|
Ингибирование активности каспазы-2 в клетках Т-клеточной лимфомы человека Jurkat при помощи переключающего сплайсинг олигонуклеотида к её пре-мРНК
1Институт биомедицинской химии им. В.Н. Ореховича, 119121, Москва, ул. Погодинская, 10; *e-mail: zhdanovdd@mail.ru Ключевые слова: каспаза-2; альтернативный сплайсинг; переключающий сплайсинг олигонуклеотид; ферментативная активность DOI: 10.18097/BMCRM00108 ВВЕДЕНИЕ
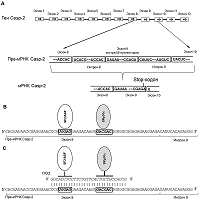
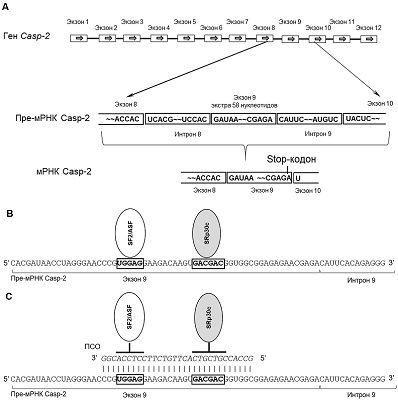
Каспазы представляют собой семейство цистеиновых протеаз, осуществляющие протеолиз белков-субстратов после аспарагиновой кислоты в аминокислотной последовательности. Помимо расщепления различных белков-предшественников (например, ряда воспалительных цитокинов), каспазам принадлежит важная роль в процессах почечной смерти. Каспазы являются инициаторными, медиаторными и эффекторными молекулами в процессе развития апоптоза и играют определяющую роль в регуляции гибели клеток [1]. Каспаза-2 (Caspase-2, ген Casp-2) является одной из наиболее эволюционно консервативных каспаз и обладает свойствами как инициаторных, так и эффекторных каспаз [2]. Регуляция функции Casp-2 включает альтернативный сплайсинг (АС) её мРНК. Известно два сплайс-варианта Casp-2: Casp-2L (Long Form, длинная форма) и Casp-2S (Short Form, короткая форма). Полноразмерная белковая форма Casp-2L (435 аминокислотных остатков, а.о.), или ICH-1 (Interleukin-1β-converting enzyme), состоит из т.н. p19 и р12 последовательностей, необходимых для активации и каталитической активности фермента [3]. Сплайс-вариант Casp-2S содержит альтернативный не кодирующий экзон на 5’-конце мРНК, что приводит к инициации трансляции с кодирующего кодона 2 и потере 31 а.о. в области CARD домена (Caspase Recruitment Domain) на N-конце белковой молекулы [4]. Появление дополнительного кодирующего экзона 9 вызывает сдвиг рамки считывания, появление стоп-кодона на стыке экзонов 9 и 10 и укорочение белковой молекулы на 92 а.о. с С-конца белковой молекулы (рис. 1 А) [5]. В результате АС Casp-2S теряет р12 последовательность и ферментативную активность. Сплайс-варианты Casp-2 обладают противоположным эффектом на судьбу клеток: Casp-2L индуцирует клеточную гибель, в то время как Casp-2S подавляет апоптотические процессы [6]. Casp-2L экспрессируется в большинстве тканей, в то время как Casp-2S - преимущественно в мозге, скелетных и сердечной мышцах [6, 7]. Casp-2 активируется в клеточных линиях Т- и В- лимфоцитов человека при стимуляции CD95 рецептора [8]. Известно участие некоторых факторов сплайсинга в регуляции АС Casp-2: hnRNPA1 (heterogeneous nuclear ribonucleoprotein A1) способствует включению экзона 9, а богатые серином и аргинином белки ASF (alternative splicing factor) и SF2 (splicing factor 2) способствуют его удалению [9]. Описано участие интронной последовательности, названной In100 [10, 11], которая взаимодействующет с пре-мРНК Casp-2 белка RBM5 (RNA binding motif protein 5) [12]. В настоящее время применение переключающих сплайсинг олигонуклеотидов (ПСО) считается одним из наиболее специфичных методов модуляции АС и ферментативной активности [13]. Ранее мы показали, что АС мРНК Casp-2 индуцируется в ответ на действие эндонуклеазы EndoG [14]. Мы предположили, что по аналогии со способностью EndoG производить активный ПСО к пре-мРНК каталитической субъединицы теломеразы hTERT (human Telomerase Reverse Transcriptase) [15] и дезоксирибонуклеазы 1 (DNase I) [16], произведённый ею ПСО способен модулировать АС Casp-2. Целью данной работы явилось изучение способность ПСО, специфичного к пре-мРНК Casp-2, модулировать её АС. МАТЕРИАЛЫ И МЕТОДЫ Культивирование клеток и трансфекция В работе использовали клетки Т-клеточной лимфомы человека линии Jurkat из коллекции клеточных культур Института биомедицинской химии им. В.Н. Ореховича. Клетки культивировали в среде RPMI-1640 («Gibco», США), содержащей 10% FSB (Fetal Serum Bovine, «Thermo Fisher Scientific Inc.», США) при 37°С в атмосфере с 5% CO2 и 95% влажности. Для трансфекции клеток ПСО или контрольным нуклеотидом (табл. 1 «Синтол», Россия) использовали Oligofectamine Reagent («Invitrogen», США), следуя протоколу компании производителя.
Все олигонуклеотиды содержали химические модификации для защиты от действия внутриклеточных РНКаз: 2’-O-(2-метокси)этил рибозу (2’MOE), фосфоротиоатный остов, и 5’-метилцитозин как описано в [17]. Все олигонуклеотиды были конъюгированы с флуоресцентным красителем Cy5.5. Поиск в программе BLAST не выявил других участков в геноме человека, комплементарных ПСО. Эффективность трансфекции EGPO оценивали методом проточной цитометрии при подсчёте Cy5.5-положительных клеток, меченых антителами к CD4+ («Miltenyi Biotec», Германия) при помощи проточного цитометра MACS Quant Analyzer 10 («Miltenyi Biotec»). Количество олигонуклеотидов внутри клеток определяли по уровню средней интенсивности флуоресценцции (mean fluorescence intensity, MFI) Cy5.5-положительных клеток. Экстракция РНК и ОТ-ПЦР в реальном времени Тотальную РНК из клеток выделяли с помощью PureLink RNA mini kit («Thermo Fisher Scientific Inc.», США), следуя протоколу компании-производителя. Реакцию обратной транскрипции (ОТ) проводили в 25 мкл реакционной смеси MMLV RT kit («Evrogen», Россия), используя 5 мкг тотальной РНК и протокол компании-производителя. В качестве реакционной смеси для ПЦР в реальном времени использовали qPCRmix-HS SYBR («Evrogen»). Праймеры («Evrogen») представлены в таблице 2.
Для амплификации применяли систему детекции ПЦР в реальном времени DTPrime 5 («ДНК-технология», Россия). Использовали двухтемпературный режим реакции (отжиг праймеров/элонгация). Количество амплификатов определяли по флуоресценции в конце цикла элонгации. Оценку качества амплификации проводили по анализу кривой плавления от 60°C до 95°C в конце реакции (после 35-го цикла). Стандартные кривые эффективности ПЦР строили по серийным разведениям суммарных кДНК (1:40, 1:80, 1:160 и 1:320). Вычисление относительной концентрации РНК проводили по DTPrime 5 («ДНК-технология»). Уровни мРНК изучаемых генов или их сплайс-вариантов нормировали по мРНК конститутивно экспрессируемого референсного гена: 18S рибосомной РНК. Определение ферментативной активности Casp-2 Определение ферментативной активности Casp-2 в клеточных лизатах проводили в 96-ти луночном планшете из темного пластика («Corning», США) при помощи Caspase 2 Assay Kit (Fluorometric, «Abcam», США) следуя протоколу производителя. Измерение флуоресценции осуществляли в планшетном спектрометре MultiscanGo («Thermo Scientific») при длинах волн возбуждения и эмиссии 400 нм и 505 нм соответственно. Статистический анализ Статистический анализ результатов осуществляли, используя критерий Стьюдента при помощи программы Statistica 9.0 («StatSoft Inc.», США). Результаты представляли в виде средних значений ± стандартное отклонение. Значения считали статистически достоверными при p ≤ 0.05. МАТЕРИАЛЫ И МЕТОДЫ Для того чтобы индуцировать АС мРНК Casp-2, клетки линии Jurkat трансфицировали 30-членным олигонуклеотидом, комплементарным 3’-концевой области экзона 9. Два регуляторных участка, являющихся сайтами взаимодействия с регулирующими сплайсинг белками, расположены в данной области: UGGAC (сайт связывания белка SF2/ASF) и GACGAC (сайт связывания белка SRp30c) (рис. 1 В). Трансфекция клеток ПСО к пре-мРНК Casp-2 приводила к блокированию взаимодействия данных белков со своими сайтами связывания (рис. 1 С).
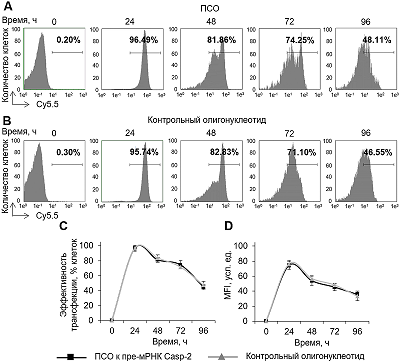
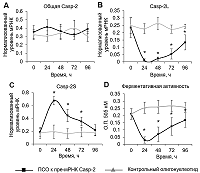
Индукция АС Casp-2 и ингибирование ферментативной активности при помощи ПСО Уровень трансфекции клеток, определённый методом проточной цитометрии, приближался к 100% через 24 ч после трансфекции (рис. 2 А – C). При культивировании клеток наблюдали постепенное снижение эффективности трансфекции. Через 96 ч эффективность трансфекции составила 45.23 – 49.02%. Также обнаружено постепенное снижение внутриклеточного содержания олигонуклеотидов, детектированное по уровню MFI (рис. 2 D). Не выявлено значительных отличий в эффективности трансфекции и уровнях MFI в клетках, трансфицированных ПСО или контрольным 30-членным олигонуклеотидом.
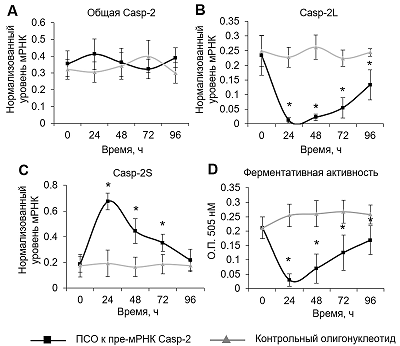
Определение уровня экспрессии сплайс вариантов мРНК Casp-2 методом ОТ-ПЦР в реальном времени не обнаружило изменения количества мРНК обшей Casp-2 при трансфекции клеток ПСО или контрольным олигонулеотидом (рис. 3 А). Трансфекция клеток ПСО вызывала индукцию АС мРНК Casp-2. Выявлено снижение уровня мРНК полноразмерного сплайс-варианта Casp-2L (рис. 3 B) и повышение количества мРНК укороченного варианта Casp-2S (рис. 3 C). Изменение пропорции сплайс-вариантов сопровождалось уменьшением ферментативной активности Casp-2 в трансфицированных ПСО клетках (рис. 3 D).
Снижение ферментативной активности Casp-2, вероятно, является следствием пониженной экспрессии полноразмерной формы Casp-2L, поскольку именно полноразмерный вариант обладает каталитической активностью. Следует отметить, что индукция АС и ингибирование активности Casp-2 достигало максимальных значений через 24 ч после трансфекции. Постепенная нормализация данных параметров происходила при дальнейшем культивировании клеток: уровень мРНК Casp-2L и её ферментативная активность постепенно повышались, в то время как уровень мРНК Casp-2S постепенно снижался и к концу периода наблюдения достигал значения контрольных клеток. Данная нормализация АС и ферментативной активности согласуется с постепенным понижением эффективности трансфекции и уровня MFI в культивируемых клетках. ОБСУЖДЕНИЕ На сегодняшний день наиболее специфичным способом модуляции АС и управления соответствующими клеточными процессами является использование ПСО. ПСО представляют собой молекулы из нуклеотидов или нуклеотидных аналогов, которые способны специфически взаимодействовать с комплементарной последовательностью. Следует отметить, что все ПСО являются синтетическими молекулами, и фактов их природного существования найти до сих пор не удавалось. Типичный размер ПСО составляет 15–30 нуклеотидов, что обеспечивает высокую степень специфичности к таргетному участку и их относительно невысокую молекулярную массу, облегчающую проникновение внутрь клеток. Взаимодействие ПСО с таргетным участком перекрывает доступ субъединицам сплайсосомы к сплайс-сайтам или регуляторным SR-белкам к цис-последовательностям на цепи пре-мРНК (рис. C1). Таким образом, ПСО способны индуцировать делецию или включение экзонов в конечный мРНК транскрипт [18]. В настоящее время исследуется возможность применения ПСО с целью терапии множества патологических состояний [19], в т.ч. и опухолевых заболеваний. Мы изучили способность олигонуклеотида, комплементарного области на экзоне 9 пре-мРНК Casp-2, индуцировать АС. Обнаружено снижение уровня мРНК полноразмерного варианта Casp-2L и увеличение количества мРНК укороченного сплайс-варианта Casp-2S (рис. C2). Последний образуется в результате появления стоп-кодона из-за сдвига рамки считывания при включении дополнительного кодирующего экзона 9 [4]. Изменение пропорции сплайс-вариантов Casp-2 приводило к ингибированию активности этого фермента. ВЫВОДЫ В данной работе показано, что активность Casp-2 можно ингибировать при помощи 30-членого олигонуклеотида, способного индуцировать АС её мРНК. Возможно, что в дальнейшем данный олигонуклеотид может стать противоапоптотическим агентом и найти применение в биомедицине в качестве цитопротектора. Кроме того, полученные результаты подтверждают определяющую роль участка на конце экзона 9 в регуляции АС мРНК Casp-2. ФИНИНСИРОВАНИЕ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013-2020 годы. ЛИТЕРАТУРА
|