|
СОДЕРЖАНИЕ |
Способность экстракта икры окуня и лиофилизата овариальной жидкости осетра ускорять восстановление фибробластов после стресс-индуцированного преждевременного старения
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича,
119121 Москва, ул. Погодинская, 10 стр. 8, *e-mail: viktoria.shumyantseva@ibmc.msk.ru
2 ООО «ЧНИОРХ», 192239, Санкт-Петербург, пр-кт Славы, д. 21, оф. 83
Ключевые слова: фибробласты; преждевременное старение; окислительный стресс; икра рыб; овариальная жидкость рыб DOI: 10.18097/BMCRM00011 ВВЕДЕНИЕ Клеточным старением называется явление необратимой остановки пролиферации клеток [1,2]. Различают репликативное и стресс-индуцированное преждевременное старение (stress-induced premature senescence, SIPS), которые имеют целый ряд общих свойств. Наиболее широко используемым признаком клеточного старения принято считать повышенную активность β-галактозидазы (senescence-associated beta-galactosidase, SA-β-Gal). В норме SA-β-Gal проявляет активность при рН 4.0. При старении клеточной культуры происходит увеличение числа клеток, у которых этот фермент активен при рН 6.0 [3]. Клеточное старение во многом сходно с биологическим старением, происходящим в целом организме, поэтому его моделирование может с успехом использоваться при изучении механизмов процесса, а также обнаружении биологически-активных соединений, способных препятствовать старению [4]. Поскольку окислительный стресс является одним из основных факторов биологического старения, его искусственно организуют у клеточных культур для инициирования SIPS при выдерживании в растворах Н2О2 с сублетальными концентрациями [5–7]. Ткани растений и животных представляют собой ценные источники биологически-активных соединений. В настоящее время подтверждены данные о том, что растительные экстракты обладают способностью замедлять клеточное старение [5,8]. Что касается рыб, то имеются сведения об антивозрастном действии экстрактов икры белуги и лосося, полученные на культуре фибробластов человека [9,10]. Овариальная жидкость образуется у рыб путем фильтрации из плазмы крови, а также в результате секреторной активности эпителия яичников. Ее состав способствует сохранению эмбрионов и продлению периода оплодотворения, как во время естественного нереста, так и при искусственном оплодотворении [11]. Большинство белков, идентифицированных в овариальной жидкости, по-видимому, эволюционно консервативны, поскольку они также наблюдаются и у высших позвоночных [12]. Установлено, что овариальная жидкость содержит полный набор заменимых и незаменимых аминокислот [13]. Кроме того, ряд вителлогенинов в её составе способен ослаблять окислительный стресс путем поглощения свободных радикалов или посредством противомикробной и противовирусной активности [14,15]. Икра рыб является потенциальным источником низкомолекулярных соединений, улучшающих качество и продолжительность жизни, поскольку содержит витамины, белки, ненасыщенные жирные кислоты и т.д. Задачей настоящего исследования было выявить возможность влияния экстрактов икры некоторых видов рыб, а также лиофилизата овариальной жидкости на стресс-идуцированное клеточное старение и/или его последствия. В качестве модели была использована культура эмбриональных фибробластов человека, в которой преждевременное старение индуцировали инкубацией клеток с Н2О2. МЕТОДИКА Исследуемые образцы В работе были использованы овариальная жидкость сибирского осетра (Acipenser baerii), а также водные экстракты, полученные из икры щуки (Esox lucius), судака (Sander lucioperca), окуня (Perca fluviatilis), горбуши (Oncorhynchus gorbuscha). Использовали как нативную овариальную жидкость, так и пастеризованную путём нагревания до 61 ± 1°С в течение 2 ч. Осадок из жидкости удаляли центрифугированием при 6000g в течение 15 мин, после чего её лиофилизировали. Содержание белка в образцах лиофилизата определяли микробиуретовым методом после растворения в фосфатно-солевом буфере (PBS) [16]. Процедура получения экстрактов икры:
Содержание белка в лиофилизированных экстрактах определяли микробиуретовым методом после растворения в фосфатно-солевом буфере аналогично образцам лиофилизата. Культура клеток В работе использовали клетки ЛЭЧ-Т, полученные из легочной ткани 10-недельного эмбриона человека мужского пола. Клетки получены из ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава РФ. Клетки прошли контрольное обследование в полном объёме, включая определение туморогенности методом колониеобразования в мягком агаре, они чувствительны к широкому кругу вирусов, активно продуцировали интерферон. Клетки культивировали в среде DMEM с 10% FBS в 5% CO2 при температуре 37°С. Индукция клеточного старения [17] и оценка влияния образцов на процесс:
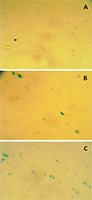
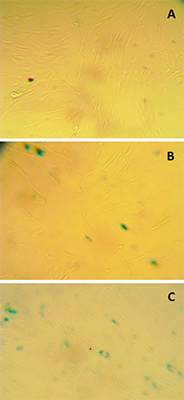
Исследование пролиферации клеток Клетки (5×103 /лунка) засевали в 96-луночные планшеты по три параллели для каждой группы. На следующий день клетки обрабатывали так же, как и для оценки старения. После инкубации в течение 96 ч в среде клетки окрашивали красителем Crystal violet и измеряют оптическую плотность при 570 нм. Результаты выражали в виде отношения оптической плотности после инкубации с образцом к оптической плотности клеток, обработанных перекисью водорода без последующего добавления образца. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Определение активности SA-β-Gal в клетках основано на появлении в цитоплазме характерных синих гранул после инкубации клеток с субстратом X-Gal при рН 6.0. После воздействия Н2О2 отмечено значительное увеличение интенсивности и числа SA-β-Gal-позитивных клеток (рис. 1). Доля окрашенных на β-галактозидазу клеток в контроле (без обработки Н2О2) варьировалась от 5 до 13% от общего числа клеток, а после воздействия Н2О2 число таких клеток возрастало до 60 – 70%.
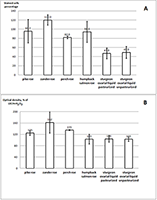
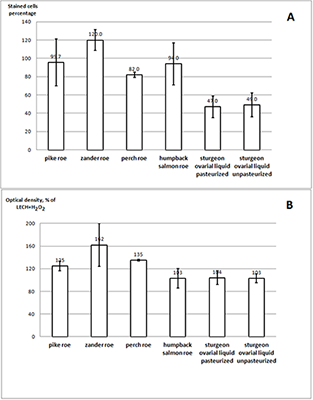
Преинкубация клеток с исследуемыми образцами до индукции клеточного старения (обработка Н2О2) не влияла на число SA-β-Gal-позитивных клеток, поэтому в ходе эксперимента оценивали способность фибробластов преодолевать последствия SIPS в присутствии исследуемых образцов. Как видно из данных, представленных на рисунке 2A, это свойство в наивысшей степени проявила овариальная жидкость, причём её пастеризация на данный эффект не повлияла. Что касается экстрактов икры, то достоверно таким действием обладал только экстракт икры окуня. На рисунке 2B приведены результаты измерения пролиферации фибробластов через 96 часов после обработки клеток Н2О2. Наблюдаемое усиление пролиферации при действии экстрактов из икры может быть связано с действием на клетки, подобным факторам роста. Ранее было показано, что экстракты мышц щуки (Esox lucius), стерляди (Acipenser ruthenus), горбуши (Oncorhynchus gorbuscha) ускоряют способность эмбриональных фибробластов человека восстанавливаться после SIPS, вызванного сублетальной концентрацией Н2О2 [18]. При этом, в отличие от мышечных экстрактов и экстракта икры окуня, лиофилизат овариальной жидкости не вызывал усиления пролиферации при снижении активности β-галактозидазы, т.е. культура клеток преодолевала последствия окислительного стресса и SIPS не за счёт увеличения их количества, а за счёт улучшения их общего состояния.
Универсальной схемы развития клеточного старения нет, и его механизм зависит, прежде всего, от стрессового фактора и используемой клеточной линии. Ниже рассмотрены вызываемые действием Н2О2 изменения, которые могут повлиять на жизнеспособность фибробластов и привести к индукции клеточного старения. Так, на культуре клеток IMR-90 (фибробласты легкого эмбриона человека) было установлено, что сразу же после обработки клеток раствором Н2О2 с сублетальной концентрацией происходит дефосфорилирование белка ретинобластомы (pRb), что сопровождается активизацией биосинтеза белков р53, р21 и р16. Кроме того, pRb участвует в индукции морфологических изменений, инициированных действием перекиси водорода [6]. При этом индукция p16 совпадала с увеличением активности SA-β-gal [7]. Считается, что р53 и p21CIP1/WAF1 играют важную роль в инициации клеточного старения, а р16INK4a передает сигналы, приводящие к необратимой остановке пролиферации [19]. В клеточной культуре наблюдается неоднородность ответа на сублетальное стрессовое воздействие: некоторые клетки могут восстанавливаться и повторно входить в клеточный цикл, тогда как у других клеток остановка пролиферации необратима, и проявляется фенотип клеточного старения. В зависимости от типа клеток, условий культивирования и стрессовых воздействий для предотвращения старения необходима инактивация либо р53-р21-pRb-, либо р16-pRb-зависимых путей по отдельности или обоих сигнальных путей, а также ключевых сигнальных белков МАР-киназного каскада: ERK1/2, р38, JNK и Akt/PKB, которые также активируются в фибробластах под действием окислительного стресса. Разнообразие биохимических каскадов, участвующих в развитии и поддержании фенотипа клеточного старения, предполагает множество мишеней в действии агентов, препятствующих старению. Так, рапамицин – ингибитор киназы mTOR – предотвращает переход обратимой остановки пролиферации к p21CIP1/WAF1-зависимому клеточному старению, как в опухолевых, так и в нормальных клетках [20,21]. Содержащийся в кожуре и косточках красного винограда ресвератрол в концентрациях, ингибирующих mTOR, также тормозит клеточное старение [22]. Исследования, проведенные in vitro и in vivo, показывают, что соединения, содержащиеся в растениях (полифенолы, флавоноиды, терпеноиды, витамины), способны активировать редокс-чувствительную Nrf2-сигнальную систему, которая усиливает экспрессию антиоксидантных генов и, тем самым, улучшает защиту от окислительного стресса и старения [2]. Например, активаторы Nrf2 обнаружены в экстрактах брокколи [8]. Широко используемый в традиционной китайской медицине камфорный гриб (Antrodia cinnamomea) содержит тритерпеноиды, способные препятствовать преждевременному старению фибробластов, активируя Nrf2-зависимые антиоксидантные гены и усиливая экспрессию SIRT-1 (NAD+-зависимую гистондезацетилазу), которая взаимодействует также с рядом молекул, включая p53 и FoxO1 [2]. Экспрессию SIRT-1 усиливают и не содержащие спирт экстракты красного вина, которые защищают клетки эндотелия от индуцированного окислительным стрессом старения на 26-40% [23]. Водные экстракты листьев, цветов и корней одуванчика (Taraxacum officinale) тормозили стресс-индуцированное старение фибробластов кожи человека, вызванного перекисью водорода, на 62%, 73% и 40%, соответственно. При этом защитное действие экстракта одуванчика не зависело от того, был ли он добавлен до или после Н2О2 [24]. Используемый в китайской медицине водный экстракт шести растений (Kangen-karyu) защищал фибробласты от стресс-индуцированного старения, как в условиях преинкубации, так и при добавлении после Н2О2. Однако количественной оценки ингибирования клеточного старения авторы не приводят [5]. В то же время, широко используемый в косметологии экстракт центеллы (Centella asiatica), добавленный к фибробластам человека, до индукции старения Н2О2 уменьшал число клеток, окрашенных на SA-β-gal, лишь на 21%, а добавленный после обработки Н2О2 вообще не влиял на число SA-β-gal-позитивных клеток [25]. В отличие от растительных экстрактов, исследованные в настоящей работе образцы оказывали защитное действие от клеточного старения только после индукции окислительного стресса. ЗАКЛЮЧЕНИЕ По результатам данной работы установлено, что биологически-активные соединения, присутствующие в экстракте икры окуня, а также в лиофилизате овариальной жидкости осетра сибирского, способны усиливать восстановление клеток после индукции их преждевременного старения, вызванного окислительным стрессом. Согласно данным наших предыдущих исследований [18], в экстракте из икры и в мышечных экстрактах присутствуют факторы роста клеток (поскольку восстановление после старения сопровождалось ростом пролиферации). Лиофилизат овариальной жидкости давал такой эффект без роста пролиферации, поэтому послестрессовое восстановление клеток было вызвано не увеличением их количества, а улучшением их состояния. БЛАГОДАРНОСТИ Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013 – 2020 годы. ЛИТЕРАТУРА
|