|
Контроль качества меченых FITC белков для интерактомных исследований методами капиллярного SDS гель-электрофореза и SPR биосенсором
Научно-исследовательский институт биомедицинской химии имени В.Н.Ореховича, Ключевые слова: поверхностный плазмонный резонанс (SPR); капиллярный гель-электрофорез; интерактомика; цитохром с; флуоресцентный краситель; FITC DOI: 10.18097/BMCRM00112 ВВЕДЕНИЕ В нашей предыдущей работе [1] были выполнены эксперименты по SEC (Size Exclusion Chromatography) - профилированию тканевого лизата и, таким образом, стало возможным составить интерактомный «паспорт» для каждого идентифицированного белка в лизате. Было выявлено, что почти три четверти всех идентифицированных во фракциях белков находятся в виде гомо- и гетеродимерных комплексах и белковых комплексах более высокого порядка. Также в работах [2, 3] был продемонстрирован оригинальный способ диссоциации интактных белковых комплексов лизата, заключающийся в кратковременной кислотной обработке лизата с последующей нейтрализацией, для увеличения чувствительности и специфичности прямого молекулярного фишинга белковых партнеров целевого белка. Вместе с тем, остается пока неизвестным, насколько отличается обычный SEC профиль белков/белковых комплексов лизата от профиля ре-ассоциированных белков обработанного лизата. Представляется удобным использовать технологию меченых красителем белков для оценки количественных и качественных различий в распределении белковых комплексов по SEC фракциям (в интактном и обработанном лизате) для некоторых целевых гем-содержащих белков. Целью данной работы была проверка применимости стандартного протокола мечения флуоресцеин изотиоционатом (FITC) гем-содержащих белков (на примере цитохрома с, 12 кДа) небольшой молекулярной массы с мониторингом включения метки в белок, а так же сохранности способности меченой формы белка взаимодействовать с белками-партнёрами. MАТЕРИАЛЫ И МЕТОДЫ Реактивы и препараты Белковый препарат цитохрома с (CYTC, сytochrome c from equine heart) приобретали от фирмы «Sigma Aldrich» (США). Белковый препарат CXXC1 (фактор транскрипции CXXC1, содержащий домен «цинковые пальцы») был получен из Института биоорганической химии НАН Беларуси. Флуоресцеин изотиоционат FITC (изомер I) был получен от «Biotium» (США). Маточный раствор FITC готовили путем его растворения в безводном ДМСО до финальной концентрации 1 мг/мл. Образец ткани печени крысы был приобретён у «Innovative Research» (USA). Приготовление лизата ткани печени крысы осуществляли при помощи буферного раствора для экстракции белков CellLytic Mammalian Tissue Lysis/Extraction Reagent (Sigma Aldrich) с добавлением коктейля ингибиторов протеаз (Sigma) по методике, описанной в работе [1]. Содержание общего белка в образцах тканевого лизата определяли по методу Бредфорда. Диссоциацию белковых комплексов тканевого лизата выполняли согласно протоколу [3]. Другие химические реактивы были аналитической чистоты и закупались от отечественных производителей. Протокол конъюгации FITC и цитохрома с Исходный препарат цитохрома с растворяли в 50 мМ боратном буфере (рН 9.0) до финальной концентрации 2 мг/мл. К 950 мкл раствора цитохрома с порциями по 10 мкл медленно добавляли раствор FITC общим объемом 50 мкл при постоянном пипетировании. Далее инкубировали смесь в течение 12 ч в холодильной камере при 6 – 8ºС в темноте. После этого для дезактивации непрореагировавшего с белком красителя к смеси добавляли раствор NH4Cl до финальной концентрации 50 мМ и инкубировали в течение 2 ч при 4ºС. Для смены буфера на гравитационных колонках PD-10 spin trap («GE Healthcare», США) инкубационную смесь переводили в PBS буфер, содержащий 10 мM Na2HPO4, 1.8 мМ KH2PO4, 137 мM NaCl, 2.7 мM KCl (рН 7.4), тем самым удаляли не связавшийся с белком дезактивированный FITC. Отношение измеренного поглощения FITC495нм/Белок280нм составило в среднем 0.40 ± 0.04 (n = 5). Капиллярный гель-электрофорез в присутствие SDS (SDS-CGE-UV) Капиллярный гель-электрофорез был выполнен на оборудовании PA 800 Plus («Beckman Coulter», США), укомплектованным UV-источником c дейтериевой лампой и фотодиодным детектором PDA (Photo Diode Array Detector, «Beckman Coulter»), с использованием непокрытого кремниевого капилляра с внутренним диаметром 75 мкм и общей длиной 30.2 см (эффективная длина 20 см) («Beckman Coulter»). К 10 мкл образца добавляли 85 мкл SDS-Sample Buffer (Beckman Coulter), 5 мкл 2-меркаптоэтанола (99%) и денатурировали в течение 5 мин на кипящей водяной бане. Для дифференциальной детекции анализируемых компонентов (белок и FITC) в образцах использовали длину волны 214 нм поглощения пептидных связей цитохрома с и 495 нм (пик поглощения FITC). Регистрировали спектр поглощения продуктов электрофореза в диапазоне длин волн 190 – 600 нм. Процедуры SDS-CGE-UV выполняли согласно рекомендациям производителя: 1) Промывка капилляра, его заполнение гелем и кондиционирование Rinse - Pressure Value: 20.0 psi Duration: 10.00 min Summary: forward Description: NaOH 0.1 М Rinse - Pressure Value: 20.0 psi Duration: 5.00 min Summary: forward Description: HCl 0.1 М Rinse - Pressure Value: 20.0 psi Duration: 2.00 min Summary: forward Description: H2O Rinse - Pressure Value: 80.0 psi Duration: 10.00 min Summary: forward Description: GEL Wait Time: Duration: 0.00 min Description: H2O Separate - Voltage Value: 15.0 kV Duration: 15.00 min Summary: Override, reverse 5.00 Min ramp 2) Разделение компонентов пробы в геле Inject - Voltage Value: 10.0 kV Duration: 90.0 sec Summary: Override, reverse Wait Time: Duration: 0.00 min Description: H2O Wait Time: Duration: 0.00 min Description: H2O Separate - Voltage Value: 15.0 kV Duration: 120.00 min Summary: Override, reverse 1.00 Min ramp Channel data rate: 4 Hz 3) Промывка капилляра после окончания анализа Rinse - Pressure Value: 80.0 psi Duration: 10.00 min Summary: forward Description: H2O Rinse - Pressure Value: 20.0 psi Duration: 10.00 min Summary: forward Description: NaOH Rinse - Pressure Value: 20.0 psi Duration: 5.00 min Summary: forward Description: HCl Rinse - Pressure Value: 20.0 psi Duration: 2.00 min Summary: forward Description: H2O Rinse - Pressure Value: 40.0 psi Duration: 5.00 min Summary: forward Description: Air
Поверхностный плазмонный резонанс (SPR) Все SPR измерения выполняли при 25°C в 8-ми канальном оптическом биосенсоре Biacore 8K («GE Healthcare»). Ковалентную иммобилизацию белков CXXC1 и цитохрома с за свободные аминогруппы на поверхности белка выполняли на оптическом чипе СМ5 серии S по стандартному протоколу. В качестве рабочего буфера использовали HBS-EP+ (10 мМ HEPES (pH 7.4), 150 мМ NaCl, 3 мМ ЭДТА, 0,05% v/v Tween-20. Инжекции белковых аналитов выполняли в течение 10 мин при скорости 10 мкл/мин, регенерацию поверхности оптического чипа выполняли раствором содержащим 1M NaCl и 0.2% CHAPS в течение 30 с при скорости потока 25 мкл/мин. Инжекции образцов лизата печени крысы (разбавленного рабочим буфером в 25 раз) выполняли в течение 3 мин при скорости потока 25 мкл/мин. Уровни связывания аналитов с поверхностью на выходных данных биосенсора (сенсограммах) представлены в RU, а 1 RU (resonance unit) соответствует связыванию 1 пг белка на 1 мм2 поверхности чипа. Образцы цитохрома с (без метки и с меткой) для сравнительного анализа предварительно выравнивали по содержанию общего белка, измеренного спектрофотометрически по методу Бредфорда. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Для исследования белок-белковых взаимодействий в растворе с использованием белков, ковалентно конъюгированных с низкомолекулярными флуоро- и люминофорами (метками), важно соблюдать баланс между чувствительностью детекции (оптимальное мольное соотношение метка/белок) и сохранением способности меченого белка взаимодействовать с другими белками. Ещё одним лимитирующим фактором может быть взаимное тушение флуоресценции при большом числе меток на одну молекулу белка, что особенно актуально при мечении белков небольшой молекулярной массы (менее 20 кДа). На первый взгляд, относительно FITC, который произвольно связывается с поверхностными аминогруппами остатков лизина белка, логично предположить о существовании параллели между числом молей ковалентно связанной метки и числом закрытых меткой аминогрупп. В данной ситуации может закономерно проявиться вероятное влияние модифицированных меткой аминокислотных остатков белка на его связывающую способность, что, в частности, уже было показано для цитохрома с [4]. Тем не менее, как было недавно подтверждено масс-спектрометрией UHPLC-ESI-TOF-MS, эффективность процедуры мечения разных белков составила всего от 3 до 30% с использованием стандартных протоколов мечения и флуоресценция на моль белка не была пропорциональна количеству остатков лизинов [5].
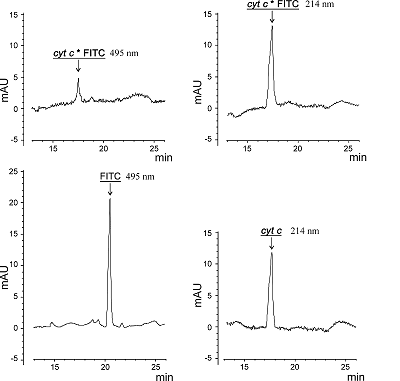
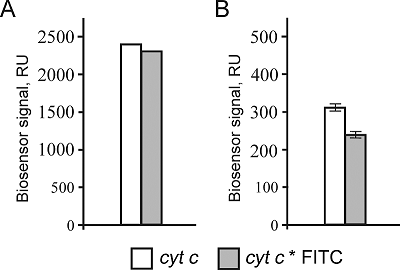
SDS-CGE-UV метод использовался для контроля конъюгации цитохрома с с FITC по принципу «да-нет» и контроля отсутствия примесей не связавшейся метки в финальном препарате меченного белка. В первом случае, детектировали не содержащий метки цитохром с по времени появления пика на длине волны 214 нм, во втором определяли время выхода свободного FITC (пик поглощения на длине волны 495 нм), во третьем – время выхода меченого цитохрома с (пики поглощения на длинах волн 214 и 495 нм) (рис. 1). Важно отметить, что подвижность в геле (время выхода пика с максимумом поглощения при длине волны 214 нм на 17.3 мин) немеченой и меченой FITC форм цитохрома c не менялась (рис. 1). Из рисунка 1 следует, что на 17.3 мин (время выхода цитохрома c) помимо поглощения по 214 нм, наблюдается так же поглощение на длине волны 495 нм (максимум поглощения FITC), что является подтверждением включения метки в белок. Также на электрофореграмме меченого FITC цитохрома с (рис. 1) видно, что пик поглощения на длине волны 495 нм на 20.5 мин (свободный FITC) отсутствует. Этот факт говорит о достижении полной очистки финального белкового препарата от непрореагировавших молекул FITC. Как было отмечено выше, для интерактомных исследований следует убедиться, что включение метки не оказывает существенного влияния на свойства самого белка и его белок-белковые взаимодействия. Принимая во внимание, что существенный избыток молекул FITC на поверхности небольшого по молекулярному весу белка может значительно ограничивать доступные для белковых взаимодействий участки, мы использовали SPR анализ для сравнительного анализа связывания разных форм цитохрома с (без метки и меченного FITC) в описанных ниже экспериментах. Во-первых, были оценены количества ковалентно иммобилизованного на чипе цитохрома с, как без метки так и меченого FITC. Из рисунка 2А следует, что фактически отсутствует разница в уровнях иммобилизации на карбоксилированной поверхности чипа обеих форм цитохрома с за аминогруппы белка. Так как именно поверхностные аминогруппы задействованы при карбодиимидной иммобилизации, значит можно косвенно говорить, что на поверхности меченого FITC белка все-таки остается такое количество свободных от красителя аминогрупп, при котором отсутствует влияние на эффективность ковалентной посадки на чип.
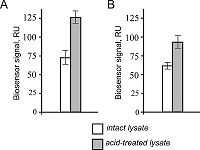
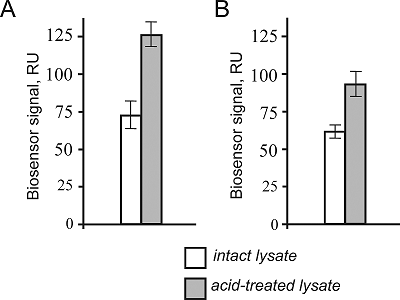
Во-вторых, была оценена эффективность взаимодействия цитохрома с с ранее установленным его белком партнером CXXC1 [6]. Для этого СXXC1 был иммобилизован на оптическом чипе по стандартному протоколу иммобилизации за аминогруппы белка, а образцы цитохрома с (без метки и меченая FITC форма) вводились в качестве аналита (в растворе) (рис. 2B). Возможно, что взаимодействие CXXC1/CYTC является очень чувствительным к изменению общего поверхностного заряда цитохрома с, что могло бы объяснить почти 30%-ное снижение связывания меченого FITC цитохрома с с иммобилизованным на поверхности чипа CXXC1. В-третьих, в двухканальной биосенсорной системе с разными иммобилизованными формами цитохрома с (без метки и меченого FITC) были оценены уровни связывания белкового материала из образцов интактного лизата печени и лизата, обработанного кислотой/восстановленного (для диссоциации всех белковых комплексов). Так, из рисунка следует, что имеет место некоторое падение уровней связывания белкового материала из лизата печени крысы с иммобилизованным цитохромом с конъюгированным с FITC, что согласуется с падением уровней связывания для белок-белкового взаимодействия CXXC1/CYTC.
Таким образом, в представленной работе мы, используя ряд экспериментов с применением двух методик капиллярного гель-электрофореза и SPR биосенсора, подтвердили, что оптимизированный стандартный протокол ковалентного мечения красителем по поверхностным аминогруппам гем-содержащих белков применим для подготовки подобных меченых белков к использованию в интерактомных исследованиях. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей. При использовании тканей животных были соблюдены все применимые международные, национальные и институциональные принципы БЛАГОДАРНОСТИ Экспериментальная часть работы на оптическом биосенсоре была выполнена на оборудовании ЦКП "Протеом человека" Института биомедицинской химии им. В.Н. Ореховича (финансовая поддержка в рамках соглашения № 075-15-2019-1502 от 5 сентября 2019 года). ФИНАНСИРОВАНИЕ Работы по капиллярному электрофорезу были выполнены при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант РФФИ № 18-04-00071). ЛИТЕРАТУРА
|