|
Оптимизация протокола получения экзосом и секретома клеток колоректальной аденокарциномы линии Caco-2 из кондиционированной среды для последующего масс-спектрометрического анализа
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: экзосомы; секретом; внеклеточные везикулы; масс-спектрометрия; протеомика DOI: 10.18097/BMCRM00118 ВВЕДЕНИЕ
Белки, выделяемые опухолевыми клетками в составе экзосом или напрямую в межклеточное пространство (секретом), отражают молекулярные характеристики клеток-продуцентов и являются потенциальными маркерами злокачественных заболеваний. В организме человека секретируемые белки могут попадать в кровь, где их можно зарегистрировать. Панорамный масс-спектрометрический (МС) анализ представляет собой высокочувствительный, производительный и специфичный метод для профилирования протеома экзосом и секретома. На этапе скрининга потенциальных биомаркеров важно получить наиболее полное представление о секретируемом протеоме, но наличие в плазме крови высокопредставленных компонентов, таких как альбумин и иммуноглобулины, затрудняет детекцию низкокопийных белков в режиме панорамной масс-спектрометрии. Использование модельного объекта, например кондиционированной среды, в которой культивируют опухолевые клетки человека, позволяет осуществлять поиск секретируемых маркеров на фоне более простой биологической матрицы. Одновременное выделение экзосом и секретома из одного начального объема среды является актуальной задачей, решение которой позволит получить более полное представление о белках, выделяемых опухолевыми клетками во внешнюю среду. При этом нужно учитывать технические детали, сопряженные с получением как экзосом, так и секретома, влияющие на эффективность последующего МС анализа. В первую очередь, для культивирования опухолевых клеток человека в среду кондиционирования добавляют фетальную бычью сыворотку (ФБС), сильно интерферирующую с масс-спектрометрическим анализом. ФБС содержит большое количество биологически активных веществ, в том числе факторов роста, гормонов, транспортных белков, микроэлементов и детоксикантов, необходимых для роста и деления культивируемых клеток человека [1]. В то же время ФБС содержит экзосомы и белковые комплексы животного происхождения, которые препятствуют детекции и идентификации низкокопийных белков секретома и экзосом, происходящих из опухолевых клеток человека. Также высокая консервативность аминокислотных последовательностей белков, а, следовательно, и протеотипических пептидов млекопитающих приводит к ложноположительным идентификациям компонентов ФБС как белков плазмы крови человека. При культивировании клеток для выделения экзосом используют ФБС, специально обедненную внеклеточными везикулами, а белковые комплексы удаляют с использованием аффинной хроматографии, преципитации или дифференциального центрифугирования в градиенте плотности сахарозы или йодиксанола. Для получения секретома подобные подходы к очистке от белковых компонентов ФБС оказываются неэффективными, поэтому опухолевые клетки человека культивируют в истощенной по сыворотке среде. Первые пассажи клеток растят в присутствии ФБС до достижения уровня конфлюэнтности порядка 60 – 70%, после чего клетки культивируют в среде без добавления сыворотки в течение 24 ч [2, 3]. Подобная техника позволяет получить относительно чистый препарат секретома, однако нужно учитывать, что отсутствие ФБС в среде культивирования является стрессовым фактором, влияющим на гомеостаз и метаболизм клеток, в том числе на количественный и качественный состав секретируемых белков. Кислотно-основной индикатор феноловый красный и соли, содержащиеся в среде кондиционирования, негативно влияют на эффективность электроспрейной ионизации, что приводит к снижению чувствительности масс-спектрометрического метода. Данные интерферирующие компоненты удаляют за счет ультрафильтрации, диализа или преципитации белков трихлоруксусной кислотой [2]. Для эффективного протеомного анализа экзосом опухолевых клеток также важно сохранение целостности внеклеточных везикул, что, как показало недавнее исследование [4], может быть достигнуто за счет уменьшения количества циклов ультрацентрифугирования и применения ультрафильтрации. Учитывая все факторы, описанные выше, в данной работе мы применили сочетание ультрафильтрации, ультрацентрифугирования и ультрацентрифугирования с использованием сахарозной подушки для одновременного выделения экзосом и секретома клеток линии Caco-2. Данный подход был применен к кондиционированной среде с добавлением ФБС и без неё. Кроме того, мы применили протокол, сочетающий два последовательных цикла ультрацентрифугирования и один цикл ультрацентрифугирования с использованием сахарозной подушки для выделения экзосом из кондиционированной среды с добавлением ФБС. МАТЕРИАЛЫ И МЕТОДЫ Культивирование клеточных линий
Клеточная линия аденокарциномы толстой кишки – Caco-2 – была получена из банка клеточных культур Института биомедицинской химии им. В.Н. Ореховича (ИБМХ). Культивирование до монослоя проводили в атмосфере 5% СО2 при 37°С, среде DMEM/F-12 без глутамина («ПанЭко», Россия), с добавлением 20% ФБС («Thermo Fisher Scientific», США), 1% GlutaMAX («Thermo Fisher Scientific»), 1% незаменимых аминокислот (NEAA, «Thermo Fisher Scientific»), 1% антибиотиков-антимикотиков (амфотерицин B 0.25 мкг/мл, пенициллин G 100 единиц/мл, стрептомицин 100 мкг/мл.). Когда клетки достигали состояния монослоя, их дважды промывали PBS (фосфатно-солевой буферный раствор) и заменяли культуральную среду на безэкзосомальную (с добавлением сыворотки, предварительно отчищенной от экзосом методом ультрацентрифугирования при 100000 g в течение 14 ч) или бессывороточную (без добавления ФБС). Для дальнейшего анализа культуральную среду отбирали через 24 ч. Снятие клеток с культуральных флаконов осуществляли путем инкубации в присутствии 2 мл трипсин-ЭДТА в течение 5 – 10 мин при 37°С. Количество клеток измеряли с помощью счетчика клеток и анализатора жизнеспособности клеток - TC20™ Automated Cell Counter («BioRad», США) и набора для подсчета клеток («BioRad»). Одновременное выделение экзосом и секретома из одного начального объема среды Выделение экзосом Изучив литературные данные, описывающие методы выделения экзосом [4], мы решили применить стратегию, включающую следующие этапы: (1) осаждение клеточного дебриса путем центрифугирования при 1000 g в течение 15 мин при температуре 4°С (центрифуга Allegra X-15R Centrifuge, «Beckman Coulter», США), ротор SX4750A Swinging Bucket Rotors («Beckman Coulter»); (2) осветление среды кондиционирования с помощью фильтра с порами размером 0.2 мкм («Merck Millipore», США); (3) концентрирование среды кондиционирования до объема 500 мкл с помощью центрифужных фильтров с отсечением 100 кДа («Merck Millipore Amicon», 100K, США) путем центрифугирования при 3500 g в течение 30 мин при температуре 4°С (центрифуга Allegra X-15R Centrifuge с использованием ротора SX4750A Swinging Bucket Rotors, «Beckman Coulter»). Фильтрат далее использовали для получения секретома, а фракцию на фильтре подвергали (4) 1 циклу ультрацентрифугирования при скорости 100000 g в течение 90 мин при температуре 4°С (центрифуга Optima MAX-XP Ultracentrifuge с использованием ротора TLA-55, «Beckman Coulter»), полученный осадок растворяли в 50 мкл 0.015% холата натрия в 0.1 M калий-фосфатном буфере (pH 7.4) и наслаивали на 26% раствор сахарозы в калий-фосфатном буфере (r = 1.1082 г/мл) с последующим ультрацентрифугированием при 120000 g в течение 120 мин при температуре 4°С. Сахарозный раствор отбирали, высушивали на роторном испарителе с последующим переосаждением белка с помощью метанол-хлороформной экстракции, как описано ранее [5]. Осадок белка сахарозной фракции и экзосомальную фракцию перерастворяли в буфере, содержащем 1% SDS в 100 мМ Tris-HCl (pH 7.4), и подвергали воздействию ультразвука с помощью ультразвукового дезинтегратора со щупом Bandelin Sonopuls («Bandelin Electronic GmbH & Co. KG», Германия) с мощностью 30% в течение 1 мин во льду. Затем центрифугировали в течение 20 мин при 14000 g и температуре 4°С. В полученных образцах определяли концентрацию общего белка колориметрическим методом с помощью коммерческого набора PierceTM BCA Protein Assay Kit («Pierce», США) в соответствии с рекомендациями производителя. Получение препарата секретома Фильтрат, полученный после центрифугирования среды через фильтры с отсечением 100 кДа («Merck Millipore Amicon», 100K), переносили на центрифужные фильтры с отсечением 5 кДа («Agilent Technologies», 5K, США) и концентрировали путем центрифугирования при 3500 g в течение 30 мин при температуре 4°С (центрифуга Allegra X-15R Centrifuge с использованием ротора SX4750A Swinging Bucket Rotors, «Beckman Coulter»). Далее концентрат высушивали на роторном испарителе с последующим переосаждением белка с помощью метанол-хлороформной экстракции, как описано ранее [5]. Белковый преципитат перерастворяли в буфере, содержащем 1% SDS в 100 мМ Tris-HCl (pH 7.4), и подвергали воздействию ультразвука с помощью ультразвукового дезинтегратора с щупом Bandelin Sonopuls с мощностью 30% в течение 1 мин во льду. Затем центрифугировали в течение 20 мин при 14000 g и температуре 4°С. В полученных образцах определяли концентрацию общего белка колориметрическим методом с помощью коммерческого набора PierceTM BCA Protein Assay Kit в соответствии с рекомендациями производителя. Для среды кондиционирования без добавления ФБС (w/oFBS) и содержащей ФБС (wFBS) процедуру выделения экзосом и секретома выполняли одинаковым образом в двух повторах для каждого типа среды. Препараты от одного повтора выделения экзосом и секретома (Exo_w/oFBS1, Sec_w/oFBS1, Exo_wFBS1, Sec_wFBS1) префракционировали в полиакриламидном геле с последующим гидролитическим расщеплением трипсином. Препараты от второго повтора выделения экзосом и секретома (Exo_w/oFBS2, Sec_w/oFBS2, Exo_wFBS2, Sec_wFBS2) использовали для гидролитического расщепления на концентрирующих фильтрах. Кроме того, для каждого типа среды были получены образцы сахарозной фракции (Suc_w/oFBS1, Suc_w/oFBS2, Suc_wFBS1, Suc_wFBS2).
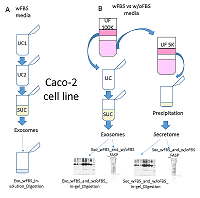
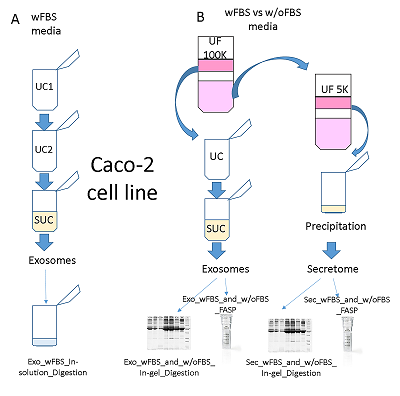
Гидролитическое расщепление препаратов экзосом и секретома Одномерный гель-электрофорез и гидролитическое расщепление в геле Одномерный гель-электрофорез и окрашивание геля Кумасси осуществляли согласно стандартному протоколу. Дорожки, соответствующие образцам Exo_w/oFBS1, Sec_w/oFBS1, Exo_wFBS1, Sec_wFBS1, разрезали вручную с помощью стерильного хирургического скальпеля на 10 полос каждую. Гидролитическое расщепление в геле было проведено по протоколу, описанному Shevchenko с коллегами [6]. Гидролитическое расщепление на концентрирующих фильтрах Гидролитическое расщепление белков осуществляли согласно протоколу FASP (Filter-Aided Sample Preparation) [7] с некоторым изменениями. Образец экзосом Exo_w/oFBS1 в полном объеме и остальные образцы в количестве 100 мкг наносили на концентрирующие фильтры c отсечением 10 кДа путем центрифугирования при 11000 g в течение 15 мин при температуре 20°С. Для восстановления и алкилирования дисульфидных связей каждый образец инкубировали 1 ч в присутствии 30 мМ трис(2-карбоксиэтил)фосфина (TCEP), 50 мМ 2-хлорацетамида (САА) при комнатной температуре. Затем 5 раз промывали буфером, содержащим 8 М мочевину в 0.1 М Tris-HCl (pH 8.5) и 3 раза промывали буфером для трипсинолиза (50 мМ триэтиламмоний бикарбонат (ТЭАБ), pH 8.5) путем центрифугирования при 11000 g в течение 15 мин при температуре 20°С. Затем к каждому образцу добавляли 50 мкл 50 мМ ТЭАБ, pH 8.5, раствор трипсина с концентрацией 0.5 мкг/мкл в соотношении масса трипсина к массе общего белка 1:50, затем пробу инкубировали в течение ночи при температуре 37°С. По окончании инкубации пептиды элюировали путем центрифугирования при 11000 g в течение 15 мин при температуре 20°С и дважды промывали фильтр 100 мкл 0.1% муравьиной кислотой. В полученных образцах определяли концентрацию пептидов колориметрическим методом с помощью коммерческого набора PierceTM Quantitative Colorimetric Peptide Assay («Pierce») в соответствии с рекомендациями производителя. Пептиды высушивали и растворяли до конечной концентрации 2 мкг/мкл в 0.1% растворе муравьиной кислоты. Выделение экзосом из среды культивирования с добавлением ФБС и их гидролитическое расщепление были осуществлены, как описано ранее [8] (далее Протокол 1, p1). Панорамный MC анализ Хромато-масс-спектрометрический анализ осуществляли для каждой пробы в трех технических повторах. Пептидную смесь каждой пробы загружали на обогащающую колонку Zorbax 300SB-C18 (диаметр частиц 5 мкм, 5 мм × 0.3 мм) («Agilent Technologies) и промывали подвижной фазой С, представлявшей собой 5% раствор ацетонитрила в 0.1% муравьиной кислоте и 0.05% трифторуксусной кислоте, при скорости потока 3 мкл/мин в течение 5 мин. Пептиды разделяли на аналитической колонке Zorbax 300SB-C18 (диаметр частиц 3.5 мкм, 150 мм × 75 мкм) в градиенте подвижной фазы В, представлявшей собой 80% раствор ацетонитрила в 0.1% муравьиной кислоте при скорости потока 0.3 мкл/мин. Использовали следующие параметры градиента ацетонитрила: аналитическую колонку промывали подвижной 2% фазой В в течение 3 мин, после чего линейно увеличивали концентрацию подвижной фазы B до 40% в течение 67 мин, в течение 2 мин увеличивали концентрацию подвижной фазы B до 100%, в течение 9 мин промывали аналитическую колонку 100% подвижной фазой В, в течение 2 мин уменьшали концентрацию подвижной фазы B до 2%, в течение 7 мин аналитическую колонку уравновешивали 2% подвижной фазой В. МС анализ проводили на гибридном масс-спектрометре Q Exactive HF («Thermo Scientific»), оснащённом масс-анализатором типа орбитальная ионная ловушка (orbitrap). Максимальное время накопления 3 × 106 ионов для получения MC-скана с разрешением 60000 (для m/z = 400) в диапазоне величин m/z = 380 – 1650 в режиме положительной ионизации составляло 25 мс. Двадцать наиболее интенсивных ионов, зарегистрированных в МС-скане, выбирали для последующей фрагментации, если величина AGC target была больше 104. Использовали HCD-тип фрагментации с нормализованной энергией соударения 28%. Применяли динамическое исключение из тандемного анализа: длительность исключения составляла 60 с. Максимальное время накопления 2 × 105 ионов для получения МС/МС-скана с разрешением 15000 (для m/z = 400) в режиме положительной ионизации составляло 150 мс. Обработка МС данных МС данные загружали в программное обеспечение MaxQuant 1.5.5.0. Для идентификации белков использовали встроенный в программное обеспечение MaxQuant поисковый алгоритм Andromeda; идентификацию проводили относительно FASTA файла, содержащего аминокислотные последовательности белков человека (25-10-2019), и его инвертированного аналога для вычисления частоты ложноположительных идентификаций (FDR). В качестве фиксированной модификации использовали карбамидометилирование цистеина, в качестве вариабельной модификации - окисление метионина. Толерантность для родительских и дочерних ионов составляла 20 ppm. Для белков и пептидов пороговое значение FDR = 0.01. Количественный анализ осуществляли на основании площади под пиком родительского иона с вычислением величины LFQ с помощью встроенного в MaxQuant алгоритма [9]. Статистический анализ выполняли в программном обеспечении Perseus 1.6.0.7 («Max Planck Institute of Biochemistry», Германия). Синтез изотопно-меченых внутренних стандартов (SIS) Твердофазный пептидный синтез осуществляли на автоматическом пептидном синтезаторе Overture («Protein Technologies», Великобритания), как описано ранее [10]. При синтезе изотопно-меченых пептидов вместо обычного лизина или аргинина использовали изотопно-меченые аминокислоты Fmoc-Lys-OH-13C6,15N, или Fmoc-Arg-OH-13C6,15N («Cambridge Isotope Laboratories», США). Направленный количественный анализ экзосомальных маркеров Каждый экспериментальный образец анализировали в 3-х технических повторах. Хроматографическое разделение осуществляли с помощью системы Agilent 1200 series («Agilent Technologies»), соединённой с тройным квадрупольным масс-анализатором TSQ Quantiva («Thermo Scientific»). Образец объёмом 4 мкл, содержащий 5 мкг нативных пептидов и стандарты SIS, разделяли c использованием аналитической колонки ZORBAX SB-C18 (150 × 0.5 мм, диаметр частиц 5 мкм) в градиенте ацетонитрила со скоростью потока 20 мкл/мин. Вначале колонку уравновешивали 5% раствором B (80% ацетонитрил в 0.1% муравьиной кислоте) и 95% раствором А (0.1% муравьиная кислота) в течение 5 мин, затем концентрацию раствора В линейно увеличивали до 50% за 30 мин, после чего концентрацию раствора В увеличивали до 99% за 1 мин, и в течение 5 мин промывали колонку 99% раствором В, затем в течение 1 мин концентрация возвращалась к начальным условиям, в которых колонка уравновешивалась в течение 9 мин. Масс-спектрометрический анализ осуществляли в режиме динамического мониторинга выбранных реакций (dSRM), используя следующие настройки МС детектора: напряжение на капилляре составляло 4000 В, скорость осушающего газа (азот) составляла 7 л в мин, скорость аксилярного газа (азот) составляла 5 л в мин, температура капилляра – 350°С, окно изоляции для первого и третьего квадруполя 0.7 Да, время цикла сканирования – 1.2 с, давление газа (аргон) в ячейке соударения – 1.5мТорр. Окно времени удерживания на колонке обращённой фазы составило 3 мин для каждого прекурсорного иона. Использовались транзиции, приведенные в таблице дополнительных материалов. РЕЗУЛЬТАТЫ На рисунке 1 показан дизайн эксперимента по оптимизации протокола получения экзосом и секретома клеток линии Caco-2 из кондиционированной среды для последующего МС анализа.
Для выделения экзосом из кондиционированной среды с добавлением ФБС (wFBS) использовали подход, сочетающий два последовательных цикла ультрацентрифугирования (UC/UC) и один цикл UC с использованием сахарозной подушки (SUC) (рис. 1A). Такая схема, которую далее мы будем называть UC1-UC2-SUC, ранее была с успехом применена в нашей лаборатории для выделения экзосом из плазмы крови человека с целью дальнейшего масс-спектрометрического анализа [8]. С другой стороны, для выделения экзосом и секретома из одного начального объема кондиционированной среды мы применили комбинацию ультрафильтрации (UF), UC и UC с использованием сахарозной подушки (SUC), поскольку, как было показано ранее, замена одного из циклов UC на UF позволяет сохранить целостность внеклеточных везикул [4]. Схему UF-UC-SUC тестировали на кондиционированной среде с добавлением ФБС (wFBS) и на обедненной сывороткой среде (w/oFBS) (рис. 1B). Белки экзосом, выделенных по схеме UC1-UC2-SUC, гидролизовали в растворе (In-solution Digestion), в то время как белки экзосом и секретома, выделенных из кондиционированной среды с добавлением ФБС (wFBS) и без нее (w/oFBS) (схема UF-UC-SUC), подвергали гидролизу в геле (In-gel Digestion) либо гидролизу с использованием концентрирующих фильтров (FASP). По результатам масс-спектрометрического анализа были идентифицированы белки в образцах экзосом и секретома, выделенных по различным схемам (табл. 1).
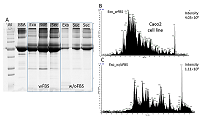
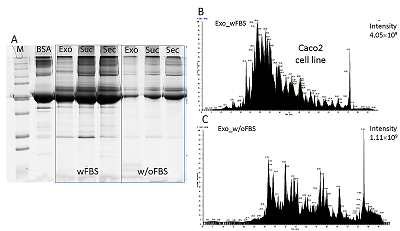
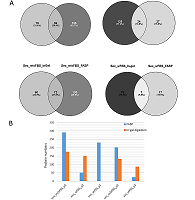
Как видно из таблицы 1, МС анализ оказался наименее эффективен для идентификации белков экзосом и секретома, выделенных из кондиционированной среды с добавлением ФБС (wFBS) и гидролизованных на концентрирующих фильтрах. Оценка контаминации препаратов секретома и экзосом белковыми комплексами ФБС Причиной малого количества идентификаций может быть контаминация препаратов секретома и экзосом белковыми комплексами ФБС. Для оценки контаминации белками ФБС при использовании протокола выделения секретируемых белков по схеме UF-UC-SUC осуществляли разделение экзосом (Exo), секретома (Sec) и, белков, задерживаемых сахарозной подушкой (Suc) в одномерном полиакриламидном геле, а также сравнивали хроматограммы общего ионного тока, полученные в результате панорамного масс-спектрометрического анализа (рис. 2).
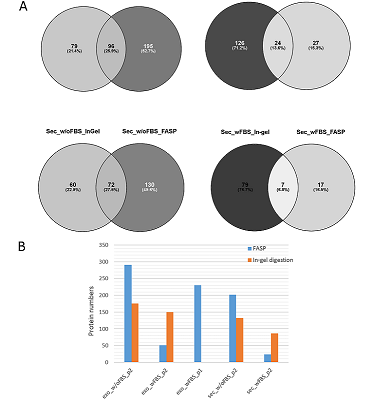
Одномерный гель-электрофорез показал значительную контаминацию белками ФБС, прежде всего альбумином, для образцов экзосом и секретома, полученных из кондиционированной среды с добавлением ФБС, по сравнение с соответствующими образцами из бессывороточной среды (рис. 2A). В то же время, сахарозная подушка задерживала белковые комплексы при выделении экзосом из кондиционированной среды как с добавлением ФБС, так и без нее. В образце экзосом, выделенном из кондиционированной среды с добавлением ФБС, был идентифицирован всего 51 белок (Табл. 1), интенсивность масс-спектрометрического сигнала (по хроматограмме экстрагированного ионного тока) для этого образца была в 4 раза выше по сравнению с таковым для экзосом, полученных из среды, обедненной по сыворотке (Рис. 2B и 2C). Тип гидролиза и полнота масс-спектрометрического анализа секретома и белков экзосом Эффективность гидролитического расщепления белков во многом определяет успех МС идентификации белков. Как видно из рисунка 3, в случае культивирования клеток Caco-2 в среде без добавления ФБС (w/oFBS) протокол гидролиза на концентрирующих фильтрах (FASP) позволяет идентифицировать в среднем на 50% белков больше как в секретоме, так и в препаратах экзосом, по сравнению с гидролизом в геле. В то же время для экзосом и секретома, выделяемых из среды с ФБС префракционирование в геле является необходимым этапом, поскольку такой подход позволяет идентифицировать 71 – 75% белков.
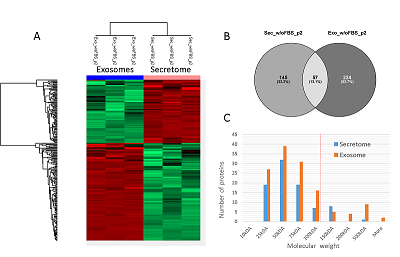
Полуколичественный анализ экзосомальных белков и белков секретома Для образцов экзосом максимальное количество идентификаций (291 белок) было получено в результате МС анализа внеклеточных везикул, полученных из кондиционированной среды без добавления ФБС по схеме UF-UC-SUC с последующим гидролитическим расщеплением на концентрирующих фильтрах (далее протокол 2, p2). На втором месте по количеству идентифицированных белков (230 белков) оказался протокол выделения экзосом по схеме UС1-UC2-SUC с последующим гидролизом в растворе (далее протокол 1, p1). Всего оба метода позволяют идентифицировать 395 белков. Диаграмма Венна на рисунке 4B показывает пересечение количества идентификаций на 31.9%, в то же время использование протокола 2 позволяет уникально идентифицировать 41.8% белков.
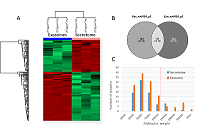
Результаты полуколичественного анализа без использования стабильных изотопных меток для образцов экзосом, выделенных двумя различными методами, показывают, что применение протокола p2 обеспечивает более высокий уровень содержания 103 белков, среди них обнаружены ALIX (FC = 2.5) и синтенин (FC = 2.7), используемые как маркеры внеклеточных везикул [11]. Содержание секретируемых белков и белков внеклеточного матрикса (локализация по материалам базы данных Uniprot www.uniprot.org) LGALS3BP (FC = 268), фибулина (FC = 72), белка-переносчика фосфолипидов PLTP (FC = 26), а также LAMP1 (FC = 22), участвующего в биогенезе экзосом [12] было повышено в 10 и более раз. Кроме того, было сильно увеличено содержание синтазы жирных кислот (FASN) (FC = 22) и белков ядерной локализации (по материалам базы данных Uniprot), таких как XRCC5, XRCC6 и преламин A/C. Подробные результаты полуколичественного анализа приведены в дополнительных материалах. Как показывает рисунок 5A, 219 белков секретома и экзосом, полученных по протоколу 2 и значимо отличающихся по содержанию (FC > 2, FDR < 0.01), разделяются на два четких кластера: содержание 86 белков больше в образце секретома, в то время как содержание 133 белков выше в образце экзосом. Из диаграммы Венна (рис. 5B) видно, что белковый состав секретома и экзосом пересекается только на 13.1% белков. Всего в секретоме и экзосомах было идентифицировано 436 белков. Как показывает гистограмма на рисунке 5C, молекулярная масса для большинства белков, которыми обогащены образцы как экзосом, так и секретома, была менее 100 кДа – отсечения по молекулярной массе, примененного на стадии UF.
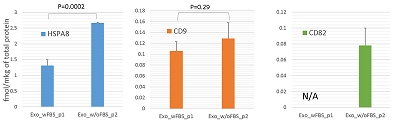
Таргетный МС анализ маркеров экзосом Эффективность выделения экзосом можно оценить по уровню содержания маркерных белков. Обычно белковые маркеры экзосом анализируют методом вестерн блота. В данном исследовании мы применили таргетный МС анализ в режиме мониторинга выбранных реакций (Selected Reaction Monitoring, SRM) для определения содержания маркеров экзосом HSPA8, CD9 и CD82 с использованием изотопно-меченных пептидных стандартов (isotopically labeled peptide standard, SIS). В образцах экзосом, выделенных по протоколу 1 и 2, содержание маркеров было на уровне 1.3 ± 0.17 фмоль/мкг и 2.6 ± 0.02 фмоль/мкг общего белка (HSPA8), 0.1 ± 0.02 фмоль/мкг и 0.13 ± 0.03 фмоль/мкг общего белка (CD9) соответственно. Маркер CD82, уровень которого при использовании метода SRM составил 0.08 ± 0.03 фмоль/мкг общего белка, был обнаружен только в экзосомах, полученных с помощью протокола 2. По результатам измерения содержание HSPA8 оказалось значимо выше в образцах экзосом, полученных по протоколу 2, в то же время не наблюдалось значимых различий в содержании CD9. (рис 6.)
ОБСУЖДЕНИЕ даление из среды кондиционирования ФБС обеспечивает снижение матричного эффекта и позволяет идентифицировать больше белков МС методом, таким образом, достигается более глубокий протеомный анализ экзосом. На качественном уровне внеклеточные везикулы, полученные из среды как с добавлением ФБС и так без нее, содержат такие компоненты экзосом как ALIX, СD63, синтенин, лактадгерин (MFGE8), что указывает на биологическую релевантность идентифицированных белков. Повышенное по данным панорамной масс-спектрометрии содержание ALIX и синтенина и регистрация маркеров экзосом CD9, CD82 и HSPA8 с помощью таргетной масс-спектрометрии также указывают на преимущество выделения экзосом из бессывороточной среды. В то же время, высокое содержание FASN, ядерных и цитозольных белков в образце экзосом, выделенных из бессывороточной среды культивирования клеток, указывает на оксидативный стресс и гибель клеток, что согласуется с литературными данными [13]. Этот факт необходимо учитывать при интерпретации результатов. Ультрафильтрация обедненной сывороткой среды культивирования клеток позволяет осуществлять анализ экзосом и секретома из одного начального объема среды. Содержание FASN в экзосомах, происходящих из бессывороточной среды, увеличено по сравнению с секретомом, выделенном в таких же условия. Молекулярная масса FASN составляет 273 кДа, что оказывается выше порога отсечения в 100 кДа, примененного на стадии UF. Это может свидетельствовать о том, что экзосомы, выделенные с применением схемы UF-UC-SUC, могут содержать высокомолекулярные компоненты секретома. Однако молекулярная масса белков, содержание которых повышено как в секретоме, так и в экзосомах, имеет похожее распределение. Молекулярная масса экзосом-специфичных белков, таких как ALIX, MFGE8, LAMP1, составляет менее 100 кДа. Секретируемые клеткой белки представляют собой источник маркеров, связанных с опухолевой прогрессией и ростом. Среди белков, идентифицированных в секретоме, обнаружены молекулы клеточной адгезии (DAG1,PODXL, LRRN4, TGFBI), цитокин IL6ST, NPC2. Ранее было показано, что TGFBI и NPC2 вовлечены в дифференцировку клеток линии Caco-2 [14]. При этом содержание DAG1,PODXL, LRRN4, NPC2 и TGFBI, по нашим данным, больше в секретоме по сравнению с протеомом экзосом. Десмоколлин (DSC1) и десмоглеин (DSG1), ассоциированные с адгезией клеток, обнаруживались в экзосомах. Таким образом, применение сочетания ультрафильтрации и ультрацентрифугирования обеспечивает глубокий протеомный анализ секретома и экзосом, выделяемых из одного начального объема кондиционированной среды без добавления ФБС. При этом культивирование клеток в отсутствии ФБС вызывает оксидативный стресс и гибель клеток, что приводит к качественным и количественным изменениям белкового состава экзосом, регистрируемым МС методом. Оптимальным протоколом для выделения экзосом из среды с добавлением ФБС оказалось сочетание трех последовательных циклов центрифугирования, последний из которых осуществляется с использованием сахарозной подушки. Для МС анализа секретома, полученного из среды с добавлением ФБС требуется предварительное префракционирование белков. БЛАГОДАРНОСТИ Эксперименты были выполнены на оборудовании ЦКП «Протеом человека» ИБМХ. ФИНАНСИРОВАНИЕ Работа выполнена при поддержке Программы фундаментальных исследований государственных академий наук на 2013-2020 годы. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ К данной статье приложены дополнительные материалы, свободно доступные в электронной версии на сайте журнала (http://dx.doi.org/10.18097/BMCRM00118). ЛИТЕРАТУРА
|