|
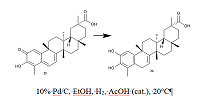
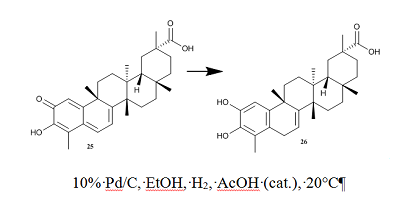
СОДЕРЖАНИЕ 1. АНТИКОРОНАВИРУСНАЯ АКТИВНОСТЬ ОТДЕЛЬНЫХ ТРИТЕРПЕНОИДОВ 2. АНТИКОРОНАВИРУСНАЯ АКТИВНОСТЬ ТРИТЕРПЕНОИД-СОДЕРЖАЩИХ ЭКСТРАКТОВ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 3 Cхема получения тритерпеноида 26 из вещества 25 гидрированием на палладии. Таблица 1Влияние тритерпеноидов на репликацию коронавирусов в клеточных культурах |
Антикоронавирусная активность тритерпеноидов
Институт технической химии Уральского отделения Российской академии наук - Ключевые слова: тритерпеноиды; коронавирус; SARS; MERS; COVID-19 DOI: 10.18097/BMCRM00127 ВВЕДЕНИЕ
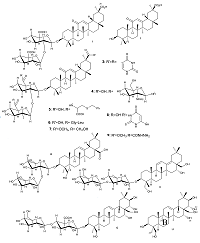
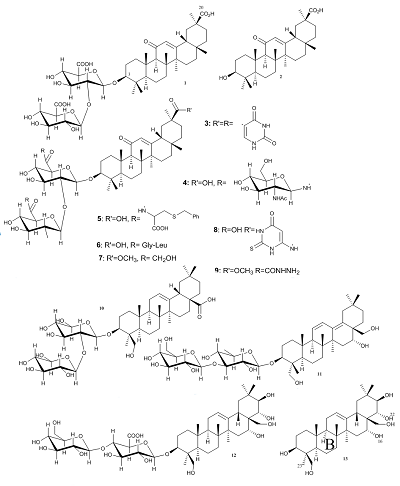
В конце 2019 года город Ухань (провинция Хубэй, КНР) стал эпицентром распространения новой коронавирусной инфекции COVID-19 (Coronavirus disease 2019), вызывающей вирусную пневмонию, а также ряд других клинических манифестаций. Международный комитет по таксономии вирусов присвоил официальное название возбудителю инфекции, относящемуся к семейству Coronaviridae (Коронавирусы) – SARS-CoV-2 (ранее известный как 2019-nCoV). Всемирная организация здравоохранения (ВОЗ) присвоила COVID-19 официальный статус пандемии 11 марта 2020 г. [1]. Пандемии COVID-19 предшествовали в 2002-2003 гг. атипичная пневмония SARS (Severe Acute Respiratory Syndrome), распространившаяся в Китае, Канаде, Сингапуре, Южной Кореи и др. [2], а также с 2013 г. по настоящее время ближневосточный респираторный синдром MERS (Middle East Respiratory Syndrome), который преимущественно охватил страны аравийского полуострова [3]. Прогнозируются повторные волны COVID-19, периодические мутации вируса, угрозы других не менее патогенных типов коронавирусов [1]. В настоящее время для лечения COVID-19 применяется терапия, эффективность которой еще должна быть обоснована в соответствии с критериями доказательной медицины («ослепленные» рандомизированные плацебо-контролируемые исследования) [1, 4]. Коронавирусы (Coronaviridae) – это большое семейство РНК-содержащих сложно организованных вирусов, объединенных в два подсемейства (Coronavirinae и Torovirinae), которые поражают человека и животных [5]. В настоящее время известно, что коронавирусы могут вызывать целый ряд заболеваний у человека. Вирусы рода Alphacoronavirus (HCoV-229E [6, 7] и HCoV-NL63 [8, 9]) и Betacoronavirus (HCoV-OC43 [10] и HCoV-HKU1 [11]) постоянно присутствуют в структуре ОРВИ, и, как правило, вызывают поражение верхних дыхательных путей легкой и средней степени тяжести. Кроме того, известны случаи тяжелого острого респираторного синдрома с летальными исходами, вызванного следующими возбудителями: SARS-CoV-2, SARS-CoV и MERS-CoV (род Betacoronavirus) [1, 4]. Из многочисленных коронавирусов животных стоит отметить вирус HCoV-PEDV (род Alphacoronavirus), вызывающий смертельную диарею у свиней, там самым нанося ущерб животноводству [12]. Тритерпеноиды являются перспективными препаратами для лечения коронавирусных инфекций, так как способны не только препятствовать проникновению вируса в клетку, но и его размножению внутри клетки. Существует ряд обзоров [13–21], затрагивающих антикоронавирусные свойства тритерпеноидов. Однако имеющиеся работы в основном посвящены антиретровирусной и цитостатической активности тритерпеноидов. Нам известна лишь одна обзорная публикация (Barnard и соавт. [22]), посвященная поиску анти-SARS-CoV активных соединений, в которой, наряду с веществами других химических классов, также рассматриваются и тритерпеноиды. Целью настоящего обзора является рассмотрение современного состояния поиска новых препаратов для лечения COVID-19 среди тритерпеноидов. Обобщены основные результаты по изучению антикоронавирусной активности тритерпеноидов, включая как индивидуальные вещества, так и растительные экстракты. Рассмотрены как природные тритерпеноиды, так и химически модифицированные производные. География проанализированных работ обширна и включает 8 стран. Среди основных научных групп следует отметить российских ученых – сотрудников Уфимского Института химии РАН. Большинство работ опубликованы, начиная с 2003 года, что связано со вспышкой атипичной пневмонии, вызванной коронавирусом SARS-CoV в 2002–2003 гг. При этом авторы работы [18] допускали возможность повторной вспышки коронавирусной инфекции SARS. 1. АНТИКОРОНАВИРУСНАЯ АКТИВНОСТЬ ОТДЕЛЬНЫХ ТРИТЕРПЕНОИДОВ Экстракт корня солодки (Glycyrrhiza glabra) используется в качестве противокашлевого лекарственного средства, что может указывать на актуальность исследования антикоронавирусной активности входящих в его состав соединений. Стоит отметить, что именно из данного экстракта был впервые выделен сапонин тритерпеновой природы – глицирризиновая кислота (glycyrrhizinic acid) (1). Известно, что данное соединение и его производные могут ингибировать размножение некоторых ДНК- и РНК-содержащих вирусов [13, 23]. В работе J. Cinatl с соавторами [24] продемонстрирована антикоронавирусная активность соединения 1 в отношении вируса SARS-CoV на клеточной линии Vero (клетки почек зеленой мартышки), вызывающего тяжелый острый респираторный синдром (ТОРС, англ. SARS). Также соединение 1 препятствует проникновению внутрь клетки и дальнейшей репликации вируса SARS-CoV в клеточной культуре Vero-E6 (вакцинная клеточная линия) с полумаксимальной эффективной концентрацией (EC50), соответствующей 370 мкM [18] . Недавно методом компьютерного докинга было показана возможность взаимодействия глицирризиновой кислоты с аминокислотами Arg559, Gln388, Arg393, Asp30 мембранного фермента ACE2 (ангиотензин-превращающий фермент 2) [25]. Поскольку ACE2 является основным рецептором для проникновения SARS-CoV-2 в клетку [26, 27], Luo Liu с соавт. [28] предположили наличие антикоронавирусной активности у глицирризиновой кислоты. Химические структуры тритерпеноидов, проявляющих антикоронавирусную активность, представлены на рисунках 1-3. Данные по влиянию тритерпеноидов на репликацию коронавирусов в клеточных культурах представлены в таблице 1.
Ранее изучалось ингибирование проникновения вируса SARS-CoV в клеточную культуру Vero и его репликации в этой культуре рядом производных, полученных путем химических модификаций глицирризиновой кислоты. Было показано, что изменение гликозидной цепи при С3-ОН и введение гетероциклических фрагментов или аминокислот при С20-СООН в соединении 1 значительно увеличивает противовирусную активность производных. Hoever и соавт. [29] показали, что гетероциклический тритерпеноид 3 в 70 раз активнее глицирризиновой кислоты в одинаковых условиях (EC50 = 5 и 365 мкM, соответственно), но при этом 3 обладает цитотоксичностью (CC50 = 15 μM), в то время как глицирризиновая кислота не проявляет выраженной токсичности. Среди ее нетоксичных производных наиболее активным является соединение 4 (EC50 = 40 мкM); десятикратное увеличение активности вещества 4 было достигнуто при введении 2-ацетамидо-β-D-глюкопиранозиламина в углеводную цепь 1. Предполагается, что глицирризиновая кислота и ее производные ингибируют процесс проникновения SARS-CoV в клетки путем присоединения N-ацетилгликозамина (для соединения 4) к углеводной части S-белков, которые необходимы для проникновения вируса в клетки. Этот вывод сделан авторами на основании отсутствия антикоронавирусной активности у продукта гидролиза глицирризиновой кислоты: соединение 2 [29, 30]. Также известны другие сапонины, относящиеся к тритерпеноидам растительного происхождения, которые обладают антикоронавирусной активностью. Данные вещества были исследованы на клеточных линиях Vero-E6 и MRC-5 (клетки легочного эпителия эмбриона человека), которые использовали в качестве клеток-мишеней для вирусной инфекции. Наиболее активным сапонином по отношению к SARS-CoV является α-Хедерин (α-hederin) [31] (10) (EC50 = 10 мкM), выделенный из чернушки посевной (Nigella sativa) [32]. Предполагается, что соединение 10 препятствует проникновению коронавируса в клетку по тому же механизму, что и глицирризиновая кислота [32]. В то же время наиболее активным веществом против другого коронавируса HCoV-229E (EC50 = 1.7 мкM) является сайкосапонин B2 (saikosaponin B2) (11), полученный из володушки серповидной (Bupleurum falcatum). Авторы предполагают, что данное соединение блокирует мембранные белки (гликопротеины) вируса, необходимые для проникновения в клетку [7, 33]. Другими тритерпеновыми сапонинами являются эсцины (escin), выделенные из лекарственного растения японский каштан (Aesculus turbinata). Интересно, что тритерпеноид 12, проявляющий наибольшую активность против коронавируса HCoV-PEDV среди нетоксичных эсцинов на клеточной линии Vero, имеет сопоставимую антикоронавирусную активность (и отсутствие цитотоксичности) со своим продуктом гидролиза 13, что позволяет предположить иной механизм антикоронавирусного действия. Действительно, проведено компьютерное моделирование (докинг) вещества 13 для оценки возможного ингибирования 3C-химотрипсин-подобной протеазы коронавируса SARS-CoV (протеаза SARS-CoV 3CL) [12]. Протеазы необходимы РНК-вирусам для процессинга, играющего важную роль в регуляции репликации вируса. Стоит отметить, что ингибирование протеазы ВИЧ-1 (HIV-1) в настоящее время является самым эффективным методом снижения вирусной нагрузки ВИЧ-инфекции [34]. В результате проведенного виртуального скрининга с применением докинга показано, что противовирусный препарат Индинавир (Indinavir), использующийся при лечении ВИЧ-инфекции, может быть ингибитором протеазы 3СLpro SARS-CoV-2 [35]. Гидроксильные группы при C22 и C16 вещества 13 образуют водородные связи с атомом кислорода карбонильной группы Glu166 протеазы SARS-CoV 3CL. Кроме того, возможны гидрофобные взаимодействия между метильной группой C23 и кольцом «B» этого вещества с Cys145 и Leu27 фермента [12].
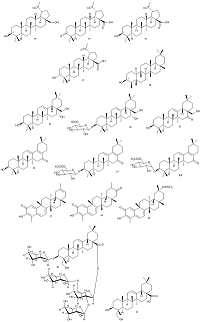
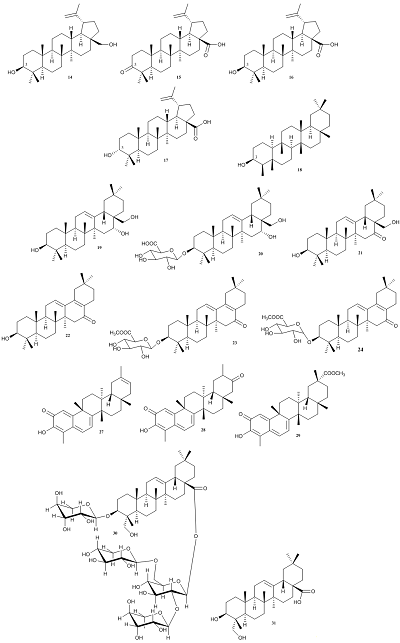
Бетулин (14) является природным тритерпеноидом лупанового ряда, который придает коре березы белый цвет. В связи с доступностью коры березы как сырья, бетулин производится в крупнотоннажных объемах, и используется в качестве исходного вещества для синтеза широкого ряда производных лупановых и олеонановых тритерпеноидов. Среди лупановых производных бетулина стоит отметить бетулоновую кислоту (15), которая является продуктом окисления бетулина, а также 3β- и 3α-бетулиновые кислоты (16, 17) – продукты восстановления бетулоновой кислоты (характеристики активности представлены в таблице 2). Производные бетулина (15–17) наиболее активно подавляли репликацию SARS-CoV в клеточной культуре Vero-E6. Согласно данным авторов работы [36], значение EC50 бетулоновой кислоты (15) составило 0.63 мкМ. Антикоронавирусная активность соединений 16, 17 была установлена только качественно; в работе приведены данные, согласно которым EC50 ≥ 10 мкМ. Стоит отметить, что данные вещества не обладают выраженной цитотоксичностью, что позволяет считать их перспективными в качестве антикоронавирусных агентов, несмотря на достаточно высокое значение EC50. Антикоронавирусная активность данных соединений может быть обусловлена двумя механизмами противовирусного действия, реализующихся на разных стадиях жизненного цикла вируса [14, 18]. Одним из механизмов является ингибирование протеазы SARS-CoV 3CL, которая играет важную роль в репликации вируса внутри клетки [37]. Другой механизм ингибирования реализуется на стадии слияния вирусных мембранных гликопротеинов с клеточными рецепторами, что препятствует проникновению вируса внутрь клетки. Стоит отметить, что механизм подавления вируса через ингибирование химотрипсин-подобной протеазы преобладает для β-3-ОН- и α-3-ОН-бетулиновых кислот 16, 17 [18, 36, 38]. Данные соединения были дополнительно протестированы in vivo путем анализа ингибирования протеазы SARS-CoV 3CL. Согласно расчетам авторов, выполненным на основе данных работ [18, 36], диастереомеры 16, 17 проявляют ингибирующее действие в отношении протеазы SARS-CoV 3CL (IC50 = 10 мкM; Ki = 8.2 ± 0.7 мкM), что указывает на конкурентный способ ингибирования и отсутствие существенного влияния стереоконфигурации у С3 на активность. В то же время, бетулоновая кислота 15 не ингибирует протеазу SARS-CoV 3CL. С использованием компьютерного докинга было показано, что соединение 16 взаимодействует с карманом связывания (substrate-binding pocket) протеазы SARS-CoV 3CL за счет образования водородной связи между C3-OH 16 и C=O Thr24 протеазы SARS-CoV 3CL. Наоборот, соединение 15 не образует иных межмолекулярных связей с ферментом, помимо гидрофобного взаимодействия [36]. Недавно M. Baglivo c соавторами [39] на основе результатов работ [40, 41] предположили наличие у бетулиновой кислоты (11) анти-SARS-CoV-2 активности, обусловленной ее взаимодействием с холестериновыми микродоменами (raft cholesterol) клеточной мембраны, таким образом препятствуя проникновению вируса в клетку.
Растение Euphorbia neriifolia является богатым источником тритерпеноидов лупанового и олеонанового рядов, в том числе и с редкой α конфигурацией у С3. В работе [42] приведено сопоставление подавления репликации коронаврируса HCoV-229E в клеточной культуре MRC-5 тритерпеноидами, выделенными из E. Neriifolia. Наибольшую активность проявил тритерпеноид 18 с β конфигурацией при С3. Из камелии японской (Camellia japonica) выделены тритерпеноиды олеонанового ряда [43, 44]. Исследовано их влияние на подавление репликации коронавируса HCoV-PEDV в клеточной культуре Vero. Соединение 19 оказалась наиболее активным ингибитором репликации вируса (EC50 = 0.06 мкM), но при этом обладающим наибольшей цитотоксичностью (CC50 = 0.81 мкM). Менее активное соединение 22 имело и более низкую цитотоксичность: EC50 = 0.28 мкM, CC50 = 12.47 мкM. Из трехкрыльника регеля (Tripterygium regelii) выделены тритерпеноиды метилиденхинонового (quinone-methide) типа. Кроме того, из вещества 25 был получен тритерпеноид 26 путем гидрирования на палладии (схема 1). В исследованиях in vitro показано, что эти вещества являются конкурентными ингибиторами протеазы SARS-CoV 3CL. Наиболее активным оказалось природное соединение 27 (Ki = 2.6 мкМ) [45]. С применением молекулярного моделирования показано, что гидроксильная группа C3-OH 27 образует прочную водородную связь с атомом кислорода карбонильной группы Cys44 и OH Thr25 в кармане связывания, тогда как для вещества 26 выявлено только гидрофобное взаимодействие [45].
2. АНТИКОРОНАВИРУСНАЯ АКТИВНОСТЬ ТРИТЕРПЕНОИД-СОДЕРЖАЩИХ ЭКСТРАКТОВ Для экстракта из жимолости японской (Lonicera japonica), используемого в Китае для лечения атипичной пневмонии [16], в клинических исследованиях показано снижение инфекционности коронавируса SARS-CoV. Антикоронавирусная активность, вероятно, связана с наличием в составе экстракта сапонина: секологанин А (loniceroside A) (30) [46] и продукта его гидролиза: гедерагенин (hederagenin) (31) [31]. Для экстракта Strobilanthes cusia продемонстрировано ингибирование репликации HCoV-NL63 в клеточной культуре LLC-MK2 (эмбриональные почечные клетки макаки-резус. Экстракт содержит бетулин (14) и другие тритерпеноиды, но до сих пор остается неясным вопрос, какой именно из компонентов обуславливает антикоронавирусную активность [9]. Экстракт упомянутого выше трехкрыльника регеля (Tripterygium regelii) представляет собой смесь олеонановых и метилиденхиноновых тритерпеноидов, которая ингибирует протеазу SARS-CoV 3CL в опытах in vitro. Вероятно, его биологическая активность связана с наличием в экстракте тритерпеноида 27 [47]. Экстракт туны китайской (Toona sinensis) содержит терпены, близкие по структуре к глицирризиновой кислоте (1). Экстракт подавляет репликацию коронавируса SARS-CoV в клеточной культуре Vero [48]. ЗАКЛЮЧЕНИЕ В настоящем обзоре мы собрали, систематизировали и проанализировали опубликованные литературные данные по антикоронавирусной активности тритерпеноидов. В настоящее время данная тема является крайне актуальной в связи с пандемией новой коронавирусной инфекции COVID‑19, вызванной вирусом SARS‑CoV‑2. Как показывает проведенный нами анализ, в литературе имеется большой объем информации (подробное описание коронавирусов, методики выделения и химической модификации тритерпеноидов, результаты молекулярного моделирования методами докинга, и т.д.), который может быть использован в различных исследованиях, направленных на изучение антикоронавирусной активности веществ этого класса. Тритерпеноиды и их производные проявляют антикоронавирусную активность путем воздействия на разные этапы жизненного цикла вирусов, включая ингибирование репликации. Тритерпеноиды, модифицированные в положении С3OH, блокируют S-белки коронавирусов, необходимые для проникновения в клетку. Тритерпеноиды взаимодействуют с холестериновыми микродоменами клеточной мембраны и/или связываются с мембранным белком ACE2, тем самым препятствуя проникновению вируса в клетку. Одной из предполагаемых мишеней действия тритерпеноидов является 3C‑химотрипсин‑подобная протеаза, которая рассматривается в качестве перспективной мишени для поиска препаратов с целью терапии SARS‑CoV‑2 инфекции. Дополнительно следует исследовать роль карбоксильной группы, которая часто содержится в тритерпеноидах, обладающих антикоронавирусной активностью. Таким образом, тритерпеноиды, обладающие антикоронавирусной активностью, могут являться перспективными фармакологическими веществами для терапии COVID-19. Представленный нами обзорный материал будет полезным исследователям, работающим в области фармации, фармакогнозии и химии биологически активных соединений. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках госзадания АААА-А18-118030790037-7. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|