|
Конструирование химерного гена реналазы человека
Научно-исследовательский институт, биомедицинской химии имени В.Н. Ореховича, Ключевые слова: ПЦР, клонирование, экспрессия, реналаза, сигнальная последовательность DOI: 10.18097/BMCRM00137 ВВЕДЕНИЕ
Реналаза (RNLS) - недавно открытый белок, который выполняет различные функции внутри и снаружи клеток [1-5]. Внеклеточная RNLS оказывает защитные эффекты на клетку, действуя, по данным ряда авторов, на свои рецепторные белки [6-8]. Внутриклеточная RNLS проявляет свойства FAD-зависимой оксидоредуктазы (КФ 1.6.3.5) [5, 9], кофактор FAD [10] которой может быть “размещён” только в полноразмерном белке, содержащем N-концевой пептид [2, 11]. Соотношение внутриклеточных и внеклеточных форм этого белка, а также механизмы и факторы, ответственные за его транспорт из клетки, остаются неизвестными. По нашим данным, внеклеточная RNLS человека лишена N-концевого сигнального пептида [11], что свидетельствует в пользу реализации классического механизма ее транспорта во внеклеточное пространство [12]. Одним из подходов для изучения соотношения внутриклеточных и внеклеточных форм RNLS может быть создание химерных форм белка с модифицированными участками его аминокислотных последовательностей. В данной работе описан метод конструирования химерного гена RNLS человека, кодирующего химерный белок, который лишен N-концевого пептида. В основе этого метода лежит т.н. «экзоновое конструирование кодирующих последовательностей» [13], которое было апробировано на экспрессии одной из изоформ RNLS человека [14]. МАТЕРИАЛЫ И МЕТОДЫ
Реактивы В работе были использованы Tersus полимераза («Евроген», Россия), эдонуклеазы рестрикции BamHI, XhoI и маркеры молекулярной массы («Fermentas», США), Ni-сефароза («GE Healtheare», Швеция), система для очистки фрагментов ДНК (Wizard® SV Gel и PCR Clean-Up) и TA-вектор (pGEM®-T easy vector), реактив для трансфекции клеток FuGene-6 («Promega», США), прокариотический вектор pET-28a(f+) и E. coli штамм Rosetta (DE3) («Novagen», Великобретания), эукариотический вектор pcDNA4 myc-His (Invitrogen, США), PVDF-фильтры 0,45 мкм («Millipore», США), Олигонуклеотиды для ПЦР и вектор TagGFP2-N («Евроген», Россия). ДМЕМ, глутамин и антибиотики (пенициллин и стрептомицин) («ПанЭко», Россия). Поликлональные антитела овцы были получены против рекомбинантной RNLS человека и предоставлены «Покард» (Россия). Моноклональные антитела против IgG кролика барана, конъюгированные с пероксидазой хрена, были получены из ИМТЭК (Россия). Остальные химические реактивы были приобретены у «Sigma-Aldrich» (США). Полимеразная цепная реакция ПЦР ПЦР проводили в 20 мкл реакционной смеси содержащей 6,7 мМ трис (pH 8,8), 1,66 мМ (NH4)2SO4, 0,02 % Tween 20, 1 мМ MgCl2 , 0,2 мМ dNTP, 1% глицерин, по 4 мкМ каждого праймера (табл. 1), 50 – 100 нг ДНК-матрицы и 0,5 ед. Tersus-ДНК-полимеразы. Условия ПЦР: денатурация – 95ºС в течение 2 мин – 1 цикл; элонгация – 92ºС – 20 с, 55º С – 15 с, 72º С – от 30 с до 2-3 мин; количество циклов от 30 до 35; заключительный цикл 72º С – 3 мин. При синтезе (поли)нуклеотидных фрагментов, кодирующих сигнальный пептид и матричный пептид RNLS, время элонгации составило 60 с и 210 с соответственно. Электрофорез Электрофорез фрагментов ДНК проводили в 2 % агарозном геле с использованием трис-боратного буфера рН 8,0 [15]. Электрофорез в 12% ПААГ проводили в системе Лэммли [16]. Выделение плазмидной ДНК Выделение плазмидной ДНК из клеток E. coli проводили по методу Kushner [17]. Трансформация клеток Трансформацию клеток E coli BL-21 штамм (DE3) проводили, согласно протоколу, приведенному Kushner [17]; аликвоты компетентных клеток (по 0,2) мл хранили при -70ºС. Трансформацию проводили по стандартному методу Cohen [18], используя 1 мкл вектора pGEM®-T Easy. Трансформированные клетки высевали на чашки с LB-агаром, содержащим 100 мкг/мл ампициллина, необходимым для селекции трансформированных клеток. Секвенирование ДНК Секвенирование ДНК проведено компанией «Евроген» (Россия). Полученную последовательность ДНК соотносили с геном RNLS (NM_001031709, GeneBank), используя программу BLAST, доступную на сайте National Center for Biotechnology Information: (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PAGE_TYPE=BlastSearch&PROG_DEF=blastn&BLAST_PROG_DEF=blastn&BLAST_SPEC=GlobalAln&LINK_LOC=BlastHomeLink#). Экспрессия гена RNLS в прокариотической системе Экспрессию рекомбинантного гена в прокариотической системе проводили следующим образом. Колонию клеток после трансформации, подращивали в 4 мл LB-среды с 50 мкг/мл канамицина (Км) в течение ночи. Ночную культуру пересевали в 200 мл этой же LB среды и наращивали культуру клеток до оптической плотности 0,5 – 0,7 ед. Затем вносили ИПТГ (конечная концентрация 1,0 мМ) и продолжали инкубировать клетки при интенсивном перемешивании еще 3 часа. Биомассу собирали центрифугированием при 5,000×g 4° С течение 20 мин. на Avanti J-E центрифуге («Beckman Coulter», США) и хранили при -20º С. Экспрессия гена RNLS в эукариотической системе Экспрессию в эукариотической системе рекомбинантных генов (вектора pcDNA4-hRenI и pcDNA4-hRenI(-sp)) проводили в клетках НЕК-293T. Клетки НЕК-293Т были посажены в 10-см чашки Петри в плотности 7 млн. клеток на чашку в ростовой среде ДМЕМ, содержащей 10% FCS, 4 мМ глутамин и антибиотики пенициллин и стрептомицин (50 ед/мл и 50 мкг/мл соответственно), за 5 ч до трансфекции. Для трансфекции готовили смесь трансфекционного реагента FuGene-6 и соответствующего вектора в среде ДМЕМ в соотношении 5 мкг вектора и 15 мкл FuGene-6 на каждую чашку. Контролем эффективности трансфекции служил вектор pTagGFP2-N. Трансфицирующую смесь инкубировали при комнатной температуре 30 мин, с последующим добавлением её в культуру клеток. После 16-ти часовой инкубации среду, содержащую трансфицирующий реагент и сыворотку, удаляли и заменяли на свежую среду ДМЕМ, содержащую 4 мМ глутамин и антибиотики пенициллин и стрептомицин (50 ед/мл и 50 мкг/мл соответственно), и инкубировали еще сутки. Эффективность трансфекции в контрольной чашке оценивали под микроскопом по экспрессии флуоресцентного маркера TagGFP2, которая составила около 60% клеток. По завершению инкубации монослой клеток механически счищали с подложки, промывали физраствором, обрабатывали ультразвуком на ледяной бане и хранили при -20º С. Выделение рекомбинантного белка. Выделение рекомбинантного белка осуществляли методом аффинной хроматографии с использованием Ni-сефарозы в 8 М буферном растворе мочевины, как описано в наших работах [13, 14]. Иммуноблоттинг. Иммуноблоттинг осуществляли, согласно протоколу, приведенному в [19], используя поликлональные антитела овцы к RNLS (полученные нами ранее) и конъюгат пероксидазы хрена с антителами кролика к иммуноглобулинам овцы (ИМТЕК) [11, 12]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Нуклеотидную последовательность химерного гена RNLS человека с модифицированным N-концом (т.е. RNLS, не содержащую N-концевую сигнальную последовательность) получали на матрице ДНК вектора pET-hRenI посредством ее амплификации. Этот вектор был сконструирован нами ранее: в основе его получения лежало т.н. «экзоновое конструирование кодирующих последовательностей» [13, 14]. Прямым праймером (Mat-RNLS-for) служила последовательность, которая включала сайт рестрикции BamHI (ggatcc) и Kozak последовательность (aatggaagcg). Обратными праймерами служили (Mat-RNLS-rev(+stop) Mat-RNLS-rev(-stop)), которые включали сайт рестрикции XhoI (ctcgag). Первый обратный праймер содержал стоп-кодон (tag), а у второго отсутствовал стоп кодон (табл. 1).
Фрагмент ДНК со стоп кодоном в дальнейшем использовали при клонировании в эукариотический вектор pcDNA4 myc-His, а без стоп кодона – для клонирования в прокариотический вектор pET-28a(f+). Согласно расчетным данным, в результате ПЦР были получены амплификаты фрагмента ДНК с расчетной массой в 1010 пар оснований (п.о.). Полученные фрагменты ДНК после ПЦР реакции очищали с помощью системы очистки фрагментов ДНК (Wizard), согласно протоколу производителя. Очищенные таким образом ДНК фрагменты встраивали в вектор pGEM®-T Easy, который на 3’-концах содержит выступающий единичный Т-остаток, значительно усиливающий лигирование ПЦР продукта. Трансформацию клеток E coli BL-21 вектором pGEM®-T Easy со встроенным фрагментом ДНК проводили в полном соответствии с протоколами [18]. Плазмидные ДНК десяти клеточных клонов были выделены и идентифицированы рестрикционным анализом с помощью рестриктаз BamHI/XhoI. После рестрикционного анализа клоны, содержащие фрагмент ДНК в области 1010 п.о. были подвергнуты секвенированию. В результате секвенирования во всех исследуемых клонах были выявлены мутационные замены нуклеотидов, которые находились в третьем положении трансляционных триплетах gcC-Ala, atC-Ile и tcG-Ser (табл. 2).
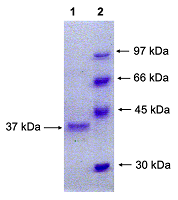
В связи с тем, что эти кодоны являлись вырожденными, аминокислотная последовательность кодируемого белка RNLS осталась без изменения (рис. 1). Данные мутации в гене RNLS являются следствием сконструированного нами ранее вектора pET-hRenI [14].
Затем кодирующую последовательность химерного гена RNLS человека без N-концевого пептида, не содержащую в гене стоп кодон, вставляли по сайтам рестрикции BamHI/XhoI в вектор pET-28a (+) которым трансформировали клетки E. coli Rosetta (DE3). В результате клонирования, рестрикционого анализа и последующего секвенирования встроенного фрагмента ДНК был отобран клон, содержащий ген RNLS, названный нами pET28-hRen1(-sp), который не содержал N-концевую сигнальную нуклеотидную последовательность в кодирующей области и его стоп кодон. Это приводило к включению векторной 6xHis последовательности, используемой при очистке белка. Экспрессию RNLS, лишенной N-концевой сигнальной последовательности, в прокариотической системе проводили на основе вектора pET28-hRen1(-sp) в клетках E. coli (штамм DE3 Rosetta). Трансформацию, селекцию и индукцию клеток E. coli проводили стандартным методом. Очистку рекомбинантного белка проводили методом хроматографии на Ni-агарозе [14].
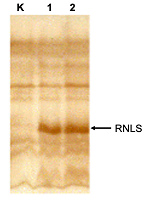
Аналогичным образом получали эукариотический вектор, содержащий кодирующую последовательность химерного гена RNLS человека и стоп кодон. Фрагмент ДНК встраивали по сайтам рестрикции BamHI/XhoI в вектор pcDNA4 myc-His которым трансформировали клетки E. coli Rosetta (DE3). В результате клонировани, рестрикционного анализа рестриктазами BamHI/XhoI и последующего секвенирования встроенного фрагмента ДНК был отобран клон, содержащий ген RNLS (названный нами) pcDNA-hRen1(-sp). Экспрессию RNLS, лишенной N-концевой сигнальной последовательности, в эукариотической системе проводили методом трансфекции генетической конструкции (вектор pcDNA-hRen1(-sp)) в эукариотических клетках НЕК-293T стандартным методом [12]. Методом Вестерн блот анализа с использованием поликлональных антител к RNLS было обнаружено, что в контрольных клетках, которые были трансфицированы вектором pcDNA4 myc-His, белок реналазы не выявлялся в клеточном экстракте (рис. 3, дорожка К). В клетках, трансфицированных вектором pcDNA-hRen1 (в котором ген RNLS содержит нуклеотидную последовательность, кодирующую сигнальный пептид), белок RNLS в клеточном экстракте детектировался (рис. 3, дорожка 1). При экспрессии в клетках НЕК-293Т химерного гена RNLS, лишенного нуклеотидной последовательности, кодирующей N-концевой сигнальной последовательности (вектор pcDNA-hRen1(-sp)), белок RNLS также обнаруживается клеточном экстракте (рис. 3, дорожка 2).
Масс-спектрометический анализ клеточных экстрактов, выполненный с использованием меченого протеотипического пептида RNLS человека с аминокислотной последовательности EGDCNFAPQGISSIIK, который включал стабильные изотопы углерода 13С и азота 15N в С-терминальном аминокислотном остатке лизина [20], также подтвердил присутствие химерного белка в трансфицированных клетках (и его отсутствие в контрольных, нетрансфицированных клетках). ЗАКЛЮЧЕНИЕ Таким образом, выбранная нами ранее стратегия получения кодирующих последовательностей гена хорошо зарекомендовала себя при конструировании химерного гена RNLS человека с модифицированным N-концом. ФИНАНСИРОВАНИЕ Исследования по клонированию гена RNLS и экспрессии рекомбинантного белка выполнены в рамках проекта РФФИ № 20–015–00104. Масс-спектрометрические исследования выполнены при поддержке Программы фундаментальных исследований государственных академий наук на 2013-2020 годы. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Данная работа не содержит каких-либо результатов исследований, проведенных с участием людей или использованием животных в качестве объектов. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|