|
Измерение эстрогенов в тканях молочной железы методом жидкостной хроматографии и тандемной масс-спектрометрии
1Сколковский институт науки и технологий, Сколково Ключевые слова: эстрогены; рак молочной железы; ВЭЖХ-МС DOI: 10.18097/BMCRM00147 ВВЕДЕНИЕ
Стероидные гормоны регулируют множество жизненно важных функций в организме человека, и поэтому широко используются в клиническом анализе для диагностики различных заболеваний [1, 2]. Эстрогены, например, участвуют в развитии вторичных женских характеристик, однако их более продолжительное воздействие на протяжении всей жизни считается ведущей причиной риска развития рака молочной железы [3-5]. Многочисленные исследования были сосредоточены на изучении уровня циркулирующих эстрогенов; прямое измерение стероидов в молочной железе проводили преимущественно методом радиоиммуноанализа, и работы по данному направлению малочисленны [6-8]. Чтобы лучше понять роль локальных концентраций эстрогенов в развитии рака молочной железы (РМЖ), необходим точный метод, который может определять низкие физиологические концентрации гормонов. Преимущество использования для этой цели высокоэффективной жидкостной хроматографии с масс-спектрометрией (ВЭЖХ-МС) по сравнению с иммуноферментным анализом заключается в повышенной чувствительности и селективности, а также одновременном количественном определении нескольких аналитов [9, 10]. Предыдущие работы по измерению эстрогенов в образцах ткани молочной железы (МЖ) с помощью ВЭЖХ-МС были сфокусированы на анализе тонкоигольных аспиратов ткани МЖ [11], образцов жировой ткани МЖ [12], и клеточной культуры РМЖ [13]. Тем не менее, разработка метода исследования ткани МЖ с быстрым приготовлением образцов, не требующим использования трудоемких процедур экстракции, остается многообещающей. Более того, описанные методы различаются подходами к нормировке количества эстрогенов, оставляя открытой для обсуждения обоснованность каждого метода нормировки. Таким образом, целью исследования было разработать метод определения содержания эстрогенов в тканях МЖ с помощью ВЭЖХ-МС. Основными требованиями к разрабатываемой методике были малое время и удобство для высокопроизводительных анализов, а также точность и чувствительность для количественного определения эстрогенов в образцах тканей молочной железы. МЕТОДИКА Проведено исследование на биоптатах рака молочной железы пациентов, проходящих лечение в Национальном медицинском исследовательском центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова. Средний возраст пациенток составил 56±7 лет. Половина пациенток (n=10) имели стадию pT1N0M0, вторая (n=10) – pT2N0M0. Образцы ткани МЖ были собраны после мастэктомии у женщин в постменопаузе, а затем специалистом-гистологом для каждой пациентки выделялась злокачественная ткань МЖ и здоровая ткань, разделялась на две части для гистологического и масс-спектрометрического анализа. Образцы последних замораживали в жидком азоте и хранили при -80 °С В работе использовали следующие химические вещества: эстрон (E1) («Sigma-Aldrich», Италия), эстрадиол (E2) («Sigma-Aldrich», Китай), 17β-эстрадиол-D5 («Sigma-Aldrich», США), муравьиная кислота (98%, для масс-спектрометрии, «Sigma-Aldrich», Германия), деионизированная вода, приготовленная с помощью системы очистки воды Milli-Q Reference («Molsheim», Франция), ацетонитрил (для ВЭЖХ, «Fisher Chemicals», Великобритания), метанол (для ВЭЖХ, «Fisher Chemicals», Великобритания), метил-трет-бутиловый эфир (МТБЭ) (для ВЭЖХ, «Sigma-Aldrich», США), дансилхлорид (≥99.0%, «Sigma-Aldrich,» Швейцария) и карбонат натрия (≥99.8%, «Sigma-Aldrich», США). Для дериватизации эстрогенов были приготовлены растворы дансилхлорида в ацетонитриле (1 г/л) и карбоната натрия в воде (10 ммоль/л). Стандартные растворы эстрогенов готовили растворением 1 мг в 1 мл метанола. Рабочие стандарты (10 пг/мл, 50 пг/мл, 100 пг/мл, 1000 пг/мл) были приготовлены путем последовательного разбавления стандартных растворов и последующего добавления в пул из нескольких экстрактов тканей, полученных способом, описанным в разделе подготовки образцов. Раствор 17β-эстрадиола-D5 в метаноле (10 нг/мл) использовали в качестве внутреннего стандарта (эстрадиол-ВС). Образцы тканей взвешивали и помещали в пластиковые пробирки. Затем добавляли 1 мл МТБЭ и 10 мкл раствора внутреннего стандарта. Экстракцию проводили в ультразвуковой бане в течение 15 минут при комнатной температуре. После переноса органического слоя в новые пробирки экстракцию повторяли с добавлением 1 мл МТБЭ и 200 мкл воды. Объединенный экстракт сушили в атмосфере азота и взвешивали липидный остаток. Полученные массы использовали для нормировки сигнала эстрогенов. После добавления 0.5 мл холодного метанола смесь встряхивали в течение 1 минуты и центрифугировали в течение 5 минут при 15000 g. Супернатант переносили в пластиковые пробирки и сушили в атмосфере азота. Дериватизацию проводили добавлением 20 мкл растворов дансилхлорида и карбоната натрия. Образцы встряхивали и инкубировали 10 мин при 70 °С. Далее добавляли 60 мкл раствора ацетонитрил / вода (50/50, об./об.), после раствор переносили в стеклянные виалы для анализа. Подготовку образцов проводили по методике, описанной ранее [11]. Объединенные образцы экстрактов тканей были получены путем объединения экстрактов из 5 частей одного образца ткани. Образцы анализировали с использованием жидкостного хроматографа серии Agilent 1200 («Agilent Technologies», Германия). Хроматографическое разделение проводили на колонке Kinetex C18 (2.1 × 50 мм, размер частиц сорбента 2.6 мкм, «Phenomenex», США). Объем дозируемых проб 50 мкл. Расход элюэнта 0.4 мл/мин. Температура колонки 30°С. Подвижная фаза A – деионизированная вода с добавлением муравьиной кислоты (0,1%), B – ацетонитрил с добавлением муравьиной кислоты (0.1%). Градиент подвижной фазы (фаза B) был следующим: от 30% до 99% 0-3 мин; 99%, 3-5.7 мин; от 99% до 43% 5.7-6 мин; 30%, 6-10 мин. Система ВЭЖХ была соединена с тройным квадрупольным масс-спектрометром AB Sciex QTRAP 5500 («ABSciex», Сингапур). Количественную оценку выполняли с помощью мониторинга множественных реакций (MRM) в режиме положительных ионов. Переходы MRM и их параметры для каждого аналита и внутреннего стандарта показаны в таблице 1.
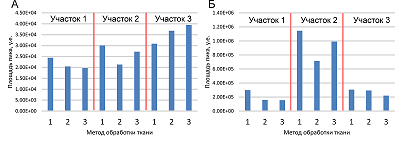
Для калибровки метода к объединенным экстрактом тканей добавляли заданное количество эстрогенов (0 пг/образец, 5 пг/образец, 10 пг/образец, 20 пг/образец, 30 пг/образец, 40 пг/образец, 50 пг/образец, 100 пг/образец) и после анализировали с помощью ЖХ-МС / МС. Калибровочные кривые строили как отношение площадей пиков (аналит /внутренний стандарт) к количеству аналитов и корректировали по фоновому сигналу эстрогенов в объединенных экстрактах тканей. Точность и воспроизводимость оценивали с использованием стандартных растворов, добавленных в экстракт ткани (2,5 пг/образец, 5 пг/образец, 10 пг/образец, 25 пг/образец, 100 пг/образец). Для каждой концентрации использовали 4 раствора. Наконец, было проанализировано распределение эстрогенов в образцах здоровой и злокачественной ткани МЖ от 20 пациентов. Статистическую обработку данных анализа проводили в R (R Core Team, 2020) с использованием программного обеспечения RStudio (RStudio Team, 2020). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Первым этапом разработки метода было определение оптимального способа подготовки образцов ткани МЖ. Для этого из трех разных участков биоптата ткани от одного пациента было взято несколько образцов одинаковой массы. Часть образцов без предварительного измельчения была перенесена в пробирки, вторая часть была разрезана на несколько крупных фрагментов, а третья часть была нарезана на предметном стекле на фрагменты порядка 0,3 мм. После этого проводили приготовление полученных образцов в соответствии с описанной процедурой. Для сравнения интенсивности сигнала эстрадиола и эстрона в образцах, приготовленных с помощью трех процедур, абсолютные значения интенсивности для каждого типа процедуры были нормированы на среднюю площадь хроматографического пика, полученную для образцов из одного участка ткани. Полученные площади сравнивались между каждым типом измельчения и образцами без измельчения с использованием t-критерия Стьюдента (табл. 2).
В результате было обнаружено, что измельчение образца описанными выше способами искажает определяемое содержание гормонов, поскольку для эстрона нормированные площади для обоих типов измельчения были статистически значимо меньше по сравнению с площадью, полученной для образцов без измельчения. Уменьшение площади может быть связано с потерей доли аналитов в составе липидного остатка на предметном стекле который не был перенесен. Соответствующие абсолютные площади пиков представлены на рисунке 1. Экстракция из цельного куска ткани с использованием ультразвуковой ванны без предварительного измельчения может быть использована для приготовления образцов ткани, что было описано в предыдущих исследованиях [14]. Также была предпринята попытка осуществить механическую гомогенизацию образцов ткани по аналогии с ранее описанными процедурами [12, 15], однако во время подготовки часть образца теряется в процессе, что может привести к искажению результатов. Поэтому было решено готовить все образцы тканей без измельчения.
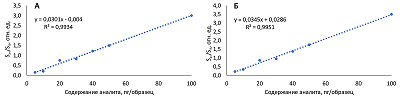
При построении калибровочных кривых, сигнал аналитов был линейным в диапазоне 5-100 пг/образец (R2 = 0.9934 и R2=0.9951 для эстрона и эстрадиола соответственно). Градуировочные кривые представлены на рисунке 2.
Значения воспроизводимости и точности показаны в таблице 3. Воспроизводимость, которую оценивали по величине относительного стандартного отклонения и составила меньше 15% для всех измерений. Точность методики, оцениваемая по величине средней ошибки аппроксимации, была в интервале от 10.4 % до 21.8 %. Значения средней ошибки выше 15%, возможно, являются следствием интенсивного матричного эффекта и процесса дериватизации.
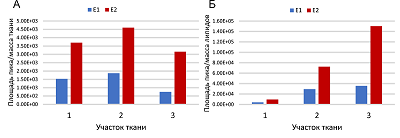
Сравнение методов нормировки на массу образца ткани или массу липидного остатка, которые были ранее описаны в работах [11, 12], выполнено с использованием трех образцов примерно одинаковой массы, взятых из трех разных частей биоптата от одного пациента и проанализированы. Нормированные площади пиков эстрона и эстрадиола представлены в таблице 4. Более четкая демонстрация значительной разницы между площадями пиков эстрогенов, нормированных на массу ткани и нормированных на массу липидов, показана на рисунке 3. Нормировка на массу ткани не приводит к значительным различиям между образцами, однако нормировка на массу липидной фракции приводит к значительной вариации в 73 и 92% для эстрона и эстрадиола, соответственно. Этот факт заставляет задуматься о том, является ли нормировка количества эстрогенов на массу липидной фракции подходящим методом.
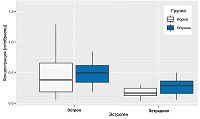
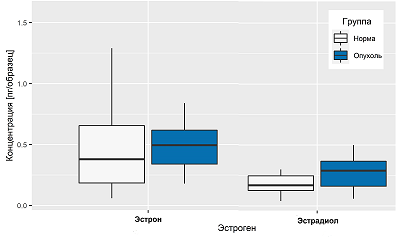
Очевидно, что незначительные изменения количества жировой ткани в биоптате могут кардинально повлиять на нормировку площади пиков эстрона и эстрадиола. Учитывая тот факт, что эпителиальная секреторная ткань МЖ окружена жировой тканью, потенциально небольшая примесь жировой ткани в биопсийном материале может значительно исказить концентрации гормонов при использовании метод нормировки их содержания на массе липидов. Нормировка количества эстрогенов на массу ткани дает менее противоречивые результаты, однако все же значительные отклонения могут указывать на плохую воспроизводимость экстракции гормонов из ткани или неоднородность самой ткани с точки зрения содержания гормонов в ее различных частях. Для установления причины могут потребоваться дальнейшие исследования. Наконец, уровни эстрадиола и эстрона были измерены в образцах нормальной и злокачественной ткани МЖ, взятых от 20 пациентов в менопаузе. Поддающиеся количественной оценке концентрации гормонов были обнаружены в 15 образцах из 20. Площади полученных хроматографических пиков были выше верхнего предела количественного определения в нескольких образцах. Данные представлены в виде диаграмм размаха на рисунке 4. Количество эстрогенов было нормировано на массу ткани (массы эстрогенов в пг делили на массу ткани в мг). Представленная диаграмма четко указывает на значительный разброс уровней эстрона как в норме, так и при патологии. По сравнению с эстроном наблюдается меньшая вариабельность содержания эстрадиола.
Сравнение содержания эстрогенов в образцах здоровой и злокачественной ткани с помощью теста Вилкоксона не продемонстрировало статистически значимой разницы (значения p для эстрона и эстрадиола составляют 0.1882 и 0.0868 соответственно). Корреляционный анализ позволил выявить корреляцию содержания эстрона в нормальной и злокачественной тканяи (ρ Спирмена = 0.5640, p = 0.0148), в то время как для содержания эстрадиола статистически значимой корреляции не наблюдалось. ЗАКЛЮЧЕНИЕ Разработан метод ВЭЖХ-МС/МС для одновременного измерения эстрона и эстрадиола в образцах ткани молочной железы, оценены воспроизводимость, точность и чувствительность методики. Несмотря на то, что не было обнаружено статистически значимой разницы между уровнями эстрогенов в нормальных и злокачественных образцах ткани молочной железы женщин в постменопаузе, многопараметрическое исследование с участием большого числа пациентов является перспективным для более глубокого понимания влияния эстрогенов на развитие рака молочной железы. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все клинические исследования проводили в соответствии с принципами, изложенными в Хельсинкской декларации. Все пациенты прочитали и подписали информированное согласие, одобренное этическим комитетом Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени академика В.И. Кулакова. ФИНАНСИРОВАНИЕ Работа выполнена при поддержке РФФИ и Национального фонда естественных наук Китая в рамках проекта № 19-515-55021. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|