|
Определение концентрации холестерина и триглицеридов в экстраклеточных везикулах сыворотки крови с помощью коммерческих наборов 1Институт высшей нервной деятельности и нейрофизиологии РАН, Ключевые слова: малые экстраклеточные везикулы; сыворотка крови; динамическое светорассеяние; холестерин; триглицериды DOI: 10.18097/BMCRM00148 ВВЕДЕНИЕ
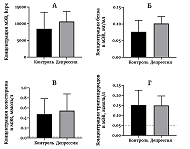
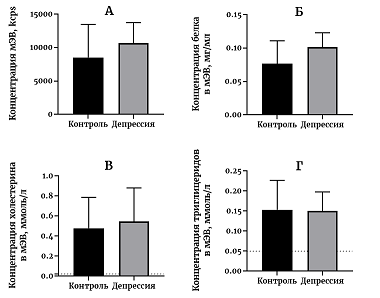
Последнее время продолжается активное изучение малых экстраклеточных везикул (мЭВ). Продемонстрировано вовлечение мЭВ в развитие целого ряда патологий: от нейродегенерации до онкологии [1, 2]. Предполагается, что мЭВ могут быть использованы как в диагностике [3], так и для лечения [4] многих заболеваний. Продолжаются исследования состава мЭВ. В частности, было выполнено довольно много исследований липидного состава мЭВ [5-9]. Можно считать однозначно установленным то, что мембраны мЭВ обогащены холестерином, сфингомиелином и некоторыми ганглиозидами [5-9]. Однако все работы по установлению липидного состава мЭВ были проведены на клеточных культурах, для выделения мЭВ были использованы сложные многостадийные методы, а основным методом детекции липидов мЭВ была масс-спектрометрия [9]. Очевидно, что результаты, полученные на клеточных культурах, довольно сложно перенести на мЭВ из крови человека в силу гораздо большей сложности объекта. Также и метод выделения, для того чтобы быть востребованным в клинике, должен быть максимально простым и высокопроизводительным. Масс-спектрометрия в рутинной практике слишком затратна и пока не может стать методом лабораторного анализа. Тем не менее, исследования липидного состава мЭВ могут всерьез помочь в диагностике заболеваний. Уникальность мЭВ как объекта исследования обусловлена способностью мЭВ проникать через гематоэнцефалический барьер (ГЭБ) [10]. Способность проникать через ГЭБ является не только важным диагностическим преимуществом мЭВ [3, 11], но и может быть важным звеном патогенеза некоторых заболеваний, связанных с этим свойством мЭВ [12]. Таким образом, исследуя липидный состав мЭВ крови, можно составить косвенное представление о процессах липидного обмена в головном мозге. Ранее считалось, что при депрессии концентрация холестерина в крови понижается [13, 14]. По крайней мере, это было показано при исследовании депрессивных пациентов, проявляющих склонность к суициду [15], хотя далеко не все работы последних лет подтверждают это утверждение [16]. При несомненной полезности исследований холестерина крови при депрессивном расстройстве истинное положение дел в мозге, конечно, остается неизвестным. С этой точки зрения мЭВ из клеток мозга, проникшие через ГЭБ в кровь, могут служить важным источником информации о метаболизме холестерина (как и других веществ) в структурах мозга. Давно известно, что при психических заболеваниях, таких как шизофрения, биполярное расстройство, депрессивное и тревожное расстройства, в структурах мозга происходит окислительный стресс [17, 18]. Окислительный стресс характерен также при течении ряда нейродегенеративных заболеваний. Показано, что в плазме крови уже на начальных стадиях болезни Альцгеймера появляются окисленные метаболиты холестерина [19]. Вероятно, мЭВ, поступающие из мозга в биологические жидкости, могут пролить свет на выраженность окислительного стресса в мозге при психических и нейродегенеративных заболеваниях. Для исследования качественного состава мЭВ крови нужен хороший отработанный метод их выделения. В последнее время все большую популярность приобретает гель-фильтрация как метод выделения мЭВ из биологических жидкостей [20]. Мы долгое время использовали и продолжаем использовать этот метод для анализа мЭВ крови [21, 22]. Однако, при использовании этого метода чувствительности для корректного определения в мЭВ холестерина с помощью коммерческих наборов не всегда оказывается достаточно (Яковлев и др.,неопубликованные данные). Таким образом, нам потребовалась разработка нового метода выделения мЭВ с увеличенным выходом очищенных мЭВ для того, чтобы определять в этой фракции концентрацию холестерина. В работе мы использовали комбинацию двух хорошо известных методов выделения мЭВ: преципитацию с помощью PEG 6000 с последующей доочисткой полученной фракции на колонке с Sepharose CL-2B. В полученных таким образом пробах нам удалось без дополнительных процедур измерить концентрацию холестерина и триглицеридов с помощью доступных коммерческих наборов. МАТЕРИАЛЫ И МЕТОДЫ В экспериментах были использованы фосфатно-солевой буфер (PBS, в таблетках, «Биолот», Россия), PEG 6000 («Fluka», Германия), Sepharose CL-2B («GE Healthcare», США). Все растворы готовили на дважды деионизованной воде сопротивлением 18.2 МОм*см. Отбор участников исследования Пациенты были набраны из числа пациентов Научно-практического психоневрологического центра им. З.П. Соловьева ДЗМ (НПЦ). Здоровые добровольцы были найдены среди медицинского персонала НПЦ. В исследование были включены 27 человек, из которых 11 был поставлен диагноз депрессивного расстройства. Критериями включения для пациентов явились: наличие установленного диагноза в рамках F41.2, F32, F33 МКБ-10, возраст от 18 до 45 лет, наличие письменного информированного согласия. Диагноз депрессивного расстройства для каждого пациента подтверждался лечащим врачом-психиатром. Критериями включения для контрольной группы (n=16) явились: возраст от 18 до 45 лет и наличие письменного информированного согласия. Критериями исключения для обеих групп явились: шизофрения; алкоголизм и наркомания в анамнезе; серьезные неврологические заболевания (инсульт, болезнь Паркинсона, деменция, ушибы мозга, эпилепсия, и т.п.); эндокринные нарушения: сахарный диабет, дисфункция щитовидной железы и прием тиреотропных препаратов/заместительной терапии; любое инвалидизирующее заболевание внутренних органов; выраженный дефицит зрения или слуха; значительные физические нагрузки накануне обследования, суточный и ночной графики работы, прием антикоагулянтов и психотропных препаратов в период до госпитализации или перед участием в исследовании. Демографическая информация включала возраст, пол, уровень образования, экономический статус, индекс массы тела (ИМТ) и не отличалась между группами. Количественную оценку симптомов депрессии и тревоги проводили с использованием опросников «Шкала депрессии Бека» для субъективной оценки уровня депрессии; «Шкала тревоги Спилбергера» для оценки уровней ситуативной и личностной тревоги. Состояние пациентов также оценивалось по «Шкале Депрессии Гамильтона», заполняемой их лечащим врачом–психиатром. Материал для исследования Материалом для исследования служила сыворотка крови человека. Забор крови у здоровых добровольцев и пациентов проводили из локтевой вены в утренние часы натощак. Известно, что на образование экстраклеточных везикул оказывает влияние множество факторов [23]. Поэтому процедура взятия крови и преаналитический этап подготовки проб были максимально стандартизированы. Для всех проб были соблюдены одинаковые условия, а именно: время (не более 30 мин) и способ забора крови; температура в помещении между взятием крови и центрифугированием (22-23°С); условия центрифугирования; условия хранения биологического материала на всех этапах анализа. Выделение мЭВ из сыворотки крови человека с помощью PEG 6000 Пробы сыворотки крови получали и очищали от остатков клеток и высокомолекулярных агрегатов центрифугированием при 4°С в течение 30 мин при 10000 g. К аликвоте образца объемом 500 мкл добавляли равный объем 6% PEG 6000, интенсивно перемешивали и оставляли на 30 мин на льду. Затем образцы центрифугировали при 4°С в течение 30 минут при 1500 g. Осадок однократно промывали 100 мкл PBS и растворяли в 100 мкл PBS при интенсивном перемешивании. Полученную грубую фракцию мЭВ замораживали на -80°С. Доочистка мЭВ с помощью гель-фильтрации Колонку заполняли 2 мл смолы Sepharose CL-2B и уравновешивали PBS. Грубую фракцию после выделения PEG наносили на колонку в объеме 100 мкл, после добавления пробы наносили 800 мкл PBS, элюат отбрасывали. После этого наносили 200 мкл PBS и собирали элюат для последующего анализа. Перед очередным образцом промывали колонку не менее чем 4 мл PBS [24]. Выделенные мЭВ хранили при -80°С. Определение концентрации белка по методу Бредфорда Пробы смешивали с красителем Кумасси G-250 в соотношении 2:3 в лунках 384-луночного планшета, инкубировали при комнатной температуре в течение 5 мин и определяли поглощение при 595 нм с помощью планшетного спектрофлуориметра Hidex Sense («Perkin Elmer», Финляндия). Калибровочную прямую строили по бычьему сывороточному альбумину в концентрации от 0.01 мг/мл до 2 мг/мл. Определение концентрации холестерина в мЭВ Определение концентрации холестерина в мЭВ проводили на автоматическом биохимическом анализаторе ILab Aries (Италия) жидким монореагентом («BioSystems SA», Испания), состоящим из PIPES (пиперазин-N,N′-бис(2-этансульфоновая кислота)) – 35 ммоль/л, холат натрия – 0.5 ммоль/л, фенол – 28 ммоль/л, холестеролэстераза – 0.2 Ед/мл, холестеролоксидаза – 0.1 Ед/мл, пероксидаза – 0.8 Ед/мл, 4-аминоантипирин – 0.5 ммоль/л, рН 7.0. Метод определения – холестеролоксидаза/пероксидаза, конечная точка. Предел обнаружения – 0.023 ммоль/л, предел линейности – 26 ммоль/л. Определение концентрации триглицеридов в мЭВ Определение концентрации триглицеридов в мЭВ проводили на автоматическом биохимическом анализаторе ILab Ariesжидким монореагентом («BioSystems SA»), состоящим из PIPES - 45 ммоль/л, ацетат магния – 5 ммоль/л, 4-хлорфенол – 6 ммоль /л, липаза – 100 Ед/мл, глицеролкиназа – 1.5 Ед/мл, глицерол-3-фосфатоксидаза – 4 Ед/мл, пероксидаза – 0.8 Ед/мл, 4-аминоантипирин – 0.75 ммоль/л, АТР – 0.9 ммоль/л, рН 7.0. Метод определения – глицеролфосфатоксидаза/пероксидаза, конечная точка. Предел обнаружения – 0.05 ммоль/л, предел линейности – 6.78 ммоль/л. Определение концентрации мЭВ с помощью динамического светорассеяния Интенсивность динамического светорассеяния мЭВ определяли с помощью прибора Zetasizer Nano S («Malvern Panalytical», Великобритания). В кварцевую кювету с рабочим объемом 100 мкл наливали мЭВ, разбавленные в 100 раз PBS, и определяли светорассеяние на угол 173 градуса на длине волны 633 нм за четыре повтора длительностью по 40 с каждый. Оборудование позволяет вычислить размер наночастиц, а также определить число рассеянных на частицах фотонов, выражаемое в тысячах фотонов в секунду, kcps. Общее число рассеянных на частицах фотонов служит параметром, отражающим концентрацию мЭВ в образце [21]. Статистическая обработка результатов Статистический анализ проводили в программе Graphpad Prism ver. 8.0. Результаты представлены в виде среднее ± стандартное отклонение. Для выявления взаимосвязи между переменными использовали непараметрический корреляционный анализ, представлен коэффициент корреляции Спирмена и 95% доверительный интервал. РЕЗУЛЬТАТЫ Группа пациентов с диагнозом депрессия характеризовалась средним возрастом 34,3±10,4 года, средним баллом по шкале Бека 19.3±6.5, средним баллом по шкале Гамильтона 17.4±3.5 и средней длительностью заболевания более восьми лет. Таким образом, группу пациентов, представленных в работе, можно охарактеризовать как людей среднего возраста с умеренно выраженной депрессией. Контрольная группа не отличалась от пациентов с депрессией по возрасту (41.3±9.2 года). Выделенная фракция мЭВ была исследована по нескольким биохимическим показателям. В первую очередь, во фракции мЭВ было измерено число частиц (рис. 1А). Результат значительно превосходит предел детекции метода и, в целом, воспроизводит полученные нами ранее результаты. Столь же воспроизводимым оказался и метод определения концентрации белка в мЭВ, результаты представлены на рисунке 1Б. Эти два показатели были определены нами и раньше. Результаты определения концентрации холестерина во фракции мЭВ представлены на рисунке 1В.
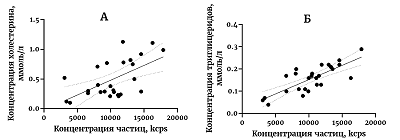
Хорошо видно, что концентрация холестерина и в контрольной группе, и в группе пациентов с депрессией, существенно превосходит предел обнаружения, установленный для используемого метода производителем. Похожая ситуация обнаружена и для концентрации триглицеридов в мЭВ (рис. 1Г). Превышение над пределом обнаружения в этом случае не столь явное как в случае с холестерином, но, тем не менее, заметное (рис. 1Г). В ходе работы были обнаружены корреляционные связи между концентрацией частиц и концентрации холестерина и триглицеридов (рис. 2А, 2Б). В обоих случаях была обнаружена достоверная корреляция по Спирмену. Концентрация частиц и концентрация холестерина коррелируют с коэффициентом корреляции 0.52, р=0.0061. Коэффициент детерминации в этом случае составил 0.348, что является довольно слабым показателем связи. Концентрация частиц и концентрация триглицеридов коррелируют с коэффициентом корреляции 0.72, р<0.0001. Коэффициент детерминации в этом случае составил 0.616, что является довольно высоким значением. На графиках (рис. 2А, 2Б) хорошо видны и линейность взаимосвязей концентрации частиц и концентрации холестерина или концентрации триглицеридов, и небольшой разброс значений вдоль прямой. Тест серий не выявил неслучайности отклонения от линейности в обоих случаях.
ОБСУЖДЕНИЕ В работе представлена комбинация двух методов выделения мЭВ, позволившая провести измерения концентрации холестерина и триглицеридов во фракции мЭВ с помощью коммерчески доступных наборов. Этот результат позволяет существенно упростить биохимический анализ мЭВ. Ранее мы пытались определить концентрацию холестерина во фракции мЭВ, выделенных с помощью одной гель-фильтрации, но безуспешно (результаты не представлены). Комбинация двух методов позволяет выделить примерно такое же количество частиц, как и одна гель-фильтрация, но в концентрации в 3-5 раз больше. Видимо, увеличение концентрации и является залогом успешного применения методов количественного определения холестерина и триглицеридов. При этом концентрация холестерина в пробах во много раз превосходит предел обнаружения (рис. 1В). Такой результат нельзя объяснить лишь пятикратным увеличением концентрации холестерина при выделении с использованием двух методов. Мы предполагаем, что в процессе очистки происходит избавление от компонентов, мешающих определению холестерина в образцах. Таким образом, комбинация двух методов не только позволяет выделять более концентрированную фракцию мЭВ, но и выделенная фракция оказывается более чистой. Если руководствоваться полученной концентрацией белка (рис. 1Б), то степень обеднения примесными белками при комбинации двух методов выделения составляет примерно два раза. В работе обнаружена высокодостоверная корреляция между числом мЭВ и концентрациями холестерина (рис. 2А) и триглицеридов (рис. 2Б). Этот результат указывает на то, что все выделяемые с помощью комбинации двух методов частицы однородны по составу и имеют одинаковое соотношение липидов в мембранах мЭВ. Это наблюдение косвенно указывает на чистоту фракции мЭВ и отсутствие в ее составе примеси липопротеинов. Присутствие липопротеинов должно было бы сильно увеличить долю липидов во фракции мЭВ, чего, согласно нашим результатам, не происходит. Таким образом, в работе представлена новая схема выделения мЭВ, сочетающая в себе преимущества двух методов – преципитации PEG и гель-фильтрации. Каждый из методов сам по себе хорошо охарактеризован и их совместное применение не предполагает никаких сложностей. При некотором увеличении времени эксперимента происходит увеличение концентрации мЭВ и избавление от части примесей. Применение двух методов последовательно позволило определить концентрацию липидов во фракции мЭВ с помощью коммерчески доступных наборов, что позволит в будущем проводить более детальный анализ состава мЭВ и использовать результат для диагностики заболеваний. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все процедуры, выполненные в исследовании с участием людей, одобрены этическим комитетом Института ВНД и НФ РАН. От каждого из включенных в исследование участников было получено информированное добровольное согласие. БЛАГОДАРНОСТИ Авторы выражают искреннюю благодарность российскому представительству Malvern Panalytical и лично С.Л. Васину и Е.О. Дуплякину за помощь в разработке методов регистрации везикул с помощью динамического светорассеяния. ФИНАНСИРОВАНИЕ Работа выполнена по теме АААА-А19-119071990046-9 «Нейрогенетика» Государственного задания Института ВНД и НФ РАН. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|