|
Оптимизация технологии получения препарата бактерий человека для биологической коррекции микрофлоры кишечника Федеральный научно-клинический центр физико-химической медицины ФМБА, 119435, Москва, Малая Пироговская, 1а ;*e-mail: al.androva@gmail.com Ключевые слова: трансплантация фекальной микробиоты; лиофилизированные пероральные капсулы; лиопротекторы; короткоцепочечные жирные кислоты DOI: 10.18097/BMCRM00151 ВВЕДЕНИЕ
Восстановление бактериального разнообразия кишечника посредством трансплантации фекальной микробиоты (ТФМ) стало эффективным методом лечения и предупреждения рецидивов кишечной инфекции, вызванной ванкомицин-устойчивой формой бактерии Clostridium difficile [1]. С 2013 года процедура для терапии данного состояния официально одобрена Управлением по контролю пищевых продуктов и лекарственных препаратов США (Food & Drug Administration) [2, 3]. Спектр применения метода постоянно расширяется. Сегодня его используют в составе комплексной терапии воспалительных заболеваний кишечника [4], коррекции микробиоты после антибактериальной терапии [5], а также в качестве экспериментальной методики при нейродегенеративных расстройствах [6, 7]. Применение ТФМ приводит к снижению представленности патогенов с множественной резистентностью к антибиотикам, что важно на фоне растущей смертности из-за инфицирования резистентным к антибиотикам патогенными бактериями. По сравнению со многими другими медицинскими процедурами методика проведения ТФМ очень проста. Однако ее практическая реализация зачастую существенно усложняется из-за логистических барьеров, связанных с идентификацией и проверкой доноров, согласованием сроков сбора и подготовки материала. Эти и другие организационные барьеры преодолеваются использованием замороженного кала [8, 9]. Основной вопрос, связанный с использованием замороженного кала, заключается в жизнеспособности микроорганизмов по сравнению с исходным материалом. В проведенных исследованиях по использованию метода ТФМ для лечения кишечной инфекции, вызванной ванкомицин-устойчивой формой бактерии Clostridium difficile, свежеприготовленные и замороженные фекалии не различались по эффективности, которая составляла 81-100% [8, 9]. Еще одним принципиальным вопросом, связанным с использованием замороженного кала, является жизнеспособность микроорганизмов с течением времени. В различных исследованиях приводятся данные об использовании замороженного кала в течение 6 месяцев хранения [10] и даже 1 года [11] без потери эффективности. Препараты фекалий доставляют как через нижние отделы ЖКТ (клизма, колоноскопия), так и верхние (эндоскопия, пероральные капсулы). Каждый из методов имеет свои преимущества и свои недостатки и остается на выбор медицинского персонала. Общим недостатком инструментальных методов введения (эндоскопия, колоноскопия) является их инвазивность, связанная с риском перфорации кишечника и применением анестезии. Пероральные капсулы, заполненные лиофилизированными фекалиями, минимально инвазивны, удобны и более эстетичны, поэтому при отсутствии противопоказаний врачи и пациенты все чаще отдают предпочтение именно этому способу доставки препарата [12, 13] В процессе лиофилизации клетки микроорганизмов подвергаются действию стрессовых факторов, таких как низкие температуры, кристаллизация воды, осмотический стресс, изменения рН растворов, дегидратация. Для снижения риска повреждения клеток при лиофилизации используют защитные среды - главный из варьируемых факторов, влияющий на выживание бактерий при высушивании [14]. Подбор защитных сред проводят эмпирически. Это в значительной степени связано с тем, что полностью не определены механизмы повреждения бактериальных клеток при высушивании и хранении сухих препаратов, так же, как и механизмы защитного действия лиопротекторов, представления о которых находятся на уровне предположений. Протективные среды должны защищать клетки от повреждений при замораживании, дегидратации, хранении, быть легко высушиваемыми, хорошо растворяться при регидратации, не обладать токсичностью. Спектр эффективных лиопротекторов, соответствующих вышеуказаным свойствам, ограничен углеводами, некоторыми аминокислотами, восстановленным молоком, сывороткой крови, желатином и их комбинациями [15]. Наиболее популярными лиопротекторами являются низкомолекулярные углеводы. Их защитные свойства при высушивании бактерий подтверждены результатами многочисленных исследований [16, 17]. Наиболее эффективными лиопротекторами являются дисахариды [17], которые используются в рабочих концентрациях 5–20% как индивидуально, так и в составе с протекторами другой химической природы [15, 17]. По данным большинства работ, защитные свойства дисахаридов возрастают в ряду лактоза-сахароза-трегалоза [18]. Целью настоящего исследования была оптимизация условий лиофилизации биоматериала для последующей фекальной трансплантации, оценка жизнеспособности микроорганизмов и сопоставление молярных соотношений КЖК в полученных лиофилизатах по сравнению с исходными образцами кала. МАТЕРИАЛЫ И МЕТОДЫ
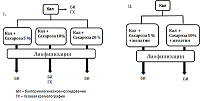
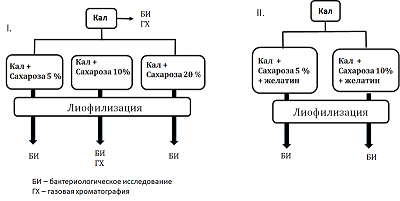
Материалом для исследования служил кал донора-волонтера, полученный после естественной дефекации. Донор-волонтер отвечал критериям отбора донора для включения в проект «Создание биобанка фекальных образцов здоровых доноров ФНКЦ ФХМ», одобренный Локальной этической комиссией ФНКЦ ФХМ от 06.09.2016. В работе использовали фосфатно-солевой буфер (PBS, в таблетках, «Биолот», Россия), сахарозу («Sigma-Aldrich», США), желатин пищевой. Подготовка образцов фекалий для лиофилизации В работе в качестве лиопротекторов использовали (а) сахарозу и (б) смесь сахарозы и пищевого желатина. (а) Свежий образец фекалий донора (40 г.) разводили в стерильном фосфатном буфере 0.1 М, рН 7.4 (конечное объемное соотношения фекалии:буфер 1:4). Для получения гомогенной массы использовали бытовой погружной блендер с объемом измельчителя 0.7 л («Philips», Китай). Гомогенизацию проводили в течении 1 мин. Полученную суспензию фильтровали через ситечко для чая (диаметр отверстий 1-2 мм) и разливали в пластиковые для замораживания объемом 50 мл, («Sarstedt», Германия). В зависимости от выбранной процентной концентрации сахарозы (5%, 10%, 20%) и конечного объема смеси (40 мл) в емкости добавляли рассчитанное количество сахарозы («Sigma-Aldrich») (2 г, 4 г, 8 г соответственно). Объем смеси доводили до 40 мл фосфатным буфером. Каждый приготовленный образец (40 мл) разливали в 2 стеклянных стакана для лиофилизации и замораживали при -80°С. б) Подготовку образцов фекалий для лиофилизации со смесью сахарозы и желатина проводили аналогично. Фекалии разводили в фосфатном буфере, содержащем 1% желатин, приготовленный согласно инструкции производителя. Изучение качественного и количественного бактериологического состава исходного кала и лиофилизированных смесей проводили согласно методическим рекомендациям «Бактериологическая диагностика дисбактериоза», утвержденным Министерством здравоохранения РФ 14.04.1997 и методическим рекомендациям «Бактериологическая диагностика заболеваний, вызываемых энтеробактериями», утвержденным Министерством здравоохранения РФ 2001 на базе бактериологической лаборатории центра. Газохроматографическое определение КЖК проводили на газовом хроматографе Кристалл 5000.2 («Хроматэк», Россия) с пламенно-ионизационным детектором (ДИП) и капиллярной хроматографической колонкой длиной 30 метров, внутренним диаметром 0.32 мм, толщиной пленки 1.0 мкм поперечно сшитой неподвижной жидкой фазы Карбовакс по методике, разработанной ранее [19] . Статистическую обработку результатов проводили с помощью программного пакета Statistica 10.0 для Windows. Достоверность результатов оценивали по критерию линейной корреляции Пирсона, значимыми считали значения более 0.85. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ После анализа литературных данных по применению защитных сред для лиофилизации [16-18, 20, 21] для дальнейшей практической работы из всего спектра предлагаемых лиопротекторов была выбрана сахароза как на наиболее описанный в научной литературе и доступный. Дополнительно использовали смесь сахарозы с желатином. Схема эксперимента представлена на рисунке 1. После бактериологического исследования и газохроматографического анализа исходного образца кала, он был лиофилизирован с различными выбранными концентрациями сахарозы (5%, 10% и 20%). Полученные лиофилизаты также были подвернуты бактериологическому и газохроматографическому исследованию.
Перед проведением бактериологического исследования проводили визуальную оценку структуры полученных лиофилизатов для их практической пригодности для ручного наполнения капсул. Образцы с содержанием сахарозы 5% и 10% обладали воздушной текстурой, хорошо поддающейся дроблению на мелкодисперсные частицы, напоминающие «кофейный порошок», удобный для наполнения капсул. Лиофилизаты не меняли своих физических свойств с течением времени. Образец с содержанием сахарозы 20% оказался непригоден для дальнейшей работы, так как не обладал сыпучестью, плохо дробился и с течением времени становился гигроскопичным. Лиофилизаты, содержащие смесь лиопротекторов сахароза-желатин, также не были взяты в дальнейшую работу, так как после лиофилизации они частично вспенивались, образуя пористую структуру, не пригодную для дробления в однородный порошок и дальнейшего технологического использования. Для определения микробного состава анализируемого биоматериала (свежий кал, лиофилизаты с содержанием сахарозы 5% и 10%) проводили бактериологическое исследование. В ходе исследования оценивали качественный состав популяции микробиоты и количественную представленность бактерий рода Bifidobacterium, Lactobacillus, Escherichia а также семейства Enterobacterales, в целом. Особое внимание уделяли видам, относящимся к нормальной микрофлоре кишечника: бифидобактериям и лактобактериям [20]. Известно, что нормальная микрофлора кишечника создает условия для оптимального протекания процессов пищеварения и всасывания в кишечнике, защищает от патогенных агентов и стимулирует ответные иммунные реакции организма [20] Согласно полученным данным в лиофилизированных образцах количественная представленность бифидобактерий и лактобактерий не изменялась по сравнению с исходным материалом (свежим калом) (табл. 1). Представленность других бактерий – энтеробактерий, энтерококков и кишечной палочки – существенно снизилось (в среднем на 2 порядка). Вероятно, это связано с различной чувствительность микроорганизмов к перепадам температуры (замораживанию-размораживанию). Согласно литературным данным, грамотрицательные бактерии зачастую более чувствительны к замораживанию, чем грамположительные, что объясняется особенностями строения клеточной стенки [21].
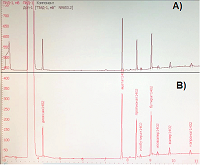
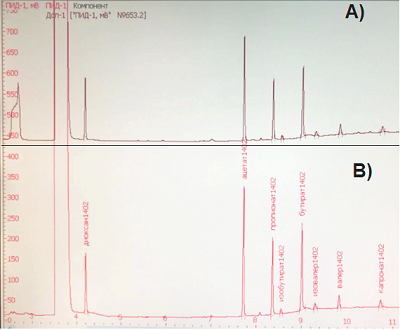
Особенностью данного образца является повышенный рост бактерий рода Proteus. Данные микроорганизмы являются представителями нормальной, условно-патогенной микрофлоры кишечника человека. Однако их наличие оказало определенное влияние на конечные результаты. Бактерии рода Proteus отличаются очень активной подвижностью и способны подавлять рост других микроорганизмов, характеризующихся более медленным ростом. Данное обстоятельство может затруднять идентификацию других видов микроорганизмов. Главным образом данное наблюдение относится к кишечной палочке, представленность которой в лиофилизированных образцах была несколько снижена. В целом анализ бактериального состава образцов кала донора (свежего и лиофилизированного) позволяет говорить о сопоставимом микробном пейзаже исследуемых препаратов. Несмотря на то, что бактериальный состав в лиофилизатах, содержащих 5% и 10% сахарозу, оказался практически идентичным, для дальнейшей отработки методики и последующего технологического использования было решено использовать лиофилизат с содержанием сахарозы 10%, так как такая концентрация лиопротектора, по данным литературы, более традиционна для лиофилизации бактерий [15, 17]. Воспроизводимость результатов («выживаемость» бактерий в лиофилизированных образцах кала) оценивали на основании 6 повторных серий экспериментов. Коэффициент линейной корреляции Пирсона между сериями составил r=0.853 Терапевтический эффект ТФМ поливалентен и связан не только с замещением микрофлоры, но и с обогащением метаболитами, обладающими «оздоравливающим» действием. К таким метаболитам относятся КЖК, продуцируемые кишечной микрофлорой. Молярное соотношение мажорных КЖК (ацетата, пропионата и бутирата) в толстой кишке и фекалиях здоровых индивидуумов относительно постоянно и составляет в среднем 60:20:20 [22], что позволяет использовать их для объективной оценки функционального состояние микробиоты кишечника. Методом газовой хроматографии были проанализированы концентрации и молярные соотношения КЖК исходного образца кала и исследуемых лиофилизатов, которые оказались идентичны между собой (рис. 2). Молярные соотношения мажорных КЖК в исследуемом образце составили 64:19:17.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ/p> Все процедуры, выполненные в исследовании с участием людей, соответствуют этическими стандартами институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики. От донора, включенного в исследование, было получено информированное добровольное согласие. ФИНАНСИРОВАНИЕ Работа выполнена в рамках госзадания. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|