|
Способы подготовки проб сыворотки крови при оценке фармакокинетики препаратов белковой природы на примере вискумина 1Государственный научно-исследовательский испытательный институт военной медицины, 195043, Санкт-Петербург, ул. Лесопарковая, 4; *е-mail: gniiivm_7@mil.ru 2 Научный центр «Сигнал», 115487, Москва, ул. Нагатинская, 16А Ключевые слова:масс-спектрометрия; сыворотка; фармакокинетика; лектины; количественный анализ DOI: 10.18097/BMCRM00152 ВВЕДЕНИЕ Создание новых лекарственных препаратов предполагает обязательные испытания безопасности и эффективности фармакотерапии. Этому способствуют результаты, полученные в процессе клинических исследований фармакокинетики, одним из этапов которых является разработка методики определения компонентов лекарственных препаратов в пробах биологического материала. Основными объектами исследования для оценки фармакокинетических процессов, таких как распределение, абсорбция, элиминация, являются пробы крови и мочи. При этом для определения содержания физиологически активных соединений белковой природы цельная кровь практически не используется, так как компоненты крови содержат большое количество сопутствующих соединений, которые влияют на чувствительность метода анализа и снижают степень извлечения целевых соединений. Клинические исследования лекарственных препаратов, содержащих в своем составе белковые соединения, как правило, предполагают анализ проб сыворотки и плазмы крови. Пробы мочи при изучении фармакокинетических параметров соединений белковой природы недостаточно информативны. В связи с этим наиболее представительными для оценки фармакокинетических параметров лекарственных соединений белковой природы являются пробы сыворотки крови [1]. В настоящее время определение белковых соединений в биологическом материале проводят в основном с применением иммунохимических методов, однако они имеют ряд ограничений. Как правило, подготовка проб биологического материала проводится иммунохимическими методами и наборами для выделения с использованием специфических антител, которые имеют ограниченный срок хранения. Иммунохимические методы не всегда обладают необходимой специфичностью, для них характерен риск получения как ложноположительных результатов из-за перекрестных реакций при наличии родственных белков, так и ложноотрицательных при наличии сопутствующих соединений в матрице. Кроме того, существуют объективные трудности производства и очистки специфических антител в отношении всего разнообразия белковых препаратов. На современном этапе развития аналитической химии определение экзогенных белков в сыворотке крови без использования антител возможно только при условии использования особо чувствительного метода анализа, в частности высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием высокого разрешения (ВЭЖХ-МСВР). В связи с этим актуальной задачей является разработка альтернативных способов выделения экзогенных белков на этапе подготовки проб сыворотки крови. В настоящее время перспективными и активно изучаемыми действующими компонентами антибластомных и иммуномодулирующих препаратов белковой структуры являются лектины растения омелы (Viscum Album), которые обладают выраженным противоопухолевым и иммуностимулирующим действием и имеют несколько большую область терапевтического применения и меньшую токсичность для клеток по сравнению с другими лектинами, например, клещевины (Ricinus Communis), абруса (Abrus Precatorius), момордики (Momordica Balsaminum) [2-5]. Данное исследование по разработке подходов к выделению экзогенных белков из сыворотки крови без использования специфичных антител проводили на лектине омелы — вискумине изоформы MLI [6-7]. МАТЕРИАЛЫ И МЕТОДЫ Исследование способов подготовки проб сыворотки крови лабораторных животных (крыс) проводили с использованием образца лектина Viscum Album, вискумина MLI («Sigma Aldrich», США). Выделение вискумина из пробы сыворотки крови проводили, используя следующие способы: осаждение белков раствором трихлоруксусной кислоты в изопропаноле («Sigma Aldrich», США), очистка от фракции наиболее выраженных белков с помощью колонок ProteoMiner («Bio-Rad», США), удаление альбумина с помощью набора Albumin Depletion Kit («Thermo Scientific», США) и колонок Aurum Affi-Gel Blue («Bio-Rad»). Ферментативное расщепление белков очищенных проб осуществляли на центрифужных фильтры Amicon («Millipore», Ирландия), объемом 0.5 мл, имеющих мембрану с отсечкой по массам 10 кДа. В процессе разработки способа подготовки проб использовали хроматографическую систему Vanquish («Thermo Scientific») с гибридным масс-спектрометрическим детектором высокого разрешения Q Exactive HF-X, оснащенным квадрупольным масс-фильтром заряженных частиц, высокоэффективной ячейкой соударения (HCD) и орбитальной ионной ловушкой («Thermo Scientific»). Хроматографическое разделение компонентов анализируемых образцов проводили с использованием аналитической колонки с привитой обращённой фазой С-18, Zorbax 300 SB, длиной 100 мм, внутренним диаметром 2.1 мм, размер частиц сорбента 3.5 мкм («Agilent», США). Градиентный режим элюции создавали, используя подвижные фазы: А — 0.1 % раствор муравьиной кислоты, и Б — ацетонитрил с 0.1 % муравьиной кислоты. Методы анализа Выбор методов выделения вискумина из проб сыворотки крови без применения специфических антител осуществляли на основании литературных данных [8-10], где представлены способы не иммунохимического определения белковых соединений. Модельные пробы вискумина готовили согласно методикам, представленным в статье Li и соавт. [11]. Выбор наиболее эффективного реагента для солюбилизации осажденных белков проводили с использованием следующих растворов: 0.1 % раствор реагента Invitrosol (Inv), 0.1 % раствор реагента ProteaseMax Surfactant (PM) («Promega», США), 0.1 % раствор реагента RapiGest (RG) («Waters», США), 0.1 % раствор реагента PPS Silent Surfactant (PPS) («Agilent»). Дополнительно для растворения использовали два вида буферных растворов: 0.1 % раствор Твин-20 (Tw) и буферный раствор 0.1 М трис с добавлением 8 М мочевины («Panreac», Испания) в сочетании с 0.1 % раствора Твин-20 (DВ). После добавления 1 % раствора трихлоруксусной кислоты в аликвоты сыворотки крови, осадок, содержащий белковую фракцию, перерастворяли в указанных растворах реагентов и центрифугировали с ускорением 12000 g и термостатированием 18°С. Супернатант подвергали ферментативному расщеплению на фильтре. Осаждение белков 1 % раствором трихлоруксусной кислоты в изопропаноле Осаждение белков сыворотки крови провели, используя аликвоту объемом 0.2 мл с внесением вискумина в диапазоне разведений 0.5–100 мкг/мл путем добавления 2 мл 1 % раствора трихлоруксусной кислоты в изопропаноле (1 % ТХУК/ИПС). Полученный осадок белков промывали 0.2 мл метанола с последующим удалением надосадочного слоя. Затем осадок растворяли в 0.1 мл 0.1% растворе Твин-20. Аликвоту полностью переносили на центрифужный фильтр и подвергали ферментативному расщеплению. Удаление белков матрицы с помощью набора ProteoMiner («Bio-Rad») Удаление наиболее представленных белков сыворотки крови с помощью колонок ProteoMiner Large Capacity осуществляли посредством отбора по 1 мл пробы с внесением вискумина в диапазоне разведений 0.5–100 мкг/мл. Процедуру выполняли в соответствии с рекомендациями производителя колонок [12]. Очищенную фракцию переносили на фильтр и подвергали ферментативному расщеплению. Удаление альбумина с помощью набора Albumin Depletion Kit («Thermo Scientific») Удаление альбумина с помощью набора Albumin Depletion Kit из сыворотки крови проводили с использованием 0.03 мл пробы с внесением вискумина в диапазоне разведений 0.5–100 мкг/мл. Очистку пробы сыворотки осуществляли в соответствии с рекомендациями производителя набора [13]. Фракцию, очищенную от альбумина, переносили на центрифужный фильтр и подвергали ферментативному расщеплению. Удаление альбумина с помощью набора Aurum Affi-Gel Blue («Bio-Rad») Подготовку выполняли с использованием пробы объемом 0.125 мл с внесением вискумина в диапазоне разведений 0.5–100 мкг/мл. Очистку пробы сыворотки проводили в соответствии с рекомендациями производителя колонок [14]. Фракцию, очищенную от альбумина, переносили на центрифужный фильтр и подвергали ферментативному расщеплению. Ферментативное расщепление белков Подготовку белков и их последующий протеолиз осуществляли методом концентрирования на фильтре (filter-aided sample preparation – FASP), который подходит для расщепления белков клеточных или тканевых лизатов, содержащих различные детергенты и широко используется в протеомных исследованиях [15-17]. Метод FASP заключается в использование фильтра с мембраной с отсечкой по молекулярным массам в качестве «реактора», на котором модифицируют и подвергают гидролизу сложные белковые смеси, а также эффективно удаляют детергенты и избытки реагентов, которые не рекомендуется использовать при подготовке проб для масс-спектрометрического детектирования [18, 19]. Подготовка образца, содержащего вискумин, для установления хроматомасс-спектрометрических характеристик проведена по протоколу FASP, предложенному Wiśniewski и соавт. [20] с внесением некоторых изменений с целью увеличения чувствительности и воспроизводимости метода. В частности, процедуру подготовки проб для ферментативного расщепления проводили на центрифужных фильтрах с отсечкой по массам 10 кДа. Фильтры предварительно выдерживали в течение 16 ч в 0.1 % водном растворе Твин-20 для снижения сорбции белковых соединений и пептидов на мембране фильтра. В качестве алкилирующего агента был использован более устойчивый к окислению 4-винилпиридин («Sigma Aldrich»), который образует более прочные производные с цистеином, что позволяет уменьшить количество сайтов пропусков при установлении аминокислотной последовательности (АКП) белков в ходе анализа масс-спектров пептидов. Промывку фильтра между стадиями денатурации, восстановления и алкилирования осуществляли буферным раствором, не содержащим мочевину: 0.1 М трис, рН 8.5. Замену буферного раствора перед протеолизом проводили, дважды промывая фильтр по 0.1 мл буферного раствора 0.05 М трис, рН 8.0. с последующим центрифугированием с ускорением 12000 g и термостатированием 18°С. Фильтр перемещали в новый пробоприёмник и вносили на фильтр 0.1 мл буферного раствора 0.05 М трис, рН 8.0. Ферментативное расщепление белков, как правило, проводят трипсином, расщепляющим пептидные связи, образованные карбоксильными группами; это позволяет получить пептиды, имеющие молекулярные массы от 400 Да до 2000 Да – оптимальный диапазон масс для анализа методами масс-спектрометрии [21]. В представленном исследовании применили смесь трипсина и лизилэндопептидазы (расщепление пептидных связей после K и R, за исключением сайтов КP, RP) для получения более информативной пептидной карты. Расщепление белков осуществляли смесью ферментов трипсина и лизилэндопептидазы («Promega») в растворе 0.01 М HCl с общей концентрацией ферментов 0.2 мг/мл объемом 0.01 мл (16 ч при температуре 37°С). После протеолиза фильтр центрифугировали с ускорением 12000 g и термостатированием 18°С до полного удаления раствора с фильтра. Окончательную элюцию пептидов с фильтра провели внесением на фильтр 0.05 мл раствора 0.1 % муравьиной кислоты («Fluka», США) в смеси ацетонитрила («Sigma Aldrich») и воды в объемном соотношении 2:8 (v/v) и центрифугировали досуха: с ускорением 12000 g и термостатированием 18°С в течение 15 мин; процедуру выполняли дважды. Полученную смесь пептидов, находящуюся в пробоприёмнике, высушивали в вакуумном концентраторе при температуре 60°С до минимального объема (0.005 мл). Затем пептидный концентрат разводили в 0.05 мл 0.1 % раствора муравьиной кислоты в смеси ацетонитрила и воды в объемном соотношении 2:98 (v/v), перемешивали на вортексе и центрифугировали. Конечный раствор пептидов переносили в виалу с силанизированной вставкой вместимостью 0.25 мл и анализировали методом ВЭЖХ-МСВР. Условия масс-спектрометрического детектирования Анализ пептидов, полученных в ходе ферментативного расщепления образца вискумина с концентрацией 0.01 мг/мл, проводили методом масс-спектрометрического детектирования с ионизацией пептидов методом электроспрея в режиме положительной ионизации (ESI+). Регистрацию пептидов осуществляли в двух последовательно переключающихся режимах работы масс-спектрометра: – Full Scan MS (Full Scan) - сканирование полного ионного тока ионов-предшественников в заданном диапазоне значений m/z; – Data Depended MS2 (dd-MS2) – сканирование полного ионного тока ионов-фрагментов, полученных при диссоциации 10 наиболее интенсивных ионов-предшественников – метод анализ-зависимого масс-спектрометрического детектирования. Определение пептидов вискумина осуществляли путем анализа полученных масс-хроматограмм с использованием программного комплекса PeakStudio Х («Bioinformatics Solutions Inc.», Канада). Параметры обработки масс-спектров включали следующие установленные ограничения: допустимая погрешность определения массы ионов-продуктов – 0.02 Да, максимально допустимое количество одновременно присутствующих пост-трансляционных модификаций (ПТМ) у пептида – 3 из 4-х возможных: карбамидометилирование (постоянная модификация), S-пиридилэтилирование (C), деамидирование (N, Q) и окисление (М) (вариативные модификации), допустимая погрешность определения массы ионов-прекурсоров – 15 ppm. Дальнейший целевой анализ методом ВЭЖХ-МСВР с детектированием в двух последовательно переключающихся режимах работы масс-спектрометра: Full Scan и в режиме мониторинга параллельных реакций – Parallel Reaction Monitoring (PRM). Режим PRM характеризуется более высокой чувствительностью по сравнению с dd-MS2 за счет выделения в первом квадруполе указанных в параметрах метода целевых ионов пептидов, их дальнейшей фрагментации в ячейке соударения и детектирования ионов-продуктов в масс-анализаторе Orbitrap. Идентификацию белка проводили по выбранным четырем пептидам вискумина. Количественную оценку содержания лектина в модельных пробах сыворотки крови проводили по одному наиболее интенсивному пептидному иону. Условия хроматографического разделения пептидов при анализе методом анализ-зависимого масс-спектрометрического сканирования (dd-MS2) Хроматографическое разделение смеси пептидов проводили в режиме градиентного элюирования: от 0 до 2 мин 2% подвижной фазы Б , от 2 мин до 38 мин линейный градиент до 45% подвижной фазы Б, от 38 мин до 39 мин линейный градиент до 95 % подвижной фазы Б, от 39 мин до 44 мин 95% подвижной фазы Б, от 44 мин до 45 мин линейный градиент до 2% подвижной фазы Б, до 50 мин 2 % подвижной фазы Б. Условия хроматографического разделения пептидов при анализе методом мониторинга параллельных реакций (PRM) Градиентное элюирование пептидов проводили следующим образом: от 0 до 1 мин 2% подвижной фазы Б, от 1 мин до 12 мин линейный градиент до 40% подвижной фазы Б, от 12 мин до 13 мин линейный градиент до 95% подвижной фазы Б, от 13 мин до 16 мин 95% подвижной фазы Б, от 16 мин до 16.01 мин линейный градиент до 2% подвижной фазы Б, 2% подвижной фазы Б до 35 мин. РЕЗУЛЬТАТЫ В процессе разработки способа подготовки проб сыворотки крови и определения содержания вискумина нами были проведены исследования по выбору характеристичных пептидов лектина, т.е. присутствующих только в составе целевого соединения. По результатам анализа образца пептидного лизата вискумина с концентрацией 0.01 мг/мл, проведенного методом анализ-зависимого масс-спектрометрического сканирования, были идентифицированы пептиды лектина и выбраны наиболее интенсивные характеристичные пептиды: двух- или трехзарядные молекулярные ионы с наибольшей интенсивностью сигнала на масс-хроматограмме, не имеющие модифицированных аминокислотных остатков (табл. 1).
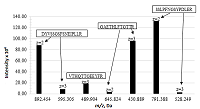
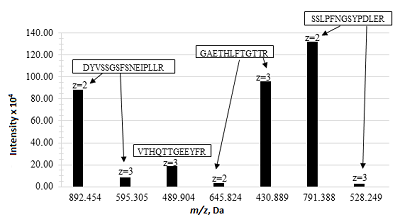
Анализ полученных данных позволил выявить следующие наиболее интенсивные ионы пептидов: DYVSSGSFSNEIPLLR (m/z 892.454, z=2+), GAETHLFTGTTR (m/z 430.889, z=3+) и SSLPFNGSYPDLER (m/z 791.388, z=2+). В качестве иона пептида для количественной оценки был выбран пептид SSLPFNGSYPDLER (m/z 791.388, z=2+), имеющий максимальную интенсивность и отвечающий всем требованиям, предъявляемым к характеристичным пептидам (рис. 1).
Выбранные пептиды использовали при создании метода PRM, позволяющего сократить время анализа и повысить чувствительность при определении вискумина. Поскольку осаждение органическими растворителями ведёт к денатурации белковых молекул, вследствие чего ухудшается их растворимость, при использовании осаждения белков 1% ТХУК/ИПС дополнительно была проведена оценка растворимости осажденных белков в растворах различных видов сурфактантов. По результатам исследования был выбран 0.1% раствор Твин-20 (табл. 2) с наибольшей степенью извлечения вискумина из сыворотки крови – 8.2 ± 2.2%.
Результаты определения содержания вискумина в модельных пробах сыворотки крови с внесением лектина в диапазоне концентраций 0.5–100 мкг/мл, подготовленных различными способами, представлены таблице 3.
ОБСУЖДЕНИЕ Оценка результатов проведенного исследования была проведена по показателю степени извлечения вискумина из проб сыворотки (см. дополнительные материалы). Среди использованных способов подготовки проб наиболее чувствительным оказался способ с применением колонок ProteoMiner, позволяющий количественно определить лектин в сыворотке на уровне 0.5 мкг/мл со степенью извлечения 2.7 ± 0.6 %. При этом наибольшая степень извлечения лектина (6.9 ± 1.6%) была достигнута при использовании метода осаждения белков раствором 1% ТХУК/ИПС, однако со сравнительно низкой чувствительностью 5 мкг/мл. Использование колонок ProteoMiner для деплеции белков сыворотки позволило выделить целевой белок в наименьшей концентрации, что объясняется принципом действия колонок, который основан на разнице в сродстве компонентов сыворотки крови к лигандам, привитым к сорбенту колонок. Тем не менее, несмотря на эффективность применения различных способов подготовки проб сыворотки крови для определения вискумина, все они показали довольно низкую степень извлечения целевого белка. Такой результат может быть обусловлен матричным эффектом, создаваемым высокой концентрацией глобулярных белков в сыворотке крови. Подготовка проб описанными способами была проведена для разных исходных объемов проб сыворотки, что не учитывали в вышеизложенном исследовании. По этой причине целесообразно сравнить эффективность выбранных на первом этапе подходов для равных объемов исходной пробы. Сравнительное исследование методов подготовки сыворотки крови проводили, используя для очистки модельных проб различные исходные объемы: 0.2 мл, 0.5 мл, 1,0 мл с внесением следующих концентраций вискумина: 1 мкг/мл, 5 мкг/мл, 10 мкг/мл. Пробы подготавливали с применением наиболее эффективных способов: удаление альбумина осаждением в 1% растворе ТХУК/ИПС и очистки на колонках ProteoMiner.
Результаты исследования, представленные в таблице 4, показали, что увеличение объема пробы не привело к повышению степени извлечения вискумина из сыворотки крови. Использование колонок ProteoMiner и способа удаления альбумина осаждением в 1% растворе ТХУК/ИПС характеризуются равноценным уровнем выделения вискумина со степенью извлечения в пределах 7% в объеме пробы, не превышающей 0.2 мл. Тем не менее, предел обнаружения лектина при использовании способа удаления альбумина 1% раствором ТХУК/ИПС значительно снижается при снижении его концентрации в сыворотке. Таким образом, по результатам проведенного исследования установлено, что при использовании колонок ProteoMiner чувствительность способа подготовки сыворотки крови методом удаления мажорных белков превосходит 0.5 мкг/мл, что значительно выше, чем при использовании метода осаждения 1% раствором ТХУК/ИПС. ЗАКЛЮЧЕНИЕ В рамках проведенных исследований установлено, что подходы без применения специфических антител можно использовать как альтернативные иммунохимическим способам подготовки проб сыворотки крови для выделения и количественной оценки содержания белковых компонентов лекарственных средств. На примере компонента лекарственного средства лектина растения Viscum Album - вискумине MLI - установлены пределы его определения в сыворотке. В результате сравнительной оценки выбран оптимальный способ подготовки проб сыворотки крови с применением колонок ProteoMiner. Предложенный способ совместно с методом ВЭЖХ-МСВР рекомендуется использовать для количественной оценки содержания целевых компонентов при проведении фармакокинетических исследований лекарственных препаратов в тех случаях, когда использование специфических антител по тем или иным причинам не представляется возможным. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не содержит исследований с использованием людей в качестве объектов исследования. Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены. БЛАГОДАРНОСТИ Авторы выражают благодарность руководству Государственного научно-исследовательского испытательного института военной медицины за возможность проведения исследований. ФИНАНСИРОВАНИЕ Исследование проведено по теме научно-исследовательской работы в рамках выполнения Государственного оборонного заказа. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00152) на сайте журнала. ЛИТЕРАТУРА
|