К 40-летию Института физиологически активных веществ РАН
|
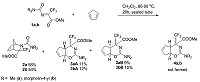
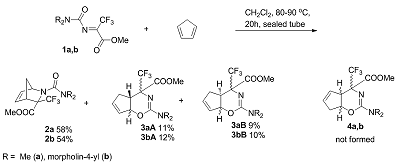
Карбамоилимины метилтрифторпирувата в азареакции Дильса-Альдера с циклопентадиеном Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: alaks@ipac.ac.ru Ключевые слова: карбамоилимины; метилтрифторпируват; циклопентадиен; [2+4]-циклоприсоединение; азанорборнены; азабицикло[2.2.1]гептены; тетрагидроциклопента[e][1,3]оксазины DOI: 10.18097/BMCRM00016 ВВЕДЕНИЕ Соединения с азанорборненовым остовом представляют перспективный класс биологически активных веществ, проявляющих в зависимости от природы заместителей антиоксидантную [1], антимикробную [2], зооцидную [3] и пестицидную [4] активности. Одним из путей синтеза представителей гетероатомных бициклических соединений, а именно азабицикло[2.2.1]гепт(ен)анов (азанорборн(ен)анов), является реакция [2+4]-циклоприсоединения иминов к циклопентадиену. Обычно в реакцию Дильса-Альдера вступают нуклеофильные диены и электрофильные диенофилы, и с этой точки зрения взаимодействие электронодефицитных диенофилов – N-замещенных иминов гексафторацетона и метилтрифторпируватов с электроноизбыточными диенами – производными циклопентадиена – следует рассматривать как реакцию с «обратными электронными требованиями» [5]. Ранее на большом числе примеров изучено поведение N-замещенных иминов гексафторацетона и метилтрифторпируватов в реакции [2+4]–циклоприсоединения с циклопентадиеном и его производными, приводящей к образованию азанорборненов [6-8]. Цель настоящего исследования заключалась в установлении особенностей поведения N-карбамоилиминов метилтрифторпирувата в реакции с циклопентадиеном и доказательном декларировании строения как мажорных, так и минорных продуктов этой реакции. МАТЕРИАЛЫ И МЕТОДЫ Спектры ЯМР 1H, 13C и 19F записывали на спектрометре Bruker DPX-200 («Bruker Daltonics», США) при частотах 200.13, 50 и 188 MHz соответственно относительно SiMe4 (внутренний эталон) и CFCl3 (внутренний эталон). Элементный анализ выполнен на CHNS/O элементном анализаторе Vario Micro cube («Elementar GmbH», Германия). Общая методика синтеза метил 2-карбамоил-3-(трифторметил)-2-азабицикло[2.2.1]гепт-5-ене-3-карбоксилатов 2a,b и метил 2-замещенных-4-(трифторметил)-4,4a,5,7a-тетрагидроциклопента[e][1,3]оксазин-4-карбоксилатов 3a,b Раствор 2 ммоль циклопентадиена, 2 ммоль имина 1a или 1b в 10 мл CH2Cl2 нагревали 20 ч при 80 - 90°C в запаянной ампуле. Ампулу вскрывали, растворитель упаривали. Соединения 2a,b и 3a,b выделяли колоночной хроматографией на силикагеле (элюент – гексан/CH2Cl2 (1/1). Метил 2-(диметилкарбамоил)-3-(трифторметил)-2-азабицикло[2.2.1]гепт-5-ен-3-карбоксилат 2a. Выход 54%; бесцветное масло. 1H ЯМР (200 MГц, CDCl3, δ): 2.39 (ддт, 1H7b, 2J7a/7b = 17.7 Гц, 3J7b/4 = 7.6 Гц, 3J7b/1 = 4J7b/2 = 2.4 Гц, CH2), 2.69 (ддт, 1H7a, 2J7a/7b = 17.7 Гц, 3J7a/4 = 7.6 Гц, 3J7a/1 = 4J7a/2 = 2.4 Гц, CH2), 2.86 (с, 6H, CH3N), 3.34 (квартет, 1H, 3J4/7a = 3J4/7b = 3J4/1 = 7.6, C(4)H), 3.81 (с, 3H, CH3O), 5.13 (дт,1H, 4J1/4 = 7.3 Гц, 3J1/7a = 3J1/7b = 2.4 Гц, C(1)H), 5.80 (дт, 1H, 3J2/3 = 5.6 Гц, 3J2/1 = 4J2/4 = 2.4, C(2)H=), 6.16 (дт,1H, 3J3/2 = 5.6 Гц, 3J3/4 = 4J3/4 = 2.4 Гц, C(3)H=). 13C ЯМР (50 MГц, CDCl3, δ): 32.8 (квартет, 3JCF = 2.2 Гц, CHCCF3), 36.6 (CCH2C), 39.7 (CH3N), 53.4 (CH3O), 67.4 (квартет, 2JCF = 28 Гц, CHCCF3), 82.8 (CHN), 124.7 (квартет, 1JCF = 283 Гц, CF3), 128.9 (CH=), 139.9 (CH=), 157.2 (NC=O), 170.8 (CC=O). 19F ЯМР (188.29 MГц, CDCl3, δ): -72.9 с. Rf = 0.45, гексан/CH2Cl2 (1/4). Вычислено, %: C, 49.32, H, 5.17, N, 9.59. C12H15F3N2O3. Найдено, %: C, 49.46, H, 5.36, N, 9.36. Метил 2-(морфонил-4-илкарбонил)-3-(трифторметил)-2-азабицикло[2.2.1]гепт-5-ен-3-карбоксилат 2b. Выход 48%; бесцветное масло. 1H ЯМР (200 MГц, CDCl3, δ): 2.40 (дддд, 1H7b, 2J7a/7b = 17.3 Гц, 3J7b/4 = 7.9 Гц, 3J7b/1 = 2.5 Гц, 4J7b/2 = 1.6 Гц, CH2), 2.40 (дддд, 1H7b, 2J7a/7b = 17.3 Гц, 3J7b/4 = 7.5 Гц, 3J7b/1 = 2.5 Гц, 4J7b/2 = 1.7 Гц, CH2), 3.33 (квартет, 1H, 3J4/7a = 3J4/7b = 3J4/1 = 7.5, C(4)H), 3.34 – 3.42 (м, 4H, CH2N), 3.59 – 3.67 (м, 4H, CH2O), 3.82 (с, 3H, CH3O), 5.13 (дт,1H, 4J1/4 = 7.5 Гц, 3J1/7a = 3J1/7b = 2.1 Гц, C(1)H), 5.80 (дт, 1H, 3J2/3 = 5.8 Гц, 3J2/1 = 4J2/4 = 2.4 C(2)H=), 6.16 (дт,1H, 3J3/2 = 5.8 Гц, 3J3/4 = 4J3/4 = 2.4 Гц, C(3)H=). 13C ЯМР (50 MГц, CDCl3, δ): 32.7 (квартет, 3JCF = 2.2 Гц, CHCCF3), 39.7 (CCH2C), 44.8 (CH2N), 53.4 (CH3O), 66.5 (CH2O), 67.0 (квартет, 2JCF = 28 Гц, CHCCF3), 82.8 (CHN), 124.5 (квартет, 1JCF = 283 Гц, CF3), 128.7 (CH=), 139.9 (CH=), 156.5 (NC=O), 170.0 (CC=O). 19F NMR (188.29 MГц, CDCl3, δ): -74.9 с. Rf = 0.32. Вычислено, %: C, 50.30, H, 5.13, N, 8.38. C14H17F3N2O4. Найдено, %: C, 50.44, H, 5.32, N, 8.18. Rf = 0.35, гексан/CH2Cl2 (1/4). Метил 2-(диметиламино)-4-(трифторметил)-4,4a,5,7a- тетрагидроциклопента[e][1,3]оксазин-4-карбоксилат 3a (смесь изомеров). Выход 20%; бесцветное масло. 1H ЯМР (200 MГц, CDCl3, δ): 1.56 – 1.70 (м, 1 H, CH2), 2.09 (дт, 0.54 H, 2JHH = 8.8 Гц, 2JCH = 1.5 Гц, CH2), 2.27 (дт, 0.46 H, 2JHH = 8.8 Гц, 2JHH = 1.5 Гц, CH2), 2.81 (с, 2.7 H, CH3N), 2.84 (с, 3.0 H, CH3N), 2.86 – 2.96 (м 1 H, CH), 3.53 – 3.59 (уш. с, 0.5 H, CH), 3.75 (с, 1.6 H, CH3O), 3.77 – 3.81 (уш. с, 0.5 H, CH), 3.87 (с, 1.4 H, CH3O), 4.65 – 4.77 (м, 1 H, CH), 6.19 – 6.28 (м, 0.54 H, =CH), 6.32 – 6.43 (м, 0.46 H, =CH), 6.69 – 6.80 (м, 1 H, =CH). 13C ЯМР (50 MГц, CDCl3, δ): меньший изомер: 38.7 (CH3N), 47.2 (квартет, 4JCF = 1 Гц, CH2), 51.6 (квартет, 3JCF = 3 Гц, CHCCF3), 53.3 (CHO), 65.5 (CH3O), 70.6 (квартет, 2JCF = 29 Гц, CCF3), 123.9 (квартет, 1JCF = 286 Гц, CF3), 135.1 (CH=), 139.7 (CH=), 159.7 (C=N), 168.3 (C=O); больший изомер: 38.8, 47.6 (квартет, 4JCF = 1 Гц, CH2), 53.0 (CHO), 53.1 (квартет, 3JCF = 1.0 Гц, CHCCF3), 64.8 (CH3O), 71.6 (q, 2JCF = 30 Гц, CCF3), 124.4 (квартет, 1JCF = 287 Гц, CF3), 136.3 (CH=), 140.7 (CH=), 159.9 (C=N), 167.0 (квартет, 3JCF = 1.5 Гц, (C=O). 19F ЯМР (188.29 MГц, CDCl3, δ): -62.7 (с, 0.46 CF3), -64.0 (с, 0.54 CF3). Rf = 0.18, гексан/CH2Cl2 (1/4). Метил 2-(морфолин-4-ил)-4-(трифторметил)-4,4a,5,7a- тетрагидроциклопента [e][1,3]оксазин-4-карбоксилат 3b (смесь изомеров). Выход 16%; бесцветное масло. 1H ЯМР (200 MГц, CDCl3, δ): 1.51 – 1.66 (м, 1 H, CH2), 2.01 (уш. д, 0.7 H, 2JHH = 9.0 Гц, CH2), 2.08 (уш. д, 0.3 H, 2JCH = 8.8 Гц, CH2), 2.97 -3.20 (м, 2.2 H, CH2N), 3.22 -3.41 (м, 2.4 H, CH2N), 3.49 -3.85 (м, 7.4 H, CH2O + CH3O), 4.56 – 4.66 (м, 1 H, CH), 6.15 – 6.24 (м, 0.7 H, =CH), 6.29 – 6.39 (м, 0.3 H, =CH), 6.58 – 6.73 (м, 1 H, =CH). 19F ЯМР (188.29 MГц, CDCl3, δ): -61.9 (с, 0.3 CF3), -63.3 (с, 0.7 CF3). Rf = 0.15, гексан/CH2Cl2 (1/4). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В нашей последней работе была представлена реакция N-диметил- 1a и N-морфолинил- 1b иминов метилтрифторпирувата с циклопентадиеном, в которой в качестве основных продуктов образуются азанорборнены 2a,b [9]. Однако пониженная по сравнению с другими ацилиминами реакционная способность карбамоилиминов 1a,b в реакции с циклопентадиеном потребовала длительного нагревания реакционной смеси при 80 – 90°C в замкнутом объеме. В этих условиях кроме образования азанорборненов протекала конкурентная реакция, в которой имины 1a,b реагировали как гетеродиены, а циклопентадиен как диенофил, образуя при этом тетрагидроциклопента[e][1,3]оксазины 3a,b (рис. 1). Так, 19F ЯМР спектры реакционной смесей иминов 1 с циклопентадиеном после 20 ч нагревания в запаянной ампуле показали сигналы азанорборнена 2a (58%), оксазинов 3aA (11%), 3aB (9%) и непрореагировавшего имина 1a (15%), в первом случае, и азанорборнена 2b (54%), оксазинов 3bA (12%), 3bB (10%) и непрореагировавшего имина 1b (13%), во втором случае.
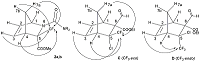
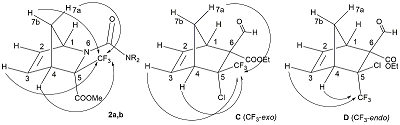
После обработки реакционной смеси и последующей хроматографии на силикагеле были выделены норборнены 2a,b в индивидуальном виде, а также оксазины 3a,b в виде смеси диастереомеров. Для определения структуры соединений 2 и 3 был выполнен ряд ЯМР экспериментов, включающих двойной резонанс на ядрах 1H, DEPT и регистрация спектров ЯМР 1H{19F} с подавлением взаимодействия протонов с атомами фтора. Стереохимическое отнесение сигналов атомов азанорборненов 2a,b и тетрагидроциклопента[e][1,3]оксазинов 3a,b было выполнено сравнением полученных данных со схожими замещенными норборненами [10]. Ранее были синтезированы и полностью охарактеризованы все диастереомеры норборнена со сходной структурой (на рис. 2 показаны структуры C и D – два из четырех диастереомеров), структура которых определена на основе NOE-взаимодействия между атомами фтора в трифторметильной группе и H(3), H(4), и/или H(7a) [8]. При этом только для одного диастереомера С, имеющего CF3-группу в exo-положении, было определено 1H-19F взаимодействие между атомами фтора CF3-группы и атомами водорода метиленового мостика. В нашем случае регистрация спектров 1H{19F} с подавлением взаимодействия протонов с атомами фтора показала очень маленькую константу спин-спинового взаимодействия (КССВ) 5JHF для атомов водорода H(7a) и H(7b) со значением не более 0.1 Гц, и, как следствие, стало возможным проявление структуры ранее уширенных сигналов протонов мостика и измерение дальней КССВ 4JHH. На основании этих данных можно заключить, что в реакции иминов 1a,b с циклопентадиеном образуются только изомеры 2a,b, имеющие CF3-группу в exo-положении. Строение тетрагидроциклопента[e][1,3]оксазинов 3a,b определяли на основании их 13C ЯМР спектров. Так, сигналы атома углерода метиленовой группы циклопентенового кольца соединений 3 со значениями 47.2 и 47.6 м.д. проявляются как квартеты с КССВ 4JCF = 1 Гц принадлежат к метиленовым атомам одного типа и указывают на то, что альтернативную структуру тетрагидроциклопента[e][1,3]оксазинов 4a,b, которая могла бы образоваться, следует исключить на основании того, что: 1) разница химических сдвигов этих атомов углерода в гетероциклах 3 и 4 должна была бы быть больше, чем 0.4 м.д.; 2) в этом положении метилена циклопентенового кольца КССВ 5JCF должна была бы быть меньше 1 Гц или отсутствовать. Представленные на рис. 1 изомеры 3A и 3B различаются положением атомов водорода у атомов углерода С(4a) и С(7a), при этом точное определение стереоконфигурации тетрагидроциклопента[e][1,3]оксазинов в настоящее время затруднено. Следует отметить, что структура тетрагидроциклопента [e][1,3]оксазина 4 (CF3-группа вместо заместителя NR2) была представлена в работе [11], но сведения о свойствах и ее спектральные данные отсутствуют.
Остальные спектральные характеристики соединений 2 и 3 соответствуют предложенным структурам. Сигналы атомов в спектрах 1H и 19F ЯМР регистрируются в обычных областях, присущих представленным группам. В спектрах 13C ЯМР наблюдаются характерные квартеты CF3C-атомов с химическими сдвигами 124 м.д. и КССВ 1JCF = 283-287 Гц для соединений 2a,b и 67 - 71 м.д. с КССВ 2JCF = 28 - 30 Hz для соединений 3a,b. Сигналы остальных атомов углерода азанорборненов 2a,b были отнесены следующим образом: сигналы при 32 м.д. принадлежат узловым атомам углерода CHCCF3 поскольку имеют КССВ CSSC 3JCF = 2.2 Гц, сигналы других узловых атомов углерода CHN наблюдаются при 82.8 м.д.; сигналы атомов метиленового мостика наблюдаются в области 36 – 40 м.д.; сигналы атомов при двойной связи цикла отнесены к NCCH = -128.9 м.д. и CCCH = -139.9 м.д. Таким образом, в данном сообщении представлен синтез и анализ структуры азанорборненов и новых, не представленных ранее в литературе, бициклических гетероциклов - тетрагидроциклопента[e][1,3]оксазинов. ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00016) на сайте журнала. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-03-00696) и Государственного задания 2018 года (тема № 0090-2017-0023). ЛИТЕРАТУРА
|