|
СОДЕРЖАНИЕ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ |
Протеолипосомы как способ иммобилизации мембранных белков для SPR-анализа на примере взаимодействия CYP3A4 и CYB5A человека 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, Погодинская ул., 10; *e-mail: leonid.kaluzhskiy@ibmc.msk.ru Ключевые слова: поверхностный плазмонный резонанс; цитохром Р450; цитохром b5; протеолипосомы DOI: 10.18097/BMCRM00160 ВВЕДЕНИЕ
Известно, что в большинстве геномов различных организмов от 20% до 30% генов кодируют мембранные белки [1, 2]; в геноме человека этот показатель составляет 30% [1]. Мембранными белками, как правило, являются рецепторы, белки, отвечающие за межклеточные взаимодействия, ионные каналы, белки-транспортеры, некоторые электрон-транспортные белки, а также ферменты. Мембранные белки являются мишенями для 50% всех современных лекарств [3]. Одним из классов мембранных белков, значимых с точки зрения фармакологии, являются ферменты монооксигеназной системы – цитохромы P450 и их белки-переносчики электронов. Микросомальные системы цитохромов P450 человека состоят из трёх компонентов, являющихся мембранными белками – гемопротеина цитохрома P450 (CYP), NADPH-зависимой цитохром Р450 редуктазы (CPR) и небольшого регуляторного гем-содержащего белка цитохрома b5 (CYB5A) [4]. Микросомальные CYP осуществляют метаболизм ксенобиотиков, синтез стероидных гормонов и других биологически активных соединений. Некоторые, микросомальные CYP человека рассматриваются как перспективные мишени для антигиперхолестеринемической терапии (ингибиторы CYP51) [5] и как мишени для противораковых препаратов (ингибиторы CYP19 и CYP17) [6, 7]. По этой причине огромное значение приобретает исследование межмолекулярных взаимодействий цитохромов P450 как с белками-партнёрами, так и с возможными прототипами лекарств. Одним из наиболее высокопроизводительных и высокочувствительных методов изучения межмолекулярных взаимодействий является биосенсорный анализ, принцип работы которого основан на анализе эффекта поверхностного плазмонного резонанса (surface plasmon resonance, SPR). Однако, возникает проблема иммобилизации мембранных белков на оптический чип биосенсора. Важным является ориентированная иммобилизация таких белков в нативных условиях, с соблюдением правильной ориентации белковой глобулы в пространстве относительно поверхности сенсора. Существуют различные методы, позволяющие в той или иной мере воспроизвести данные условия на оптическом чипе биосенсора, например, метод нанодисков [8]. Ранее нами был разработан и описан метод, предполагающий прямую иммобилизацию нативных мембранных белков в планарную бислойную липидную мембрану на поверхности чипа биосенсора [9]. Одним из широко распространённых подходов для работы с мембранными белками с помощью различных методов остается конструирование протеолипосом, содержащих мембранные белки [10]. В данной работе мы на примере белковых партнёров CYP3A4 и CYB5A приведено сравнение двух методов приготовления протеолипосом: встраивание мембранного белка (CYB5A) в липосомы, насыщенные детергентом, и встраивание мембранного белка в формирующиеся протеолипосомы по механизму мицеллярной коалесценции [11], с последующим SPR-анализом взаимодействия с CYP3A4. Данные методы приводят к формированию протеолипосом в ходе постепенного удаления из реакционной смеси мягкого детергента и отличаются в первую очередь его стартовой концентрацией в смеси. Было показано взаимодействие CYP3A4 с протеолипосомами, полученными методом встраивания мембранного белка (CYB5A) в липосомы насыщенные детергентом. Полученные значения кинетических и равновесных параметров взаимодействия свидетельствуют о том, что зарегистрированное взаимодействие было более аффинно по сравнению с параметрами, полученными ранее для той же пары в случае, когда CYB5A был иммобилизован в планарный липидный бислой, сформированный на поверхности чипа биосенсора [9]. Факт взаимодействия между CYP3A4 и полученными методом мицеллярной коалесценции протеолипосомами, содержащими CYB5A, зафиксировать не удалось. Таким образом, было показано, что встраивание мембранного белка (CYB5A) в липосомы насыщенные детергентом является более предпочтительным методом для работы с SPR-биосенсором по сравнению с методом формирования протеолипосом мицеллярной коалесценцией. Приведённые в статье подробные протоколы анализа могут послужить основой для последующей оптимизации процесса иммобилизации цитохромов P450 на поверхности оптического чипа биосенсора. МАТЕРИАЛЫ И МЕТОДЫ Рекомбинантные белковые препараты В работе были использованы высокоочищенные (>95%, по данным электрофореза в полиакриламидном геле) препараты рекомбинантных белков: микросомальный цитохромы Р450 3A4 человека (CYP3A4) и микросомальный цитохром b5 (CYB5A) человека, полученные в результате гетерологической экспрессии в штаммах E. coli в Институте биоорганической химии Национальной академии наук Беларуси согласно методикам, описанным ранее [12, 13]. Реактивы 10х концентрат HBS-N буфера (150 мМ NaCl, 10 мМ HEPES, pH 7.4 после разведения) был получен от “Cytiva” (США). Бычий сывороточный альбумин (БСА) был получен от “AppliChem” (Германия), CHAPS (3-[ диметиламмонио]-1-пропансульфонат) и препарат общей фракции липидов сои были получены от “Merсk” (США). Остальные реактивы аналитической чистоты были получены от отечественных поставщиков. Очистка фракции фосфолипидов Фосфолипиды выделяли из общей фракции липидов сои с помощью метода осаждения холодным ацетоном, согласно ранее описанному протоколу [9]:
Приготовление препарата липосом Препарат липосом, использовавшийся в дальнейшем для приготовления протеолипосом, готовили согласно следующему протоколу: Для приготовления липосом использовали круглодонную колбу DIN EN ISO 4797 (Lenz, Германия) объёмом 10 мл. После предварительного взвешивания колбы в нее переносилм 2 мл исходного раствора фосфолипидов в хлороформе и удаляли хлороформ с помощью роторного испарителя Rotacool при комнатной температуре и скорости вращения колбы 30 об/мин. Процесс удаления хлороформа контролировали с помощью вакуумметра. Процесс останавливали в тот момент, когда прекращалось падение давления в системе. Колбу с осажденными на стенках фосфолипидами взвешивали для расчета массы полученных фосфолипидов. В колбу добавляли 3-4 стеклянных шарика и HBS-N буфер в объёме, необходимом для создания суспензии липосом в финальной концентрации 100 мг/мл, после чего фосфолипиды диспергировали путём встряхивания. Полученную суспензию подвергали воздействию ультразвука при температуре 4°C на ультразвуковом гомогенизаторе Sonoplus hd 3110 (“Bandelin”, Германия) в течении 2 мин при мощности излучателя 20% от максимальной. Далее полученные липосомы стандартизировали по размеру путём многократного пропускания через поликарбонатный фильтр с диаметром пор 100 нм с помощью устройства LipoFast-Basic («Avestin», Канада). Гомогенность распределения полученных липосом по размеру контролировали методом динамического светорассеяния с использованием анализатора Zetasizer μV («Malvern», Англия) при температуре 25°C. Для этого полученную суспензию липосом растворяли в 1000 раз в HBS-N буфере и переносили 2 мкл в измерительную кварцевую кювету zmv 1002 («Malvern»). Частота измерений составляла 333,6 тыс/с, в течение 60 с, количество повторов в рамках одного измерения - 18. Приготовление препарата протеолипосом методом встраивания в насыщенные детергентом липосомы В пробирке типа Эппендорф объёмом 500 мкл смешивали: 10 мкл CYB5A (4 мкг/мкл), 40 мкл с концентрацией фосфолипидов (100 мг/мл), 221 мкл раствора CHAPS (10 мг/мл в HBS-N буфере) и 229 мкл HBS-N буфера. Финальное содержание компонентов смеси составляло: 40 мкг CYB5A, 4 мг фосфолипидов, 2,21 мг CHAPS. При этом содержание CHAPS составляло 0,3% от массы смеси, а соотношение белок-липид было 1:100 по массе. Содержание детергента в смеси определяли, исходя из уравнения (1):
Приготовление препарата протеолипосом методом мицеллярной коалесценции В пробирке объёмом 500 мкл смешивали: 10 мкл CYB5A (4 мкг/мкл), 40 мкл фосфолипидов (100 мг/мл), 417 мкл раствора CHAPS (10 мг/мл в HBS-N буфере) и 33 мкл HBS-N буфера. Финальное содержание компонентов смеси составило: 40 мкг CYB5A, 4 мг фосфолипидов, 4,17 мг CHAPS. При этом содержание CHAPS составило 0,8% от массы смеси, а соотношение белок-липид было 1:100 по массе. Содержание детергента в смеси определяли, исходя из уравнения (2):
Поверхностный плазмонный резонанс SPR анализ был выполнен с применением оптического биосенсора Biacore 3000 («GE Healthcare», США). В работе были использованы оптические чипы типа L1 («Cytiva»). В качестве рабочего буфера был использован буфер HBS-N (“Cytiva”). Все измерения проводили при температуре 25°C. Полученные сенсограммы взаимодействий представляли собой запись сигнала биосенсора в реальном времени в резонансных единицах RU (1 RU соответствует 1 пг белка на поверхности оптического чипа). Результирующий сигнал биосенсора представлял собой разницу между рабочим (с иммобилизованными протеолипосомами, содержащими CYB5A) и контрольным (с иммобилизованными контрольными липосомами, не содержащими CYB5A) каналами биосенсора. Значения констант скорости ассоциации и диссоциации комплексов, а также Kd комплексов вычисляли с использованием программного комплекса Biacore BIAevaluation v.4.1 («GE Healthcare»). Анализ проводили циклически, цикл состоял из следующих операций:
Между циклами анализа иммобилизованные в каналах биосенсора липосомы удаляли 4-х кратной инжекцией 2 М раствора NaCl с добавлением 0,5% CHAPS (w/w) в течение 30 с при скорости потока 30 мкл/мин и однократной инжекцией 50 мМ раствора NaOH в тех же условиях, согласно ранее опубликованному протоколу [9]. РЕЗУЛЬТАТЫ Приготовление препарата протеолипосом Протеолипосомы и контрольные к ним липосомы, приготовленные методом встраивания мембранного белка в насыщенные детергентом липосомы и методом мицеллярной коалесценции, были иммобилизованы в опытный и контрольные каналы чипа. В таблице 1 приведены значения уровней иммобилизации, полученные для определения воспроизводимости иммобилизации.
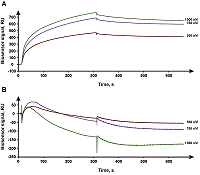
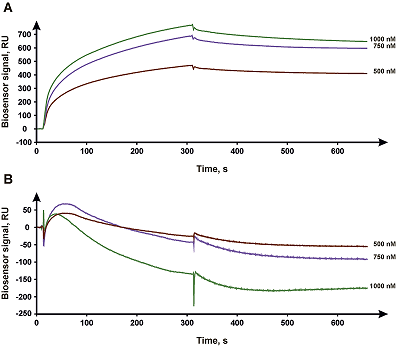
На рисунке 1 представлены полученные сенсограммы взаимодействия CYB5A в составе протеолипосом, иммобилизованных на поверхности чипа L1, с CYP3A4.
Сенсограммы были проанализированы в специализированном программном комплексе Biacore BIAevaluation v.4.1 («GE Healthcare») и обработаны по протоколу ”Kinetic Separate ka/kd”. В результате были получены значения kon (константа скорости образования комплекса), koff (константа скорости диссоциации комплекса), Kd (равновесная константа диссоциации комплекса) комплексообразования CYP3A4 с протеолипосомами, приведённые в таблице 2.
Как видно из рисунка 1, удалось зарегистрировать факт взаимодействия CYP3A4 с содержащими CYB5A протеолипосомами, полученными, методом встраивания мембранного белка в насыщенные детергентом липосомы. В то же время при использовании концентраций CYP3A4 до 1 мМ не удалось зарегистрировать факт взаимодействия CYP3A4 с содержащими CYB5A протеолипосомами, полученными методом мицеллярной коалесценции. ОБСУЖДЕНИЕ В настоящей работе приведены два метода создания протеолипосом, предназначенных для включения в состав липосом компонентов микросомальной монооксигеназной системы цитохрома P450. Полученные результаты дают возможность сопоставления двух методик изготовления протеолипосом с методикойпрямого встраивания белка в планарный липидный бислой на поверхности оптического чипа [9]. Было установлено, что уровни иммобилизации протеолипосом, полученных двумя разными методами, оказались сопоставимыми (табл. 1). Уровень иммобилизации протеолипосом, полученных методом встраивания в насыщенные детергентом липосомы, был достаточно стабилен и характеризовался параметром коэффициента вариации (CV), равным 9%. Протеолипосомы, полученные методом мицеллярной коалесценции, характеризовались менее стабильным уровнем иммобилизации (CV 22%) при одинаковых параметрах инжекции, но средний уровень иммобилизации отличался не более чем на 13%. Вероятно, это связано с тем, что процесс формирования липосом из мицелл в присутствии белка сильно зависит от условий и не гарантируется достаточной гомогенностью образцов. Липосомы прошедшие процедуру получения протеолипосом методом встраивания в насыщенные детергентом липосомы, характеризовались более выраженным разбросом значений уровня иммобилизации (CV 22%) по сравнению с липосомами, использованными в методе мицеллярной коалесценции (CV 2%). Однако, средние значения уровней иммобилизации, как и в случае протеолипосом, отличались друг от друга незначительно (разница составила 8%). Липосомы, не содержащие мембранного белка, но прошедшие все процедуры как метода встраивания в насыщенные детергентом липосомы, так и метода мицеллярной коалесценции характеризовались более высоким уровнем иммобилизации (1.6 и 1.9 раз соответственно) по сравнению с протеолипосомами. Это может быть связано с различными физико-химическими свойствами липосом, а именно с тем, что протеолипосомы, за счёт связанного с ними белка, имеют больший поверхностный заряд, чем липосомы, не содержащие в своей структуре белков. Более высокий поверхностный заряд препятствует плотному расположению протеолипосом на поверхности чипа за счёт электростатического отталкивания одноимённых зарядов. Иммобилизованные протеолипосомы содержали небольшой гемопротеин - цитохром b5 (CYB5A), играющий регуляторную функцию в микросомальных монооксигеназных системах цитохрома P450 [14]. В качестве белка-партнёра для SPR-анализа межмолекулярных взаимодействий был выбран CYP3A4, активность которого зависит от CYB5A [15]. Ранее, нами было охарактеризовано взаимодействие пары CYB5A/CYP3A4 с включением CYB5A в планарный липидный бислой на поверхности оптического чипа биосенсора [9]. Были количественно охарактеризованы константы скорости образования комплекса (kon), константы скорости диссоциации комплекса (koff) и равновесные константы диссоциации (Kd). При анализе взаимодействия CYP3A4 с иммобилизованным в протеолипосомы CYB5A было установлено, что в случае протеолипосом, полученных методом мицеллярной коалесценции, образования комплекса не наблюдается. Параметры взаимодействия CYB5A/CYP3A4 в протеолипосомах, полученных методом насыщения детергентом, говорят о более высоком сродстве комплекса CYB5A/CYP3A4, чем при иммобилизации CYB5A в планарную мембрану на поверхности оптического чипа (таблица 2). Значение Kd, полученное для пары CYB5A/CYP3A4 при иммобилизации CYB5A в протеолипосомах, приготовленных методом насыщения детергентом, была в 3 раза меньше, чем при взаимодействии CYP3A5 с CYB5A, иммобилизованным напрямую в планарную липидную мембрану на поверхности чипа. Скорость образования комплексов CYB5A/CYP3A4 была примерно в 1.6 раза больше в случае протеолипосом, изготовленных методом насыщения детергентом. Скорость диссоциации комплексов CYP3A4 с иммобилизованным в протеолипосомах CYB5A была почти в 2 раза меньше, по сравнению со взаимодействием с CYB5A, иммобилизованным в планарную мембрану. Следует отметить, что эта разница заметная, но небольшая. Поэтому можно считать метод иммобилизации в планарную липидную мембрану, описанный ранее [9], более предпочтительным за счёт его относительной простоты и меньшей трудоёмкости. Можно предположить, что более высокая аффинность при взаимодействии CYP3A4 с иммобилизованным в протеолипосомах CYB5A обусловлена более правильным позиционированием CYB5A в мембране, что достигается плавным переходом этого белка из мицеллярной фазы в липидную. При инжекции CYB5A поверх иммобилизованной липидной мембраны в отсутствии детергента правильная ориентация молекулы, по-видимому, обеспечивается не всегда; ак тому же присутствует фракция сорбированных на мембране неправильно ориентированных молекул CYB5A. Мы полагаем, что отсутствие взаимодействия CYP3A4 с CYB5A, иммобилизованном в протеолипосомы, методом мицеллярной коалесценции, можно объяснить хаотичной ориентацией мембранных белков, встраивающихся в формирующиеся протеолипосомы при их формировании в ходе данного метода [11]. Можно говорить о том, что по сравнению с методом насыщенных детергентом липосом, при создании протеолипосом методом мицеллярной коалесценции доля CYB5A на поверхности внутри липосомы, не доступная для CYP3A4, больше. Это связано с тем, что при применении метода насыщения детергентом целостность липосом не нарушается и почти все молекулы CYB5A встраиваются на наружной поверхности протеолипосомы с преимущественной ориентацией встраиваемых в липосомы молекул белка «вовне» [11]. При изготовлении протеолипосом методом мицеллярной коалесценции сборка протеолипосом носит стохастический характер и молекулы CYB5A распределяются между внутренней и внешней поверхностями липосомы равномерно, что приводит к снижению количества молекул CYB5A на внешней поверхности липосом. Считается, что в случае мицеллярной коалесценции вплоть до половины молекул встраиваемого белка могут быть ориентированы внутрь формирующихся протеолипосом [11, 16]. Так же метод мицеллярной коалесценции подразумевает использование более высоких концентраций детергентов (0,8% против 0,3%), что может влиять на белок при длительной инкубации. ЗАКЛЮЧЕНИЕ В данной работе нами на примере белковых партнёров CYP3A4 и CYB5A было проведено сравнение двух подходов создания протеолипосом, пригодных для SPR-анализа взаимодействий мембранных белков: встраивание мембранного белка в липосомы, насыщенные детергентом, и встраивание мебранного белка в формирующиеся протеолипосомы по механизму мицеллярной коалесценции. Исходя из наших наблюдений, для работы с цитохромами P450 с помощью метода SPR более приемлемым подходом оказалось встраивание белков в протеолипосомы, полученные методом встраивания в насыщенные детергентом липосомы. Однако, по сравнению с описанным нами ранее [9] методом иммобилизации мембранных белков напрямую в планарную мембрану на оптическом чипе биосенсора, создание протеолипосом с их последующей очисткой от детергента и иммобилизацией на чип биосенсора является более сложным и время-затратным методом. При этом, необходимо отметить, что изготовление протеолипосом методом мицеллярной коалесценции оказалось менее предпочтительно для работы на оптическом биосенсоре с цитохромами P450, что, по-видимому, стало следствием невозможности детерминировать ориентацию встраиваемого в протеолипосомы мембранного белка. Описанные в настоящей работе протоколы приготовления протеолипосом и SPR-анализа возможно модифицировать в зависимости от поставленных задач. Например, допустимо варьирование липидного состава мембраны при определении влияния её композиции на межмолекулярные взаимодействия. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа была выполнена в рамках гранта РФФИ №19-04-00485 «SPR анализ межмолекулярных взаимодействий с участием мембранных белков, встроенных в бислойную липидную мембрану» с использованием оборудования ЦКП «Протеом человека» при Институте биомедицинской химии (финансовая поддержка Минобрнауки в рамках соглашения №075-15-2019-1502 от 5 сентября 2019 года). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов ЛИТЕРАТУРА
|