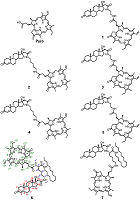
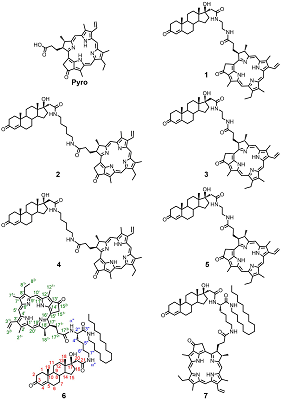
Конъюгаты пирофеофорбида а с 17-замещенными стероидными андрогенами. Синтез, молекулярное моделирование, взаимодействие с некоторыми линиями раковых клеток*
119121 Москва, ул. Погодинская, 10; *e-mail: vazolottsev@mail.ru
2Российский университет дружбы народов, 117198 Москва, ул. Миклухо-Маклая, 6
3Институт тонких химических технологий, МИРЭА – Российский технологический университет,
119454 Москва, пр. Вернадского, 86
4Российский химико-технологический университет имени Д.И. Менделеева, 125047 Москва, Миусская площадь, 9
5Институт молекулярной биологии имени В. А. Энгельгардта РАН, 119991 Москва, ул. Вавилова, 32
Ключевые слова:стероидные конъюгаты; химический синтез; тетрапиррольные макроциклы; молекулярные модели; клетки карциномы простаты; фосфолипидные мицеллы.
DOI:10.18097/BMCRM00167
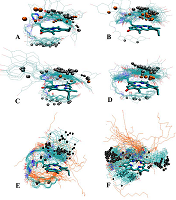
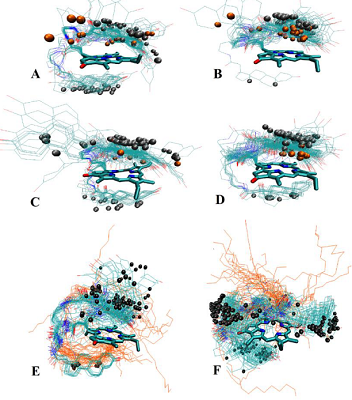
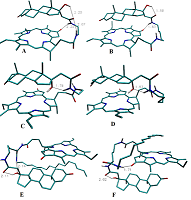
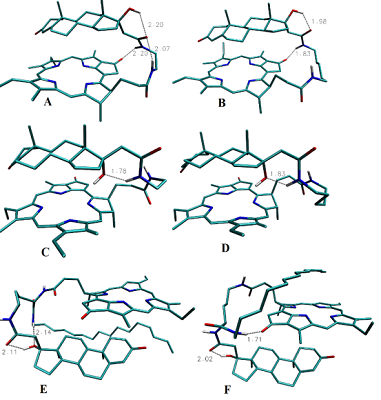
Были синтезированы пять новых бифункциональных конъюгатов пирофеофорбида а с 17-замещенными тестостероном, дигидротестостероном и эпитестостероном, различающихся длиной линкера (1 – 5), и два новых комплексных конъюгата 6 и 7 (содержащие три функциональные группы: пирофеофорбид а, 17α-замещенный тестостерон и липофильная гексадецильная цепь, связанные между собой L-лизиновым блоком). Анализом спектров 1H ЯМР и молекулярных моделей конъюгатов 1 – 7 установлено взаимное влияние стероидного и макроциклического фрагментов. Исследование взаимодействия конъюгатов 1 - 5 с культурами клеток карциномы предстательной железы показало, что их поглощение и интернализация зависят от структуры конъюгата, в частности, от стереохимической конфигурации 17-гидроксильной группы в стероидной части и длины линкера, соединяющего пирофеофорбид а со стероидным фрагментом. Конъюгаты 1 – 5 значительно снижали рост и пролиферацию клеток LNCaP и PC-3 при 96-часовой инкубации; наиболее высокой антипролиферативной активностью обладало производное эпитестостерона с коротким линкером 3. Облучение обработанных конъюгатами клеток светом (λ = 660 нм) значительно повышало цитотоксичность. Трифункциональные конъюгаты 6 и 7 легко образовывали смешанные мицеллы с фосфатидилхолином и плюроником F68; данные смешанные мицеллы эффективно интернализовались клетками гепатокарциномы человека Hep G2. Связывание конъюгатов 6 и 7 в виде смешанных мицелл с клетками Hep G2 зависело от структуры конъюгата и не зависело от способа его солюбилизации.

|
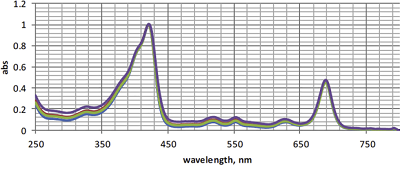
Рисунок 2.
Нормированные спектры поглощения конъюгатов 1 (оливковый); 2 (фиолетовый); 3 (синий); 4 (красный) в CHCl3.
|
|
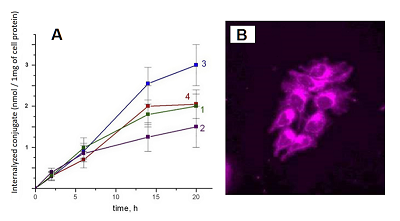
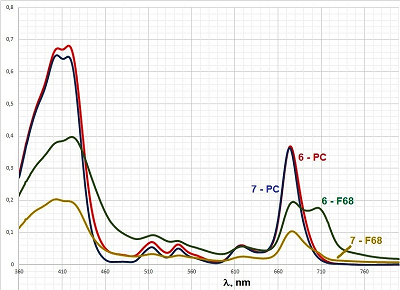
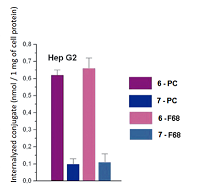
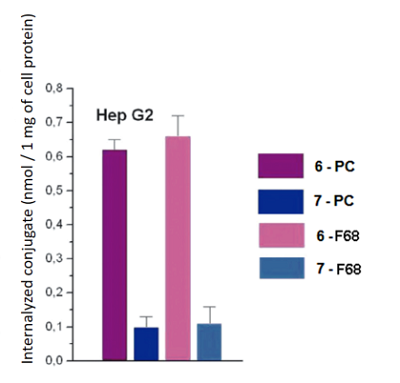
Рисунок 8.
Интернализация конъюгатов 6 и 7 в форме смешанных мицелл клетками Hep G2 (концентрация каждого конъюгата в среде 25 μM).
|
|
ЗАКРЫТЬ

|
Таблица 1.
Химические сдвиги (δ, м.д.) для избранных характеристических резонансов в спектрах 1Н-ЯМР конъюгатов 1 – 4, 6 и 7.
|
|
ЗАКРЫТЬ

|
Таблица 2.
Влияние конъюгатов 1–5 на рост и пролиферацию клеток LNCaP и PC-3 в течение 96 ч инкубации.
|
|
ЗАКРЫТЬ

|
Таблица 3.
Темновая и фотоиндуцированная токсичность конъюгатов 1 и 5 в клетках LNCaP и PC-3.
|
ФИНАНСИРОВАНИЕ
Работа выполнена в рамах Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№ 122030100170-5).
ЛИТЕРАТУРА
- Sharman W.M., van Lier J.E., Allen C.M. (2004) Targeted photodynamic therapy via receptor mediated delivery systems. Advanced Drug Delivery Reviews, 56(1), 53–76. DOI
- Giuntini F., Alonso C.M.A., Boyle R.W. (2011) Synthetic approaches for the conjugation of porphyrins and related macrocycles to peptides and proteins. Photochemical & Photobiological Sciences, 10(5), 759–791. DOI
- You H., Yoon H.-E., Yoon J.-H., Ko H., Kim Y.-C. (2011) Synthesis of pheophorbide-a conjugates with anticancer drugs as potential cancer diagnostic and therapeutic agents. Bioorganic & Medicinal Chemistry, 19(18), 5383–5391. DOI
- Abrahamse H., Hamblin M.R. (2016) New photosensitizers for photodynamic therapy. The Biochemical Journal, 473(4), 347–364. DOI
- Baskaran R., Lee J., Yang S-G. (2018) Clinical development of photodynamic agents and therapeutic applications. Biomaterials Research, 22, 25. DOI
- Tsolekile N., Nelana S., Oluwafemi O.S. (2019) Porphyrin as Diagnostic and Therapeutic Agent. Molecules, 24(14), 2669. DOI
- Pathak P., Zarandi M. A., Zhou X. , Jayawickramarajah J. (2021) Synthesis and Applications of Porphyrin-Biomacromolecule Conjugates. Frontiers in Chemistry, 9, 764137. DOI
- James D.A., Swamy N., Paz N., Hanson R.N., Ray R. (1999) Synthesis and estrogen receptor binding affinity of a porphyrin-estradiol conjugate for targeted photodynamic therapy of cancer. Bioorganic & Medicinal Chemistry Letters, 9(16), 2379–2384. DOI
- Swamy N., James D.A., Mohr S.C., Hanson R.N., Ray R. (2002) An estradiol-porphyrin conjugate selectively localizes into estrogen receptor-positive breast cancer cells. Bioorganic & Medicinal Chemistry Letters, 10(10), 3237–3243. DOI
- El-Akra N., Noirot A., Faye J.C., Souchard J.P. (2006) Synthesis of estradiol - pheophorbide conjugates: evidence of nuclear targeting, DNA damage and improved photodynamic activity in human breast cancer and vascular endothelial cells. Photochemical & Photobiological Sciences, 5(11), 996–999. DOI
- Sadler S., Persons K.S., Jones G.B., Ray R. (2011) Internalization of a C17α-alkynylestradiol-porphyrin conjugate into estrogen receptor positive MCF-7 breast cancer cells. Bioorganic & Medicinal Chemistry Letters, 21(15), 4638–4641. DOI
- Ponomarev G.V., Solovieva M.N., Dugin N.O., Zavialova M.G., Mehtiev A.R., . Misharin A.Y, Novikov R.A., Tkachev Y.V., Popenko V.I., Timofeev V.P. (2013) Lipophilic derivatives of natural chlorins: synthesis, mixed micelles with phospholipids, and uptake by cultured cells. Bioorganic & Medicinal Chemistry, 21(17), 5420–5427. DOI
- Liu A., Carlson K.E., Katzenellenbogen J.A. (1992) Synthesis of high affinity fluorine-substituted ligands for the androgen receptor. Potential agents for imaging prostatic cancer by positron emission tomography. Journal of Medicinal Chemistry, 35(11), 2113–2129. DOI
- Tojo G., Fernandez M. (2006). Oxidation of Alcohols to Aldehydes and Ketones. Springer, NY, pp. 181–200 Chapter 3.
- Oliveto E.P. (1972) In: Organic Reactions in Steroid Chemistry, Vol.II. (Fried J., Edwards J.A., Eds.), Van Nostrand Reinhold Co, 139 p.
- Bittler, D., Laurent, H., Rach, P., Topert, M. (1991) US Patent 5010071
- Zolottsev V.A., Tkachev Y.V., Latysheva A.S., Kostin V.A., Novikov R.A., Timofeev V.P., Morozevich G.E., Kuzikov A.V., Shumyantseva V.V., Misharin A.Y. (2018) Comparison of [17(20)E]-21-Norpregnene oxazolinyl and benzoxazolyl derivatives as inhibitors of CYP17A1 activity and prostate carcinoma cells growth. Steroids, 129, 24–34. DOI
- Boelrijk A.E.M., Reedijk J. (1994) Oxidation of methyl- and octyl-a-D-glucopyranoside, catalyzed by high-valent ruthenium species. Journal of Molecular Catalysis, 89(1-2), 63 –76. DOI
- Dionne P., Ngatcha B.T., Poirier D. (1997) D-ring allyl derivatives of 17β- and 17α-estradiols: chemical synthesis and 13C NMR data. Steroids, 62(10), 674–681. DOI
- Mosmann T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. Methods, 65(1-2), 55–63. DOI
- Park H., Na K. (2013) Conjugation of the photosensitizer Chlorin e6 to pluronic F127 for enhanced cellular internalization for photodynamic therapy. Biomaterials, 34(28), 6992–7000. DOI
- Tamiaki H., Michitsuji T., Shibata R. (2008) Synthesis of zinc bacteriochlorophyll-d analogues with various 17-substituents and their chlorosomal self-aggregates in non-polar organic solvents. Photochemical & Photobiological Sciences, 7, 1225–1230. DOI
- Tamiaki H., Fukai K., Shimazu H., Nishide K., Shibata Y., Itoh S., Kunieda M. (2008) Covalently linked zinc chlorophyll dimers as a model of a chlorophyllous pair in photosynthetic reaction centers. Photochemical & Photobiological Sciences, 7, 1231–1237. DOI
- Medvedeva N.V., Kisseleva A.F., Misharin A.Y. (1999) Preparation and properties of aqueous dispersions of phosphatidyl choline-cholesteryl esters or ethers. Russian Journal of Bioorganic Chemistry, 25, 147–152.
- Nikolaeva I.A., Morozova J.V., Zavialova M. G., Novikov R.A.,. Tkachev Y.V, Timofeev V.P., Misharin A.Y., Ponomarev G.V. (2010) Natural Chlorins Modified with Cholesterol Moiety. Synthesis, Characteristics, Copper Complexes, and Entrapping in Phospholipid Vesicles. Macroheterocycles, 3(2-3), 150–156. DOI
- The Open Babel Package, version 2.0.1, http://openbabel.sourceforge.net/.
- Phillips J.C., Braun R., Wang W., Gumbart J., Tajkhorshid E., Villa E., Chipot C., Skeel R.D., Kale L., Schulten K. (2005) Scalable molecular dynamics with NAMD, Journal of Computational Chemistry, 26, 1781–1802. DOI
- Zoete V., Cuendet M.A., Grosdidier A., Michielin O. (2011) SwissParam, a fast force field generation tool for small organic molecules. Journal of Computational Chemistry, 32, 2359–2368. DOI
- Humphrey W., Dalke A., Schulten K.J. (1996) VMD: visual molecular dynamics. Molecular Graphics, 14, 33–38. DOI