|
СОДЕРЖАНИЕ 1. ЭЛЕКТРОХИМ. ОПРЕДЕЛЕНИЕ ПРОДУКТОВ РЕАКЦИЙ АРОМАТИЧЕСКОГО ГИДРОКСИЛИРОВАНИЯ 2. ЭЛЕКТРОХИМ. ОПРЕДЕЛЕНИЕ ПРОДУКТОВ РЕАКЦИЙ ДЕАЛКИЛИРОВАНИЯ 3. БИЭЛЕКТРОДНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЦИТОХРОМОВ P450 СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 2Реакция метаболизма (S)-варфарина при участии CYP2C9. Рисунок 4Реакция метаболизма миансерина при участии CYP1A2 и CYP2C9. Рисунок 6Реакции метаболизма диклофенака при участии CYP2C9 и CYP3A4. Рисунок 7Реакции метаболизма пироксикама и лорноксикама при участии CYP2C9. Рисунок 8Реакция метаболизма хлорпромазина при участии CYP2D6. Рисунок 9Реакции метаболизма пропранолола при участии CYP2D6. Рисунок 10Реакция метаболизма (S)-напроксена при участии CYP1A2 и CYP2C9. Рисунок 12Реакция метаболизма фенацетина при участии CYP1A2. Рисунок 13Реакция метаболизма кодеина при участии CYP2D6. Рисунок 14Реакция метаболизма трамадола при участии CYP2D6. |
Электрохимический анализ метаболитов как метод определения активности цитохромов P450
1Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, 117997, Москва, ул. Островитянова, 1; *e-mail: v_shumyantseva@mail.ru
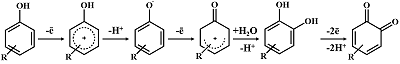
Ключевые слова: цитохромы P450; лекарственные препараты; метаболиты; электрохимия DOI: 10.18097/BMCRM00176 ВВЕДЕНИЕ Цитохромы Р450 (CYP) – суперсемейство гем-тиолатных монооксигеназ, осуществляющих метаболизм как экзогенных, так и эндогенных соединений [1]. Большое число лекарственных препаратов подвергаются метаболизму при участии цитохромов Р450. Изменение метаболизма лекарственных препаратов за счет генетических особенностей этих ферментов или возникновение межлекарственных взаимодействий при одновременном использовании нескольких препаратов может служить причиной возникновения нежелательных побочных эффектов [2]. Некоторые изоформы цитохрома Р450 катализируют ключевые стадии биосинтеза стероидных гормонов, что обуславливает их значение как молекулярных мишеней для применения лекарственных препаратов, ингибирующих их активность, например, при лечении гормон-зависимых опухолей [3]. Применение эффективных подходов к анализу активности этих ферментов является важной составляющей фармакокинетического анализа при разработке новых лекарственных препаратов и выявлении возможных межлекарственных взаимодействий. Цитохромы Р450 катализируют реакции гидроксилирования алифатических и ароматических соединений, окисления спиртов и аминов, реакции окисления гетероатомов (N, S, P и I), эпоксидирование алкенов и аренов, дегалогенирование, дезаминирование и N-, O- и S-деалкилирование [4]. При участии различных изоформ цитохрома Р450 большое число лекарственных препаратов может подвергаться реакциям ароматического гидроксилирования или O-деалкилирования, приводящим к образованию гидроксильных групп в составе ароматического кольца (табл. 1). К таким лекарственным препаратам относятся некоторые адрено- и симпатомиметики, адреноблокаторы, антиаритмические средства, антикоагулянты, гипогликемические средства, ингибиторы протонного насоса, миорелаксанты, средства для наркоза, нестероидные противовоспалительные средства, противоэпилептические препараты, снотворные, средства для лечения ВИЧ-инфекции, статины, тетрациклические антидепрессанты, эстрогены, гестагены, их гомологи и антагонисты, H1-антигистаминные средства [57]. Многие лекарственные соединения из этих фармакологических групп участвуют в межлекарственных взаимодействиях. Метаболиты цитохром Р450-зависимых реакций, например, содержащие гидроксифенильные группы, образующиеся в результате ароматического гидроксилирования, могут быть определены методами электрохимического анализа, поскольку данные соединения легко подвергаются прямому электрохимическому окислению. На рисунке 1 представлен общий механизм электрохимического окисления соединений, содержащих гидроксифенильные группы.
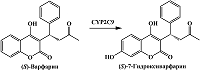
Электрохимический потенциал окисления ароматического кольца ниже, чем в случае окисления алифатических углеводородов, вследствие резонансной стабилизации ароматических катион-радикалов [59]. Гидроксильная группа в составе бензольного кольца облегчает процесс электрохимического окисления продуктов ферментативных реакций, поскольку электронодонорные группы, такие как гидроксильные и аминогруппы, активируют ароматическое кольцо, и электрохимический потенциал окисления таких соединений имеет меньшие значения. Гидроксилирование ароматических гетероциклов в составе лекарственных препаратов также может влиять на электрохимические свойства таких соединений. Различия в электрохимических свойствах субстратов цитохрома Р450 и продуктов их биотрансформации могут использоваться для идентификации и количественного определения этих соединений, при этом в идеале не требуются дополнительные стадии их разделения при условии неперекрывающихся потенциалов электроокисления. 1. ЭЛЕКТРОХИМИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПРОДУКТОВ РЕАКЦИЙ АРОМАТИЧЕСКОГО ГИДРОКСИЛИРОВАНИЯ Как было сказано выше, метаболиты цитохром Р450-зависимых реакций, образующиеся в результате ароматического гидроксилирования, подвергаются прямому электрохимическому окислению при меньших значениях потенциалов, чем в случае окисления соответствующих субстратов. Цитохром Р450 2С9 (CYP2C9) осуществляет реакцию ароматического гидроксилирования S-энантиомера антикоагулянтного препарата варфарина до соответствующего метаболита (S)-7-гидроксиварфарина (рис. 2) [60].
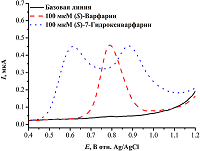
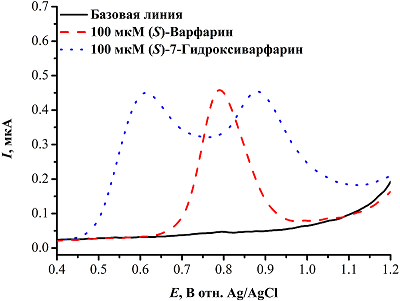
Пик электрохимического окисления (S)-варфарина на графитовых электродах, регистрируемый методом квадратно-волновой вольтамперометрии, находится около 0.8 В, а (S)-7-гидроксиварфарин имеет соответствующий окислению гидроксифенильной группы пик около 0.6 В и пик около 0.9 В, отражающий дальнейший процесс окисления метаболита (рис. 3).
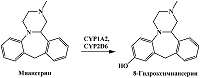
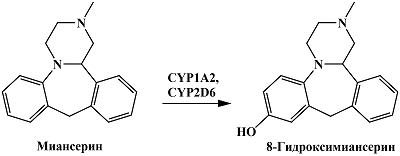
Одним из путей метаболизма тетрациклического антидепрессанта миансерина является реакция ароматического гидроксилирования с образованием 8-гидроксимиансерина, осуществляемая при участии цитохрома Р450 2D6 (CYP2D6), а также при участии цитохрома Р450 1А2 (CYP1A2) цитохрома Р450 2B6 (CYP2B6), цитохрома Р450 3A4 (CYP3A4) [6, 27] (рис. 4). Миансерин способен подвергаться электрохимическому окислению при потенциале около 1.05 В (отн. Ag/AgCl), при этом показано, что 8-гидроксимиансерин подвергается электрохимическому окислению при менее положительных потенциалах, по сравнению с миансерином [61]. Несмотря на то, что авторы используют электрохимические свойства аналитов для их детекции в плазме крови после хроматографического разделения, различия в электрохимических свойствах может быть также использовано для совместного определения миансерина и 8-гидроксимиансерина in vitro без дополнительных стадий разделения.
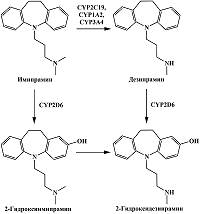
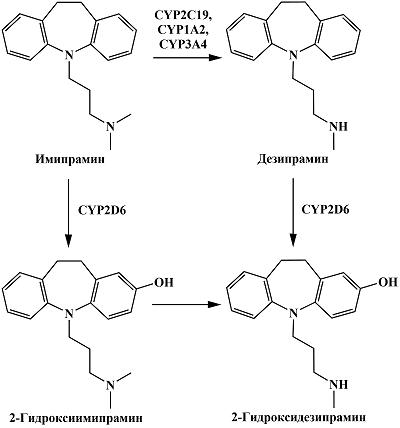
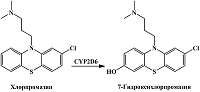
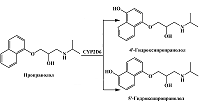
Трициклический антидепрессант имипрамин при участии CYP2D6 подвергается ароматическому гидроксилированию с образованием 2-гидроксиимипрамина [23] (рис. 5). Кроме того, N-деметилирование имипрамина при участии CYP1A2, CYP2C19 и CYP3A4 приводит к образованию дезипрамина, который подвергается ароматическому гидроксилированию при участии CYP2D6 до соответствующего 2-гидрокси производного [23]. При изучении вольтамперных кривых имипрамина, дезипрамина и их соответствующих 2-гидроксиметаболитов с помощью стекло-углеродного электрода Koyama и соавт. отметили, что 2-гидрокси производные имеют меньшие потенциалы окисления, по сравнению с имипрамином и дезипрамином [62]. Как и в случае с миансерином, авторы предлагают для анализа имипрамина, дезипрамина и их соответствующих 2-гидроксиметаболитов в плазме крови и моче хроматографическое разделение, однако различия в электрохимических свойствах этих лекарственных препаратов и их метаболитов могут быть использованы для совместного количественного определения. Поскольку имипрамин и дезипрамин могут быть использованы в качестве маркерных субстратов CYP2D6 при проведении ингибиторного анализа [63, 64], представляет интерес определение их 2-гидроксиметаболитов электрохимическими методами, основанными на различии продуктов и субстратов реакции.
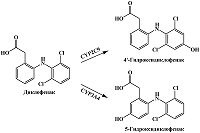
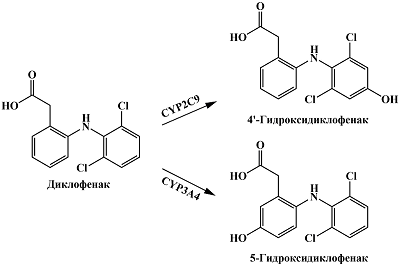
Нестероидный противовоспалительный препарат диклофенак подвергается преимущественно реакциям 4'-гидроксилирования при участии цитохрома Р450 2С9 (CYP2C9) и 5-гидроксилирования при участии CYP3A4 [65] (рис. 6). Диклофенак имеет пик электрохимического окисления в области 0.5-0.7 В (отн. Ag/AgCl) [66-68]. Для 4'-гидроксидиклофенака методом циклической вольтамперометрии авторы регистрировали пик окисления при 0.236 В (отн. Ag/AgCl) и пик восстановления при -0.131 В (отн. Ag/AgCl) в 0.1 М фосфатном буфере (pH 7.4), при аналогичных условиях пики для 5-гидроксидиклофенака были зарегистрированы при 0.167 В (отн. Ag/AgCl) и -0.439 В (отн. Ag/AgCl) соответственно [69]. Поскольку диклофенак является маркерным субстратом CYP2C9, он наиболее часто используется для определения активности CYP2C9 [70], электрохимические системы определения метаболитов диклофенака и его метаболитов могут использоваться в фармакологических исследованиях при скрининге ингибирующей активности лекарственных препаратов по отношению к CYP2C9.
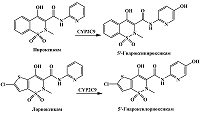
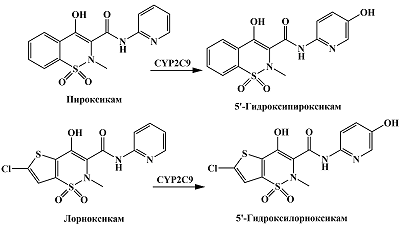
Нестероидные противовоспалительные средства, принадлежащие к группе оксикамов, такие как лорноксикам, пироксикам, подвергаются ароматическому гидроксилированию по пиридиновому радикалу под действием CYP2C9 с образованием соответствующих 5'-гидрокси производных [13, 14] (рис. 7). Suwa и соавт., исследуя электрохимические свойства лорноксикама и его 5'-гидроксиметаболита методом гидродинамической вольтамперометрии, показали отличие в электрохимических свойствах этих соединений, обусловленное наличием гидроксильной группы у 5'-гидроксилорноксикама [71]. Различия в электрохимических свойствах оксикамов и их 5'-гидроксилированных производных, образующихся при участии CYP2C9, позволяют сделать предположение, что активность данного фермента может быть исследована путем количественного электрохимического определения 5'-гидроксиметаболитов оксикамов. Однако стоит отметить, что пироксикам проявляет свойства субстратного ингибирования [14], что стоит учитывать при выборе данного субстрата для оценки активности CYP2C9.
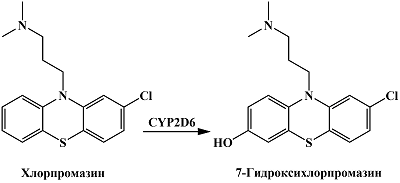
Нейролептик хлорпромазин подвергается ароматическому гидроксилированию при участии CYP2D6 по 7 положению фенотиазинового фрагмента молекулы [33] (рис. 8). Электрохимические свойства хлорпромазина, 7-гидроксихлорпромазина, а также 7,8-дигидроксихлорпромазина были исследованы в работе McCreery с помощью угольно-пастового электрода в цитрат-фосфатном буфере [72]. Автор показал различия в электрохимическом окислении хлорпромазина и его производных и предположил вероятные механизмы электрохимического окисления 7-гидроксихлорпромазина и 7,8-дигидроксихлорпромазина. В последующих исследованиях механизма электрохимического окисления 7-гидроксихлорпромазина Neptune и McCreery выявили образование различных интермедиатов, свидетельствующих о протекании реакции через формирование имина, который может подвергаться как гидролизу, так и гидроксилированию [73]. Можно предположить, что количественное определение 7-гидроксихлорпромазина, основанное на отличии его электрохимических свойств от хлорпромазина, обусловленного наличием гидроксильной группы в 7 положении, может быть использовано для оценки влияния других лекарственных препаратов на активность CYP2D6.
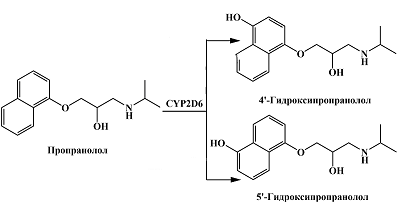
Препарат пропранолол, принадлежащий к группе β-блокаторов, метаболизируется под действием CYP2D6 до 4'- или 5'-гидроксипропранолола [31] (рис. 9). Электрохимические свойства пропранолола и 4'-гидроксипропранолола были исследованы с помощью стеклоуглеродного электрода в работе Baranowska и Koper [74]. В буфере Бриттона-Робинсона при pH 3 авторы зарегистрировали на циклической вольтамперограмме окислительный пик пропранолола в области 1.1-1.4 В (отн. Ag/AgCl), предполагая, что электрохимический процесс связан с окислением вторичной спиртовой группы, сопряженным с отщеплением двух электронов и двух протонов. Однако в других работах также предполагается, что электрохимический процесс для пропранолола может быть связан и с окислением вторичной аминогруппы [75-77]. Для 4'-гидроксипропранолола первый пик окисления находился при 0.114 В, а на катодной ветви наблюдался восстановительный пик при 0.048 В. Это указывает на обратимость электрохимического процесса для этого метаболита пропранолола. При этом, в электрохимическом процессе для 4'-гидроксипропранолола участвует гидроксифенильная группа, обратимо окисляющаяся до хинонового производного. Второй пик окисления для 4'-гидроксипропранолола при данных условиях был зарегистрирован при 0.4 В. Основываясь на различиях в электрохимических свойствах, авторы также продемонстрировали возможность одновременного электрохимического определения пропранолола, 4'-гидроксипропранолола и образующегося в организме в результате II фазы метаболизма 4'-гидроксипропранолола сульфата. Одновременное определение пропранолола и его 4'-гидроксиметаболита может быть использовано при оценке активности CYP2D6 в модельных системах.
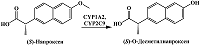
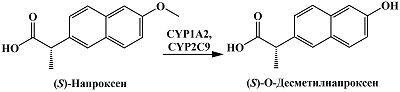
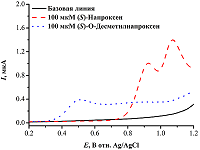
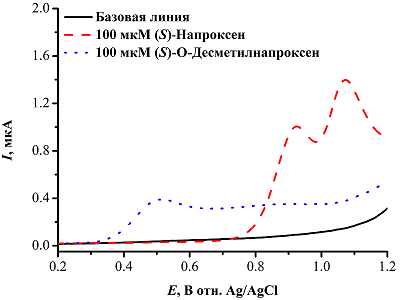
2. ЭЛЕКТРОХИМИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ПРОДУКТОВ РЕАКЦИЙ ДЕАЛКИЛИРОВАНИЯ Реакции O-деалкилирования ароматических субстратов, катализируемые цитохромами Р450, приводят к образованию соответствующих гидроксифенильных производных и альдегидов. Так, при участии CYP1A2 и CYP2C9 нестероидное противовоспалительное средство напроксен подвергается реакции O-деметилирования с образованием O-десметилнапроксена [41] (рис. 10). Пики электрохимического окисления (S)-O-десметилнапроксена, образующегося в результате O-деметилирования (S)-напроксена, находятся в области около 0.5 В (отн. Ag/AgCl), что соответствует окислению гидроксифенильной группы, и 0.8 В, что соответствует дальнейшему окислению метаболита; при этом пики окисления (S)-напроксена, соответствующие формированию катион-радикала и его дальнейшему окислению, расположены в области 0.9 и 1.1 В (рис. 11). Таким образом, концентрация O-десметилнапроксена может оцениваться по характеристическому пику окисления в области 0.5 В при исследовании O-деметилазной активности CYP2C9.
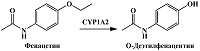
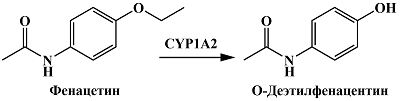
Анальгетик и антипиретик фенацетин подвергается реакции O-деалкилирования при участии CYP1A2 с образованием O-деэтилфенацентина (ацетаминофена или парацетамола) [42] (рис. 12). По данным Yin и соавт., O-деэтилфенацентин окисляется при меньших потенциалах (пик окисления 0.42 В отн. насыщенного каломельного электрода) по сравнению с фенацетином (пик окисления 0.848 В), а также возможность совместного определения этих соединений благодаря различиям в их электрохимических свойствах [78]. Это дает возможность предположить, что оценка активности CYP1A2 может проводиться электрохимическими методами по характеристическому пику окисления образующегося продукта O-деалкилирования фенацетина.
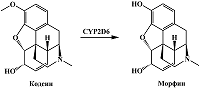
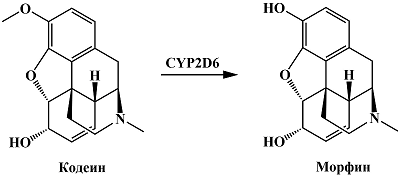
CYP2D6 принадлежит важная роль в метаболизме опиоидов [79]. Опиодный наркотический анальгетик кодеин подвергается реакции O-деметилирования с образованием морфина, содержащего гидроксифенильную группу в 3 положении [51] (рис. 13). В работе Wester и соавт. показано, что в отличие от кодеина, морфин имеет четкий пик окисления в области 0.4 В (отн. Ag/AgCl), обусловленный наличием гидроксильной группы в 3 положении [80].
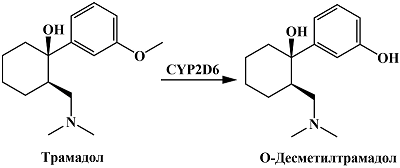
Трамадол подвергается CYP2D6-зависимому O-деметилированию с образованием O-десметилтрамадола [53] (рис. 14). Возможность одновременного электрохимического определения трамадола и O-десметилтрамадола была показана в работе Mynttinen и соавт. [81]. Используя покрытые нафионом электроды из тетраэдрического аморфного углерода, авторы показали, что трамадол и O-десметилтрамадол подвергаются электрохимическому окислению при различных потенциалах – 1.5 В и 0.95 В (отн. Ag/AgCl) соответственно. Различия в потенциалах окисления могут быть объяснены наличием гидроксильной группы у O-десметилтрамадола. Таким образом, O-деметилазная активность CYP2D6 может оцениваться путем электрохимического определения морфина, в случае использования в качестве субстрата кодеина, или O-десметилтрамадола при использовании в качестве субстрата трамадола.
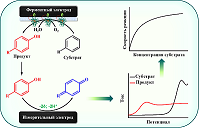
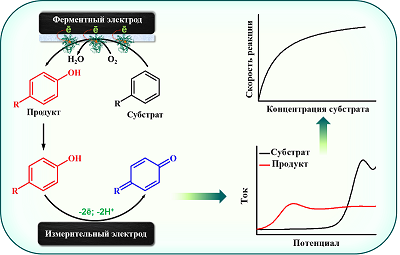
Таким образом, электрохимические свойства ряда лекарственных соединений и их метаболитов существенно различаются, что может быть использовано для количественного определения последних как в биологических образцах (кровь или моча), так и в цитохром P450-содержащих системах с целью оценки фармакокинетики лекарственных препаратов и прогноза межлекарственных взаимодействий. При этом, в случае использования систем, в которых цитохром P450 находится в иммобилизованном состоянии, не требуются дополнительные стадии очистки инкубационной смеси от белковых компонентов. Таким условиям удовлетворяют электрохимические системы для определения активности цитохрома P450, в которых фермент находится в иммобилизованном на электроде состоянии. 3. БИЭЛЕКТРОДНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЦИТОХРОМОВ P450 Использование электрохимических систем с иммобилизованным на электроде ферментом является современным подходом для определения активности цитохромов Р450. При этом электрод служит источником электронов для восстановления иона железа гема и инициирования каталитической реакции; отсутствует необходимость использования коферментов-доноров электронов и белков электрон-транспортной цепи [82-84]. Регистрация каталитической активности в таких системах может осуществляться по изменению электрохимических параметров иммобилизованного фермента в присутствии субстрата. Однако вследствие неполного сопряжения каталитического цикла цитохрома Р450 и образования активных форм кислорода для точного определения кинетических параметров требуется количественное определение продуктов реакций. В большинстве случаев для анализа продуктов цитохром Р450-зависимых реакций с помощью классических методов энзимологии требуется их выделение, что ограничивает возможность высокопроизводительного анализа для решения задач фармакокинетики и фармакодинамики. В связи с этим перспективным с точки зрения удобства практического использования является совмещение электрохимических систем на основе ферментных электродов с электрохимическим количественным определением образующихся цитохром Р450-зависимых реакций с помощью измерительных электродов. Принцип функционирования таких биэлектродных систем проиллюстрирован на рисунке 15.
Такие электрохимические системы могут быть сконструированы на основе электродов, полученных методом трафаретной печати, что обеспечивает взаимозаменяемость электродов при проведении электрохимического анализа, миниатюризацию аналитического процесса (объем пробы, используемой для анализа образующихся метаболитов с помощью измерительных электродов 50-100 мкл). Различия в электрохимических свойствах (S)-варфарина и его метаболита (S)-7-гидроксиварфарина, обусловленные наличием гидроксифенильной группы у последнего, позволили нам разработать биэлектродную систему для определения активности CYP2C9 на основе электродов, полученных методом трафаретной печати [85]. Один из электродов этой системы являлся модифицированным дидодецилдиметиламмония бромидом с иммобилизованным CYP2C9 (ферментный электрод). Электрохимическое восстановление иона железа гема этого фермента инициировало каталитическую реакцию по отношению к (S)-варфарину. Второй (немодифицированный) электрод выступал в роли измерительного для количественного определения образующегося продукта ферментативной реакции (S)-7-гидроксиварфарина по пику его электрохимического окисления методом квадратно-волновой вольтамперометрии. С помощью разработанной системы были определены параметры стационарной кинетики CYP2C9 по отношению к (S)-варфарину: максимальная скорость реакции (Vmax) и константа Михаэлиса (KM) – 0.1 ± 0.002 мин-1 и 3.03 ± 0.38 мкМ соответственно. Полученные параметры согласуются с аналогичными параметрами, полученными с помощью реконструированной ферментной системы [86]. Разработанный подход перспективен для оценки межлекарственных взаимодействий с участием CYP2C9, которые могут возникать при назначении варфарина с другими лекарственными препаратами. Одним из эффективных способов увеличения аналитической чувствительности электрохимического определения различных соединений и снижения предела определяемых концентраций является использование различных химических модификаторов измерительных электродов на основе углеродных наноматериалов [87]. Мы показали, что использование модифицированных углеродными нанотрубками электродов, служащих для определения 4'-гидроксидиклофенака, образующегося в процессе CYP2C9-зависимого электрокаталитического гидроксилирования нестероидного противовоспалительного препарата диклофенака, позволяет увеличить аналитическую чувствительность примерно в 37 раз и уменьшить предел определяемых концентраций примерно в 1.4 раза, по сравнению с немодифицированными электродами [88]. С помощью разработанной биэлектродной системы на основе иммобилизованного на электроде CYP2C9 и количественного электрохимического определения 4'-гидроксидиклофенака с помощью модифицированных углеродными нанотрубками электродов были определены кинетические параметры этого фермента: Vmax 5.35 ± 0.13 мин-1, KM 11.66 ± 0.92 мкМ. При этом активность CYP2C9 в электрохимической системе по отношению к 100 мкМ диклофенаку была определена как 4.74 ± 0.42 мин-1, что сопоставимо с полученной ранее активностью фермента в реконструированной системе по отношению к диклофенаку той же концентрации (4.25 ± 1.66 мин-1) [89]. На примере ингибитора CYP2C9 сульфафеназола была показана возможность использования разработанной биэлектродной системы в фармакокинетических исследованиях при проведении ингибиторного анализа. Эстрон и β-эстрадиол, содержащие гидроксифенильные группы, образуются в результате реакций ароматизации андрогенов андростендиона и тестостерона, катализируемых цитохромом Р450 19А1 (CYP19A1) [90]. При значениях рН, близких к нейтральным, эстрогены (в отличие от андрогенов) способны подвергаться прямому электрохимическому окислению за счет наличия у них гидроксифенильной группы [91-95]. Для оценки активности CYP19A1 по отношению к андрогенам была разработана биэлектродная система, в которой немодифицированные электроды использовались для количественного определения эстрогенов по пику их электрохимического окисления [96]. С помощью разработанной системы были определены значения Vmax ароматизации андростендиона и тестостерона под действием CYP19A1 в электрохимической системе, которые составили 0.86 ± 0.12 с-1 и 0.17 ± 0.02 с-1 соответственно, тогда как значения KM составили 4.2 ± 1.5 мкМ и 3.8 ± 1.3 мкМ соответственно. Кроме того, показана применимость системы для проведения ингибиторного анализа на примере экземестана, применяющегося в клинической практике для лечения рака молочной железы, основным действием которого является механизм-активируемое ингибирование CYP19A1. ЗАКЛЮЧЕНИЕ Электроаналитические методы высокочувствительны и удобны для использования в биохимическом анализе. Метаболиты с гидроксильными группами в ароматическом кольце, образующиеся в результате цитохром Р450-зависимых реакций ароматического гидроксилирования, деалкилирования ароматических соединений, ароматизации стероидов, могут подвергаться прямому электрохимическому окислению, что может быть использовано для их количественного определения. При этом при условии неперекрывающихся потенциалов электроокисления не требуются дополнительные стадии разделения субстратов, продуктов и ингибиторов в случае проведения ингибиторного анализа. Совмещение электрохимических систем на основе иммобилизованных на электроде клинически значимых цитохромов P450 с электрохимическим количественным определением образующихся метаболитов лекарственных препаратов с помощью измерительных электродов является весьма перспективным для практического использования при решении задач фармакокинетики, таких как ингибиторный анализ с целью выявления возможных межлекарственных взаимодействий. Повышение чувствительности электрохимического определения метаболитов с помощью современных материалов для модификации электродов, в том числе на основе углерода, а также создание устройств, позволяющих в автоматическом режиме проводить регистрацию образующихся продуктов, является перспективой дальнейшего развития электрохимических методов анализа активности цитохромов P450. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. ФИНАНСИРОВАНИЕ Исследование выполнено за счет гранта Российского научного фонда №21-75-00048, https://rscf.ru/project/21-75-00048/. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|