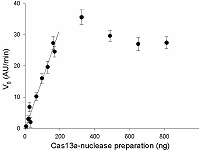
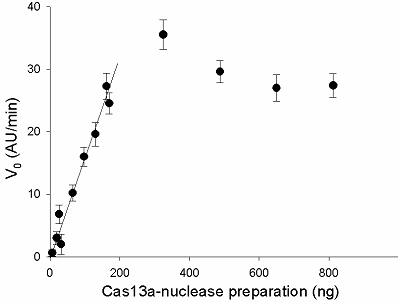
Стандартизация препаратов рекомбинантной CRISPR/Cas13a-нуклеазы с использованием РНКазы А с известной активностью
Научно-исследовательский институт биомедицинской химии имени В. Н. Ореховича, 119121, Москва, ул. Погодинская, 10; e-mail: radkos@yandex.ru
Ключевые слова: Cas13a-нуклеаза; удельная активность; стандартизация; РНКаза А
DOI:10.18097/BMCRM00177
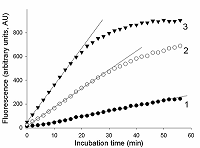
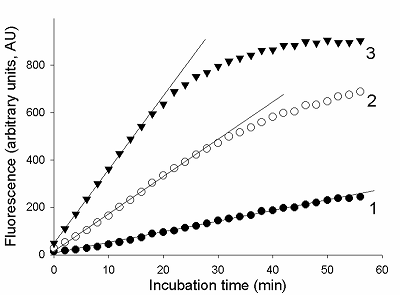
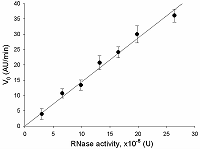
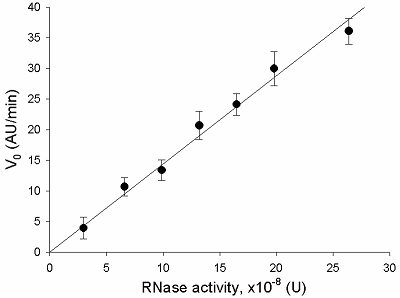
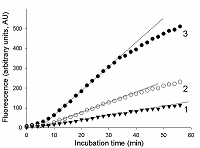
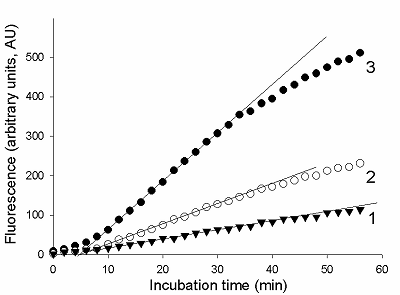
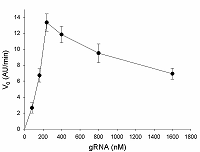
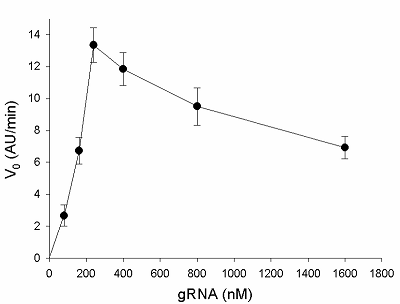
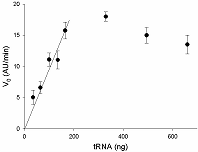
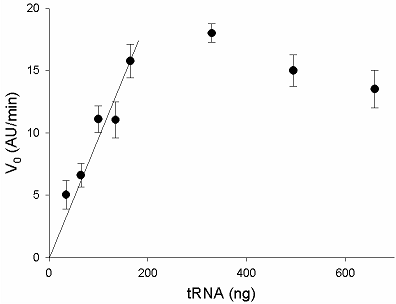
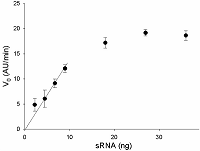
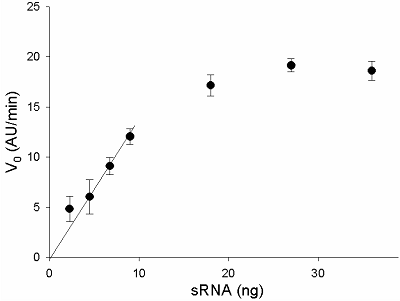
Предложен подход к характеризации препаратов рекомбинантной Cas13a-нуклеазы в терминах удельной коллатеральной активности для их стандартизации. Стандартизация препаратов Cas13a-нуклеазы по удельной активности будет полезна как при разработке тестов, использующих коллатеральную рибонуклеазную активность Cas13a, так и для оптимизации процедур экспрессии, очистки и хранения рибонуклеазы. Подход основан на измерении начальной скорости расщепления специально созданных и коммерчески доступных образцов молекул РНК (FQ-репортеров, меченных флуорофором и химическим соединением – гасителем флуоресценции) препаратом рекомбинантной Cas13a-нуклеазы и коммерческой РНКазой А с известной активностью. В качестве предварительного условия необходимо найти оптимальное молярное соотношение для образования комплексов Cas13a с направляющей РНК (нРНК), а также оптимальное количество РНК-мишени. Использование синтетической РНК-мишени (сРНК) представляется предпочтительным по сравнению с препаратами суммарной РНК (тРНК).
|
ЗАКРЫТЬ

|
Таблица 1.
ДНК-олигонуклеотиды, использованные как матрицы для синтеза нРНК и сРНК. Последовательность, комплементарная последовательности Т7-промотора, показана курсивом. Самокомплементарные последовательности ДНК-олигонуклеотидов выделены жирным шрифтом.
|
ФИНАНСИРОВАНИЕ
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской федерации в рамках Федеральной научно-технической программы развития генетических технологий на 2019-2027 годы (соглашение №075-15-2021-1345, уникальный идентификатор проекта RF----193021X0012).
К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00177) на сайте журнала.
ЛИТЕРАТУРА
- Zamani, M., Furst, A.L., Klapperich,C.M. (2021) Strategies for engineering affordable technologies for point-of-care diagnostics of infectious diseases. Accounts of Chemical Research, 54(20), 3772-3779. DOI
- Ivanov, A.V., Safenkova, I.V., Zherdev, A.V., Dzantiev, B.B. (2021) The potential use of isothermal amplification assays for in-field diagnostics of plant pathogens. Plants (Basel), 10(11), 2424. DOI
- Zhao, Y., Chen, F., Li Q., Wang, L., Fan, C. (2015) Isothermal Amplification of Nucleic Acids. Chemical Reviews, 115(22), 12491-12545. DOI
- van Dongen, J.E., Berendsen, J.T.W., Steenbergen, R.D.M., Wolthuis, R.M.F., Eijkel, J.C.T., Segerink, L.I. (2020) Point-of-care CRISPR/Cas nucleic acid detection: Recent advances, challenges and opportunities. Biosensors and Bioelectronics, 166, 112445. DOI
- Kaminski, M.M., Abudayyeh, O.O., Gootenberg, J.S., Zhang, F., Collins, J.J. (2021) CRISPR-based diagnostics. Nature Biomedical Engineering, 5(7), 643–656. DOI
- Ozay, B., McCalla, S.E. (2021) A review of reaction enhancement strategies for isothermal nucleic acid amplification reactions. Sensors and Actuators Reports, 3, 100033. DOI
- Wu, W.Y., Lebbink, J.H.G., Kanaar, R., Geijsen, N., van der Oost, J. (2018) Genome editing by natural and engineered CRISPR-associated nucleases. Nature Chemical Biology, 14(7), 642-651. DOI
- Kim, S., Ji, S., Koh, H.R. (2021) CRISPR as a Diagnostic Tool. Biomolecules, 11(8), 1162. DOI
- Abudayyeh, O.O., Gootenberg, J.S., Konermann, S., Joung, J., Slaymaker, I.M., Cox, D.B., Shmakov, S., Makarova, K.S., Semenova, E., Minakhin, L., Severinov, K., Regev, A., Lander, E.S., Koonin, E.V., Zhang, F. (2016) C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science, 353(6299), aaf5573. DOI
- Gootenberg, J.S., Abudayyeh, O.O., Lee, J.W., Essletzbichler, P., Dy, A.J., Joung, J., Verdine, V., Donghia, N., Daringer, N.M., Freije, C.A., Myhrvold, C., Bhattacharyya, R.P., Livny, J., Regev, A., Koonin, E.V., Hung, D.T., Sabeti, P.C., Collins, J.J., Zhang, F. (2017) Nucleic acid detection with CRISPR-Cas13a/C2c2. Science, 356(6336), 438-442. DOI
- Kurbatov, L.K., Radko, S.P., Kravchenko, S.V., Kiseleva, O.I., Durmanov, N.D., Lisitsa, A.V. (2020) Single stage purification of CRISPR/cas13a nuclease via metal-chelating chromatography following heterologous expression with the preservation of collateral ribonuclease activity. Applied Biochemistry and Microbiology, 56(6), 671–677. DOI
- Zhu, H., Richmond, E., Liang, C. (2018) CRISPR-RT: A web application for designing CRISPR-C2c2 crRNA with improved target specificity. Bioinformatics, 34(1), 117-119. DOI
- Bisswanger, H. (2013) Practical Enzymology. Wiley-Blackwell, 376 p.
- Polygina, G.V., Cherednichenko, V.S., Rimareva, L.V. (2003) Opredelenie aktivnosti fermentov. DeLi print, Moscow, 376 p.