|
СОДЕРЖАНИЕ 1. ЭЛЕКТРОХИМИЧЕСКИЕ ИЗМЕРЕНИЯ: МАТЕРИАЛЫ И МЕТОДЫ 2. ПОСТРОЕНИЕ РАСПРЕДЕЛИТЕЛЬНЫХ ДИАГРАММ 3. ПРОТОКОЛ РАСЧЁТА ЭЛЕКТРОАКТИВНОЙ ПОВЕРХНОСТИ МОДИФИЦИРОВАННЫХ ЭЛЕКТРОДОВ 4. ПОСТРОЕНИЕ КОНЦЕНТРАЦИОННЫХ ЗАВИСИМОСТЕЙ БИООБЪЕКТОВ 5. ИССЛЕДОВАНИЕ МЕХАНИЗМА ВЗАИМОДЕЙСТВИЯ ДНК И ЛЕКАРСТВА 6. РАСЧЁТ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ 7. ЭЛЕКТРОХИМИЧЕСКАЯ РЕГЕНЕРАЦИЯ ПОВЕРХНОСТИ ЭЛЕКТРОДА СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Таблица 2Значения электроактивных площадей ПГЭ, модифицированных различными дисперсиями. Таблица 3Расчёт метрологических и электрохимических параметров электродов. |
Алгоритмы расчёта параметров электрохимического биосенсора 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121 Москва, ул. Погодинская, 10; *e-mail: viktoria.shumyantseva@ibmc.msk.ru 2Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, Москва Ключевые слова: электрохимический биосенсор; электроактивная поверхность электрода; константа связывания; анализ ДНК; фармакогеномика DOI: 10.18097/BMCRM00178 ВВЕДЕНИЕ
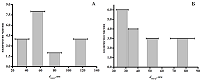
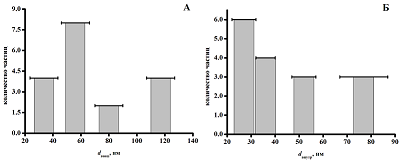
Электрохимический биосенсор является перспективным устройством для количественного анализа биологических объектов, которые оказывают решающее значение для диагностики, лечения и понимания этиологии различных заболеваний. Знания о механизме действия лекарства на биологический объект (ферменты, белки, нуклеиновые кислоты) или лиганд-рецепторных взаимодействий открывают широкие перспективы для понимания природы многих типов заболеваний, механизма действия лекарств на организм и разработки новых фармацевтических препаратов [1-3]. Анализ разработанных электрохимических биосенсоров начинается с исследования электрохимической эффективности применяемого модификатора, затем проводится анализ концентрационных зависимостей биологических объектов путём расчёта метрологических и электрохимических параметров электродов. Наноструктурирование поверхности рабочего электрода позволяет проводить селективный анализ, повысить чувствительность и снизить предел определяемых концентраций. Миниатюризация системы, проведение прямого анализа с отсутствием дополнительных реактивов, минимальный расход реактивов и применение портативных приборов расширяют возможности использования электрохимического биосенсора в клинических лабораториях [4]. В настоящей работе на примере молекулы ДНК и лекарственного препарата ацетата абиратерона представлены эксперименты для определения метрологических и электрохимических характеристик модифицированного наноматериалами электрохимического биосенсора и разработан алгоритм описания механизмов взаимодействия биологический объект (ДНК)-лекарство или лиганд-рецептор. 1. ЭЛЕКТРОХИМИЧЕСКИЕ ИЗМЕРЕНИЯ: МАТЕРИАЛЫ И МЕТОДЫ Электрохимические измерения проводили на приборе потенциостат/гальваностат Autolab 302N (Metrohm Autolab BV, Нидерланды) с программным обеспечением Nova (версия 2.0). Были использованы трехконтактные печатные графитовые электроды (ПГЭ) фирмы ColorElectronics (Россия) с графитовым печатным и вспомогательным электродами и хлоридсеребряным электродом сравнения. Все электрохимические измерения проводили в 0.1 М калий-фосфатном буфере (рН 7.4) содержащем 0.05 М NaCl. Для модифицирования рабочего электрода на его поверхность наносили 2 мкл дисперсии 1 мг/мл функционализированных углеродных нанотрубок (фУНТ) в этаноле, затем электроды инкубировали 15 мин при температуре 37°С до полного высыхания жидкости. Для последующего модифицирования на модифицированную поверхность электрода фУНТ дополнительно наносили 2 мкл дисперсии 1 мг/мл TiO2 в этаноле и инкубировали 15 мин при температуре 37°С до полного высыхания жидкости. Для модифицирования электродов коммерческой дисперсией Tuball Batt (УНТ в карбоксиметилцеллюлозе), дисперсию сначала разбавляли водой в соотношении 1:5, затем наносили 2 мкл на поверхность рабочего электрода и инкубировали 15 мин при температуре 37°С до полного высыхания жидкости. Электроактивную поверхность электродов оценивали по поведению внешнего электролита 5 мМ феррицианида калия методом циклической вольтамперометрии в вертикальном режиме измерений. Модифицированный электрод погружали в кювету, содержащую 1 мл раствора. Измерения проводили при различных скоростях развертки потенциалов 10÷100 мВ/с с интервалом 10 мВ/с при комнатной температуре в аэробных условиях. Электроанализ биообъектов проводили в горизонтальном режиме измерений, при нанесении 60 мкл анализируемой пробы в 0.1 М калий-фосфатном буфере, pH 7.4 на поверхность рабочего электрода. При нанесении 2 мкл раствора с последующей инкубацией 15 мин при температуре 37°С биологический объект может быть иммобилизован на поверхности модифицированного электрода. Дальнейший электрохимический анализ проводится в капле 60 мкл калий-фосфатного буфера, pH 7.4. Электроанализ комплексов ДНК-лекарство проводили в горизонтальном режиме измерений при нанесении 60 мкл анализируемой пробы в калий-фосфатном буфере, pH 7.4. В вертикальном режиме электроанализ проводили с иммобилизованным биологическим материалом или лигандом в 1 мл раствора лекарства. Электрохимическую регенерация поверхности электрода проводили в капле 60 мкл калий-фосфатного буфера в горизонтальном режиме измерений. 2. ПОСТРОЕНИЕ РАСПРЕДЕЛИТЕЛЬНЫХ ДИАГРАММ ПО СРЕДНЕМУ РАЗМЕРУ ЧАСТИЦ МОДИФИКАЦИЙ Анализ изображений, полученных методом сканирующей электронной микроскопии, позволяет определить положение отдельных наночастиц модификации ПГЭ, а также оценить их средний размер и форму. Исходя из параметра формы (диаметр, длина) строили распределительную диаграмму частиц по размеру. На рисунке 1 представлены диаграммы электродов, модифицированных фУНТ в хлороформе [5].
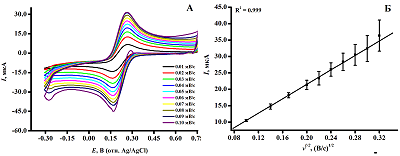
Из построенных распределительных диаграмм можно сделать вывод, что для величины внешнего диаметра фУНТ характерен диапазон 20–128 нм, а для величины внутреннего диаметра характерен диапазон 25–85 нм. 3. ПРОТОКОЛ РАСЧЁТА ЭЛЕКТРОАКТИВНОЙ ПОВЕРХНОСТИ МОДИФИЦИРОВАННЫХ ЭЛЕКТРОДОВ Для анализа эффективности модификации использовали алгоритм расчета и сравнения электроактивных поверхностей модифицированного и немодифицированного «голого» электродов. На циклических вольтамперограммах (рис.2А) присутствуют два пика, характеризующие процессы окисления и восстановления на электроде, что свидетельствует об обратимости окисления гексацианоферрата калия. Дальнейший обсчёт пиков проходил по процессу восстановления гексацианоферрата калия. Расчёт электроактивной площади модифицированного электрода осуществляли по уравнению Рэнделса-Шевчика [6-8]:
где IRed – ток пика восстановления феррицианида [A], A – площадь электроактивной поверхности электрода [см2], υ – скорость развертки потенциала [В/с], D – коэффициент диффузии [см2/с], n – число электронов, участвующих в электрохимической реакции. Для вычисления значения электроактивной поверхности электрода построен график зависимости интенсивности электроокисления от корня квадратного из скорости сканирования (рис.2Б). Угловой коэффициент зависимости IRed от равен 0.01033*A, следовательно:
Для характеристики процессов на модифицированном электроде рассчитывали потенциалы окисления и восстановления (E(Red,Ox)), разность потенциалов (ΔE), полупотенциал (E1/2) и интенсивности электроокисленияи восстановления феррицианида калия (I(Red,Ox)) при скорости развертки потенциала 50 мВ/с (табл.1).
Таким образом, чем выше электроактивная поверхность, тем электрод более эффективно будет участвовать в процессе переноса электронов, что обеспечит хорошие электроаналитические характеристики биосенсора. В таблице 2 приведены рассчитанные значения электроактивных поверхностей для различных модификаций.
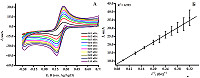
Наиболее электроактивной является модификация послойного нанесения дисперсий фУНТ и TiO2 (0.1355 см2). Некоторые модификации, например, TuballBatt, требуют оптимального соотношения компонентов дисперсии и выбора условий модифицирования. Диспергирующая жидкость так же влияет на электроактивность модификатора, так, фУНТ в этаноле на порядок электроактивнее, чем фУНТ в хлороформе (табл.2). 4. ПОСТРОЕНИЕ КОНЦЕНТРАЦИОННЫХ ЗАВИСИМОСТЕЙ БИООБЪЕКТОВ НА ПРИМЕРЕ ДНК И РАСЧЁТ МЕТРОЛОГИЧЕСКИХ ПАРАМЕТРОВ БИОСЕНСОРОВ Построение концентрационных зависимостей позволяет рассчитать электроаналитические и метрологические параметры электродов с различными модификациями для количественного анализа биологических молекул. Сравнение чувствительности, предела определяемых концентраций и предела количественного обнаружения полученных биосенсоров позволяет разработать оптимальную и эффективную систему определения точной концентрации. Количественный анализ биологического объекта проводили по интенсивности электроокисления/электровосстановления его электроактивного центра. Для построения градуировочных зависимостей ДНК по гуанину и аденину отдельно, например, использовали метод дифференциально-импульсной вольтамперометрии, сопряженной с электронакоплением образцов. В горизонтальном режиме на поверхность ПГЭ наносили 60 мкл ДНК различной концентрации. Электронакопление проводили при постоянном потенциале 0.4 В в течение 15 минут, затем производили измерение ДИВА со следующими параметрами: диапазон потенциалов 0.4 ÷ 1.1 В, амплитуда импульса 0.025 В, шаг потенциала 0.005 В, длительность импульса 50 мс, амплитуда модуляции 0.05 В. Все потенциалы отнесены к хлоридсеребряному электроду сравнения (Ag/AgCl). Относительное стандартное отклонение оцениваютя не менее чем для трех измерений (n = 3) [9]. На сегодняшний день разработаны электрохимические биосенсорные системы с использованием углеродных наноматериалов в качестве модификации для регистрации изоформ цитохрома Р450 [10] и анализа миоглобина (Mb) [11]. Электрохимические биосенсорные системы с использованием модификации коллоидных золотых наночастиц, полученных химическим синтезом, используются в анализе кардиомаркеров [12]. На вольтамперограммах ДНК присутствуют два пика в области потенциалов 0.55 ± 0.05 В и 0.86 ± 0.01 В, которые соответствуют электроокислению гуанина и аденина соответственно (рис. 3А). Были зафиксированы максимальные амплитуды электроокисления пуринов, затем построена линейная зависимость IOx от концентрации ДНК (рис. 3Б, В).
На линейном участке графика зависимости интенсивности электроокисления дцДНК от концентрации дцДНК были определены метрологические и электрохимические параметры, представленные в таблице 3 [13-17].
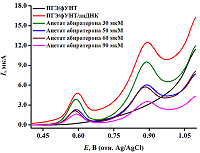
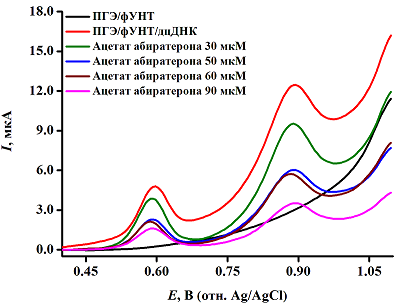
Данный алгоритм позволяет сравнить различные модификации по параметру электроактивной поверхности электродов и на основе электрохимических и метрологических параметров биосенсора объективно оценить их эффективность, провести обоснованный выбор модификации для количественного анализа биосенсора. 5. ИССЛЕДОВАНИЕ МЕХАНИЗМА ВЗАИМОДЕЙСТВИЯ ДНК И ЛЕКАРСТВА. РАСЧЁТ ЭЛЕКТРОХИМИЧЕСКОГО КОЭФФИЦИЕНТА ТОКСИЧНОСТИ ПРЕАРАТА. РАСЧЁТ КОНСТАНТЫ СВЯЗЫВАНИЯ Для моделирования взаимодействия ДНК и лекарства проводили расчёт константы связывания. Исходя из значения константы связывания, делали вывод о типе связывания (интеркаляция, взаимодействие лекарства с бороздками ДНК, электростатические взаимодействия). Расчёт константы связывания может быть применен для лиганд-рецепторных взаимодействий, подход является универсальным. Исследование взаимодействия биологического объекта и лекарства электрохимическим методом анализа начинается с выбора оптимальных условий эксперимента при различном времени инкубации комплекса, затем на рабочую поверхность модифицированного ПГЭ наносят 60 мкл аналита и проводят измерение методом ДИВА при параметрах, используемых для построения концентрационной зависимости биообъекта, алгоритм 4 (рис.4). Регистрация концентрационно-зависимого снижения интенсивности электроокисления гуанина и аденина дцДНК соответствует образованию электрохимически менее активного, чем ДНК, комплекса, а также возможность расчёта электрохимического коэффициента токсичности препарата (Т). Информация о смещении потенциала электроокисления пуринов в отрицательную (катодную) или положительную (анодную) область потенциалов даёт возможность охарактеризовать процесс связывания ДНК-лиганд. При интеркаляционном виде связывания регистрируется смещение потенциалов электрохимического окисления ГЦО в положительную (анодную) область потенциалов. Смещение в отрицательную (катодную) область потенциалов может свидетельствовать об образовании водородных связей и/или электростатических взаимодействиях в системе ДНК-лиганд [18-21].
Электрохимический коэффициент токсичности препарата рассчитывают как величина изменения интенсивности пиков электроокисления биологического объекта по формуле 3:
где Tb и Ts – интенсивности пиков электроокисления биологического объекта до и после взаимодействия с лекарством, соответственно. По принятым критериям препарат считается нетоксичным, если коэффициент токсичности (T), больше 85%; препарат относится к умеренно токсичным, если T имеет значения от 50 до 85%, и препарат токсичен, если T меньше 50% [8, 22-24]. Константу связывания для процесса образования комплекса, например, (4) рассчитывают по уравнениям (5,6,7) при постоянной концентрации , строят графики, оптимальным среди которых является график, представляющий прямую зависимость [18, 25, 26].
где Kb - константа связывания, (М-1), I – максимальная амплитуда тока электроокисления , I(ДНК- - максимальная амплитуда тока электроокисления комплекса []. Пересечение линейного графика одной из зависимостей используют для определения значения константы связывания ДНК и лиганда. Расчёт константы связывания подходит не только для анализа ДНК, но и молекул, которые могут электроокисляться, например, лекарственные препараты, в том числе включённые в фосфолипидные наночастицы и другие биологически активные соединения. Константы связывания для интеркаляции и взаимодействия лиганда с бороздками ДНК находятся в пределах 105÷109 М-1. Для электростатических взаимодействий константы связывания имеют существенно более низкие значения (как правило, 103 М-1) [22, 25-30]. На основании анализа полученных результатов по смещению потенциалов электрохимического окисления гуанина и аденина при образовании комплекса [ДНК-лекарство] и значений констант связывания можно сделать вывод о механизме взаимодействия препарата с биологическим объектом. 6. РАСЧЁТ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ Термодинамические параметры используются для понимания химических процессов, а методы расчёта успешно применяются к биологическим процессам. Знание термодинамического профиля связывания лиганда с нуклеиновыми кислотами важно для понимания механизма медико-биологического действия препаратов и разработки новых препаратов с улучшенным лечебным эффектом. Термодинамический анализ связывания лиганда с ДНК основан на анализе экспериментально измеренных изменений свободной энергии Гиббса (ΔG), энтальпии (ΔH) и энтропии (ΔS). Электрохимические методы могут использоваться при расчёте термодинамических параметров ДНК-лекарство и лиганд-рецепторных взаимодействий. Значение свободной энергии Гиббса позволяет сделать вывод о самопроизвольном протекании реакции комплексообразования при ΔG<0 и рассчитывается по формуле 8, энтропийный вклад и энтальпия рассчитываются по формулам 9 и 10:
где – свободная энергия Гиббса, – изменение энтальпии, – энтропийный вклад, – свободная энергия Гиббса, R – газовая постоянная, Т - температура, Kb – константа связывания [13]. Для механизма связывания лиганда в бороздках ДНК энтропийный вклад обычно имеет положительный вклад, тогда как интеркаляторы обычно характеризуются отрицательным вкладом энтропии. Положительное изменение энтальпии является благоприятным для интеркаляторов. Таким образом, связывание в области бороздок ДНК в первую очередь регулируется энтропией, а интеркаляция регулируется энтальпией [31]. 7. ЭЛЕКТРОХИМИЧЕСКАЯ РЕГЕНЕРАЦИЯ ПОВЕРХНОСТИ ЭЛЕКТРОДА Для модифицированных электродов с иммобилизованными нековалентно биологически активными соединениями (ДНК, белки, лекарственные препараты), которые необратимо окисляются на поверхности электрода, в частности, пуриновыми гетероциклическими основаниями, после количественного анализа существует возможность проводить электрохимическую очистку для их многократного использования. На поверхность электрода в горизонтальном режиме наносят 60 мкл биологического объекта необходимой концентрации, и проводят электронакопление по алгоритму 4. Регенерация ПГЭ осуществляется путём проведения 35 повторений метода циклической вольтамперометрии в диапазоне потенциалов 0.4 ÷ 1.1 В для ДНК при скорости развёртки потенциалов 100 мВ/с в электролитном буфере (количество повторений для определённого биологического объекта исследуется экспериментально). На рисунке 5 видно, что после регенерации электрода, модифицированного послойно дисперсиями фУНТ и TiO2, отсутствуют сигналы электроокисления пуриновых оснований, что подтверждает отсутствие биологического объекта на электроде.
Таким образом, модифицированный электрод может быть использован несколько раз для определения, например, концентрации пуриновых гетероциклических оснований. ФИНАНСИРОВАНИЕ Работа выполнена в рамах Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период 2021 - 2030 годы (№122030100168-2). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ЛИТЕРАТУРА
|