|
Выбор наиболее эффективного протокола выделения иммуноглобулинов Y из желтка куриного яйца
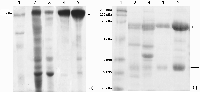
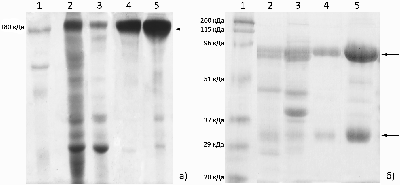
Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: иммуноглобулины Y; выдение и очистка; желток куриного яйца; делипидизация; осаждение сульфатом натрия; электрофорез в ПААГ DOI: 10.18097/BMCRM00179 ВВЕДЕНИЕ Иммуноглобулин Y (IgY) – главный защитный компонент куриного яйца, переходящий в желток из плазмы крови курицы и оберегающий потомство от патогенов. Образующиеся при иммунизации кур специфичные к антигенам антитела секретируются в желток яйца, и таким образом иммунизированная курица-несушка становится фактически фабрикой по производству специфичных антител [1]. Как и иммуноглобулины лабораторных животных, относящихся к млекопитающим, IgY используют в качестве аналитических инструментов при выявлении специфичных антигенов или содержащих эти антигены биообъектов, при картировании антигенных детерминант [2-8]. Преимуществами IgY в этом качестве являются их более высокая стабильность [9], простота очистки, высокие выходы при наработке и выделении и, соответственно, более низкая стоимость производства антител [10-18], возможность получения антител к антигенам, консервативным для млекопитающих [19]. Более 30 лет препараты специфичных IgY успешно применяют при лечении инфекционных и паразитарных заболеваний у сельскохозяйственных животных [20]. Известно, что IgY не связываются с белками системы комплемента и ревматоидным фактором млекопитающих, что снижает фоновые неспецифические сигналы при иммуноанализах и побочные реакции при лечении [2, 3]. В последние годы продемонстирована возможность использования специфичных IgY в качестве средств пассивной иммунизации для профилактики и лечения вирусных инфекций человека [1, 21-27]. В частности, показано, что IgY, полученные из яиц кур, иммунизированных препаратами spike-белка SARS-CoV2 либо его рецептор-связываюшего домена, проявляют вируснейтрализующую активность [25]. Один из таких препаратов проходит доклинические исследования [26]; обсуждается возможность применения специфичных IgY для пассивной иммунопрофилактики COVID-19 [23, 26]. Также получены препараты специфичных IgY и их scFv-фрагментов, пригодные для использования в диагностических иммунотест-системах для определения присутствия высококонсервативного нуклеокапсидного белка SARS-CoV2 в биологическом материале [6, 7]. Однако приведенные в этих статьях протоколы получения препаратов IgY – явно не отимальные способы с довольно низкими выходами IgY, загрязненных заметными количествами примесных белков. Сами авторы указывают на эти недостатки [25]. Таким образом, выбор оптимального протокола выделения IgY из яичного желтка является актуальной задачей, особенно учитывая возможное применение IgY в качестве фармацевтических препаратов, в которых иммуноглобулины должны быть свободны от токсичных и вызывающих аллергию примесей. Для получения препаратов IgY разработаны несколько протоколов, которые различаются способами удаления липидов и липопротеинов, составляющих основную субстанцию желтка яйца [10-18]. В некоторых работах проводилось сравнение эффективности отдельных протоколов друг с другом, однако ни в одной из них не сравнивали друг с другом известные протоколы выделения IgY, пригодные для получения препаратов, допустимых к применению в фармацевтике. Целью настоящей работы было сравнение таких универсальных экологичных протоколов выделения IgY из куриных яиц и выбор наиболее эффективного из них по соотношению выхода белка и относительного содержания IgY в получаемом препарате. МЕТОДИКА В работе были использованы следующие реактивы: каприловая (октановая) кислота «ч» («1СКЛАД», Россия), натрий хлористый («Реахим», Россия), трис-основание «ос.ч» («Химмед», Россия), соляная кислота «х.ч» («Сигма Тек», Россия), азид натрия «Extra pure», N,N'-метиленбисакриламид, додецилсульфат натрия (SDS), персульфат аммония («Acros organics», Бельгия), декстрансульфат натрия («Serva», Германия), кальций хлористый («Лаверна», Россия), натрий сернокислый «х.ч» («Спектр-хим», Россия), динатрий гидрофосфат додекагидрат «х.ч.» («Диа-М», Россия), калий дигидрофосфат («Merck», Германия); акриламид, N,N,N',N'-тетраметилэтилендиамин, глицин, кумасси бриллиантовый синий R250, смесь связанных с красителем белков с известной молекулярной массой «Prestained SDS-PAGE Standards, Broad Range» («BioRad Laboratories», США), глицерин («BioFroxx», Германия), бромфеноловый синий («Reanal», Венгрия), набор реагентов для определения концентрации белка «Pierce™ BCA Protein Assay Kit» («Thermo Fisher Scientific», США). IgY выделяли из желтков яиц категории С0 производства агрофабрики «Птицефабрика Сеймовская» (Россия). Скорлупу яиц промывали мылом и раствором питьевой соды, аккуратно разбивали, желток отделяли от белка, прокатывали его по бумажному полотенцу для отделения халязиона, помещали в мерный цилиндр и протыкали желточный мешок. Если не оговорено, процессы проводили при комнатной температуре. Выделение IgY с использованием каприловой кислоты Выделение проводили согласно [10] с уточнением (протокол КК). К 10 мл желтка добавляли 40 мл холодной воды, доводили рН смеси до 5.0 0.1 н. HCl при перемешивании на магнитной мешалке (550 об/мин) в течение 10 мин. Далее смесь медленно перемешивали (150 об/мин) 2 ч и центрифугировали (9000 g, 4°C) 30 мин. Осадок отбрасывали, к супернатанту при перемешивании добавляли по каплям каприловую кислоту до конечной концентрации 2% (по объему), доводили рН до 5.0 0.1 н. HCl. Перемешивали ещё 30 мин и центрифугировали, как указано выше. Диск, образовавшийся в центрифужной пробирке над супернатантом, удаляли, собирали супернатант и добавляли к нему каприловую кислоту, как указано выше, до конечной концентрации 4% (по объему), с доведением рН до 5.0. Повторяли центрифугирование и добавление каприловой кислоты до конечной концентрации 6% (по объему) аналогично указанному выше. Полученный осадок удаляли центрифугированием, супернатант, содержавший IgY, титровали 1 М раствором трис-основания до рН 9.0. Выделение IgY с использованием декстрансульфата Выделение проводили согласно [4, 11] (протокол ДС). К 10 мл желтка добавляли 40 мл холодной воды, доводили рН смеси до 5.0 0.1 н. HCl при перемешивании на магнитной мешалке 550 об/мин в течение 10 мин. Далее получали препарат IgY, как описано в работе [11]. Выделение IgY разбавлением водой Выделение проводили согласно работам [12, 13] (протокол РВ). К 10 мл желтка добавляли 50 мл воды, подкисленной до pH 5 0.1 н. HCl, перемешивали 30 мин на магнитной мешалке (550 об/мин) и выдерживали без перемешивания 12 ч при 4°C. Смесь центрифугировали (9000 g, 4°C) 30 мин. Осадок отбрасывали, к супернатанту добавляли при перемешивании сухой Na2SO4 до конечной концентрации 18% (масса/объём), инкубировали 1 ч и центрифугировали (9000 g, 4°C) 30 мин. Осадок ресуспендировали в минимальном объеме фосфатно-солевого буфера (137 мМ NaCl, 2.7 мМ KCl, 10 мМ Na-K фосфат, рН 7.4) и диализовали против двух смен по 400 объемов того же буфера. Выделение IgY с использованием замораживания-оттаивания Выделение проводили согласно [14] с уточнением (протокол ЗО). Желток (10 мл) замораживали при -38±2°C и выдерживали при этой температуре 32 ч, затем оттаивали его в течение ночи при 4°С. Добавляли 50 мл воды при температуре 20°C, тщательно размешивали стеклянной палочкой и гомогенизировали на льду блендером при 11000 об/мин в течение 10 с. Гомогенат центрифугировали 10 мин при 9000 g и 4°C, липидный диск в верхней части центрифужной пробирки и осадок отбрасывали. Концентрацию белка определяли с помощью цветной реакции с бицинхониновой кислотой, используя готовые реагенты набора «Pierce™ BCA Protein Assay Kit»; калибровочную кривую строили по бычьему сывороточному альбумину. В растворы стандарта и препаратов IgY до добавления реагентов набора вносили додецилсульфат натрия до конечной концентрации 0.04% (масса/объём) для обеспечения полной солюбилизации остаточных липопротеинов. Электрофорез проводили в полиакриламидном геле (ПААГ) с концентрациями разделяющего и концентрирующего геля соответственно 14% и 8% (в восстанавливающих условиях в присутствии 5% 2-меркаптоэтанола) и 12% и 6% (в невосстанавливающих условиях) в присутствии 0.1% SDS в буферной системе Лэммли [28, 29]. Для электрофореза использовали систему MiniProtean («Bio-Rad Laboratories», США). В лунки геля наносили по 8 мкг препаратов IgY в 10 мкл буфера образца [28, 29]. Для определения относительной локализации IgY и его субъединиц в ПААГ калибровали гель смесью белков-маркеров «Prestained SDS-PAGE Standards, Broad Range» («Bio-Rad Laboratories»). Окрашивали белки в ПААГ кумасси бриллиантовым синим R250. Интенсивность окраски полос белков после электрофореза в ПААГ определяли денситометрированием фотографий полос геля с помощью программного продукта «GelAnalyzer 19.1» [30]. Относительное содержание IgY рассчитывали как отношение интенсивности полос, соответствующих целым молекулам IgY (после электрофореза в ПААГ в неденатурирующих условиях), или суммы интенсивностей полос субъединиц IgY (после электрофореза в ПААГ в денатурирующих условиях) к сумме интенсивностей полос всех белков на дорожке геля. РЕЗУЛЬТАТЫ Исследованные нами протоколы выделения препаратов суммарных IgY из желтков куриных яиц различались способами удаления липидов и липопротеидов. Сравнение эффективности выделения IgY по разным протоколам проводили по количеству общего белка в конечных препаратах IgY и степени чистоты этих препаратов (относительному содержанию IgY по данным диск-электрофореза в ПААГ). На рисунке 1 показаны результаты электрофореза в ПААГ препаратов IgY, полученных с помощью исследованных нами четырех протоколов. Из рисунка 1 видно, что все полученные препараты обогащены IgY; полосы, соответствующие целым молекулам IgY (рис. 1а) и его отдельным субъединицам (рис. 1б), преобладают на всех дорожках ПААГ.
Наиболее чистые препараты IgY были получены по протоколам ДС и РВ. В таблице 1 представлены результаты определения количества общего белка и относительного содержания IgY в препаратах IgY, полученных по разным протоколам.
Как следует из таблицы 1, по соотношению выхода белка и чистоты препарата IgY наилучшим оказался протокол РВ. ОБСУЖДЕНИЕ
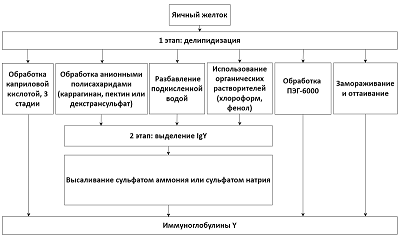
Представленные в литературе протоколы получения суммарных препаратов IgY из желтков куриных яиц различаются главным образом способами делипидизации и удаления липид-ассоциированных белков, составляющих основную долю субстанции желтка. Все протоколы можно схематически разделить на шесть групп в зависимости от используемого способа делипидизации [17]: 1) удаление каприловой кислотой путём формирования смешанных мицелл с липидами и липопротеинами [10]; 2) удаление связыванием с анионными полисахаридами (декстрансульфатом, каррагинаном, пектином) [4, 5, 11, 18]; 3) экстракция липидов и осаждение белков органическими растворителями и реагентами (хлороформом, фенолом) [15-17]; 4) удаление осаждением из подкисленного водного раствора [12, 13]; 5) селективное осаждение липопротеинов и IgY растворами полиэтиленгликоля (ПЭГ) 6000 разной концентрации [15]; 6) удаление липидов за счёт нарушения взаимодействия с белками при длительном замораживании и медленном оттаивании [14] (рис. 2).
Целью нашей работы был выбор наилучшего протокола получения фракции IgY из яичного желтка с точки зрения выхода продукта, его чистоты, материальных и трудозатрат. Ещё одним критерием выбора была универсальность применения протокола, то есть возможность его использования как в научных исследованиях, так и при получении фармацевтически приемлемых препаратов; по этой причине мы изначально не рассматривали протоколы с применением органических растворителей и реагентов (протоколы групп 3 и 5). Таким образом, мы сравнивали четыре протокола, использующие четыре разных способа делипидизации: 1) с помощью обработки каприловой кислотой (протокол КК), 2) связыванием с декстран сульфатом (протокол ДС), 3) подкисление в водном растворе (протокол РВ), 4) с использованием длительного замораживания и медленного оттаивания (протокол ЗО). Ни в одной из ранее опубликованных работ не проводилось сравнение протоколов с этими четырьмя типами делипидизации. Следует отметить, что в трех из этих четырех протоколов после делипидизации IgY далее осаждали сульфатом аммония или натрия; только при обработке каприловой кислотой, как утверждали авторы протокола [10], такое осаждение не требовалось. Полученные нами результаты сравнения четырех протоколов выделения IgY из желтка куриных яиц показывают, что наиболее эффективным с точки зрения выхода препарата и его чистоты является протокол РВ, представленный в работах [12, 13] и включающий делипидизацию путём разведения субстанции желтка подкисленной до рН 5 водой и последующее осаждение IgY сульфатом натрия (рис. 1, табл. 1). В первой из них авторы применяли для осаждения IgY сульфат аммония 30% насыщения. Аналогичный протокол был использован при выделении препаратов IgY, специфичных к нуклеокапсидному белку SARS-CoV2 [2]. В работе [13] осаждали IgY сульфатом натрия (концентрация Na2SO4 в растворе 18% насыщения, вес/объем), тогда как в ранее описанном протоколе те же авторы использовали сульфат аммония 50% насыщения. При воспроизведении оригинального протокола при осаждении сульфатом аммония нами отмечено образование очень небольшого количества неплотного осадка, тогда как использованное в более поздней работе и в наших более ранних экспериментах осаждение IgY сульфатом натрия [4, 5] оказалось значительно более эффективным (табл. 1). При использовании протокола ДС был также получен препарат IgY довольно высокой степени очистки, однако выход иммуноглобулинов был намного ниже, чем в протоколе РВ. При использовании остальных двух протоколов были получены препараты IgY, сильно загрязненные примесными белками, что явно осложнит последующую очистку специфичных IgY, а также не позволит применять получаемые IgY в качестве фармпрепаратов из-за присутствия потенциальных аллергенов куриного яйца. ЗАКЛЮЧЕНИЕ Наиболее эффективный, согласно нашим результатам, способ получения препарата IgY из желтка куриных яиц путём разбавления подкисленной водой с последующим высаливанием сульфатом натрия универсален и может применяться как в научных исследованиях, например, как первая стадия очистки специфичных поликлональных антител, далее выделяемых аффинной хроматографией, так и в фармацевтической промышленности, сельском хозяйстве и ветеринарии. В получаемом препарате отсутствуют потенциальные токсичные примеси, а технология отличается экологичностью. Помимо эффективности выделения IgY, данный протокол отличают дешевизна используемых расходных материалов и оборудования и низкие трудозатраты. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ В работе не проводились эксперименты с использованием животных и биологических материалов, полученных от человека. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 гг.), тема № 122030100170-5. КОНФЛИКТ ИНТРЕСОВ Авторы сообщают об отсутствии конфликта интересов. ЛИТЕРАТУРА
|