|
Определение дефицита андрогенов при бесплодии и сниженном овариальном резерве по данным ВЭЖХ-МС/МС и ИХЛА
Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии Ключевые слова: масс-спектрометрия; ИХЛА; дефицит андрогенов DOI: 10.18097/BMCRM00182 ВВЕДЕНИЕ
Современные исследования в репродуктивной медицине направлены на поиск предикторов неудачных исходов вспомогательных репродуктивных технологий (ВРТ). Для обеспечения репродуктивной функции в контексте откладывания деторождения на более поздний возрастной период особую значимость приобретает проблема снижения овариального резерва, а также бедный овариальный ответ у женщин с бесплодием: в данных условиях необходимо назначение наиболее оптимальной терапии, что невозможно без корректной лабораторной диагностики. В многочисленных исследованиях доказано влияние на здоровье женщин как избыточного синтеза андрогенов (гиперандрогении) при синдроме поликистозных яичников (СПЯ), так и их сниженного синтеза [1]. Андрогены имеют доминирующее значение для формирования репродуктивной функции, а также играют важную роль при поддержании гормонального баланса в репродуктивном и постменопаузальном периоде [2]. Мультисистемная роль андрогенов подтверждается наличием экспрессии андрогенных рецепторов не только в репродуктивных органах, но и в органах всего организма, включая молочные железы, центральную нервную систему, костную ткань, мышечный каркас, жировую ткань и даже волосяные фолликулы [3]. Андрогены определяют и влияют на метаболизм, когнитивные функции и психоэмоциональную сферу благодаря наличию фракций с различной биологической активностью [4]. Андрогены управляют фолликулогенезом и образованием женских половых гормонов (эстрогенов), в результате чего происходит атрезия фолликула в присутствии высоких концентраций дигидротестостерона и тестостерона [5]. Требуемые концентрации андрогенов в организме поддерживаются за счет их периферического синтеза, а также синтеза яичниками и надпочечниками. При этом основная часть синтезируется в яичниках и надпочечниках двумя путями: через дельта-5 (преимущественно в надпочечниках) и дельта-4 (преимущественно в яичниках) производные [6]. С возрастом в организме женщины снижается уровень андрогенов, поэтому проблема их дефицита у женщин представляется крайне важной и актуальной. В 35-37 лет данный аспект становится клинически заметнее и к 40 годам отмечается изменение концентраций репродуктивно значимых гормонов еще до нарушения ритма менструаций [6-8]. Андрогены являются инициаторами фолликулогенеза – дирижерами репродуктивной компетентности яичников. Нормальный уровень андрогенов ассоциирован с регулярным ритмом менструального цикла и овуляцией, а изменение их концентрации приводит к развитию патогенетических состояний: от синдрома преждевременного выключения функции яичников до формирования поликистозных состояний [9, 10]. Для оценки многих клинических состояний, а также проведения корректной терапии необходима оценка андрогенного профиля [11–14]. Диагностика дефицита андрогенов у женщин репродуктивного возраста относительно новое направление в медицине [16], на данный момент остаются вопросы, связанные с коррекцией симптомов, так и с причинами [7, 17]. В настоящее время для измерений концентрации стероидных гормонов могут быть использованы несколько методов измерений[18, 19]: иммуно-ферментный анализ (ИФА), иммунохемилюминисцентный анализ (ИХЛА), газовая хромато-масс-спектрометрия (ГХМС) и жидкостная хроматография с тандемной масс-спектрометрией (ВЭЖХ-МС/МС). Каждая из перечисленных методик имеет свои особенности. Так, использование газовой хроматографии позволяет добиться хорошей чувствительности и специфичности при одномоментном измерении панели стероидных гормонов, но платой за это становится необходимость дериватизации [20-23] тяжелых молекул (к классу которых относятся андрогены), что делает более удобным использование жидкостной хроматографии в сочетании с тандемной масс-спектрометрией [20,24–26]. Использование методов иммуно-ферментного анализа при высокой чувствительности сопряжено с возможным завышением полученных значений вследствие влияния кросс-реактивности [11, 27-29]. При дефиците андрогенов их концентрации очень низки, что приводит к значительной ошибке при измерении методом ИХЛА [11, 28, 29]. Не каждая региональная клиническая больница может позволить себе измерения методом ВЭЖХ-МС/МС. Метод ИХЛА для анализа стероидных гормонов активно применяется в большинстве медицинских учреждений и сертифицирован Министерством Здравоохранения РФ для постановки клинического диагноза. В данной работе разработаны математические модели (логистические регрессии) для постановки диагноза андрогенного дефицита у женщин разного возраста с помощью данных стероидного профиля сыворотки крови (ВЭЖХ-МС/МС и ИХЛА). МЕТОДИКА В работе использовались образцы крови, полученные от 40 женщин репродуктивного возраста с бесплодием и сниженным овариальным резервом (СОР), обратившихся для проведения программ вспомогательных репродуктивных технологий (ВРТ) ЭКО/ИКСИ в Национальный медицинский исследовательский центре акушерства, гинекологии и перинатологии им. академика В.И. Кулакова. Все они прошли тестирование на основе опросника андрогенного дефицита у женщин [15] для оценки степени значимости проявления клинических симптомов дефицит андрогенов (ДА). Средний возраст пациенток составил 37.3±2.4 лет. По результатам опросника все пациентки были разделены на две группы:
Группа контроля состояла из клинически здоровых пациенток (меньше 17 баллов) и тех, кто не имел выраженных симптомов (от 17 до 26 баллов включительно). Группа с ДА состояла из пациенток со слабо выраженными симптомами ДА (от 27 до 36 баллов включительно), пациенток со средней (от 37 до 49 баллов включительно) и высокой степенью выраженности ДА (50 баллов и больше). Для проведения исследований кровь забирали на 2-3 день менструального цикла утром, натощак из локтевой вены c помощью закрытых систем для взятия венозной крови S-Monovette® («Sarstedt», Германия) с активатором образования сгустка. Для анализа использовали сыворотку, полученную путем центрифугирования при 1207 g 10 мин. Центрифугирование крови проводили не позднее, чем через 1 ч после взятия. Аликвоты полученных образцов сыворотки крови хранили при -700С. Уровень общего тестостерона определяли в сыворотке крови электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе Cobas е411 («Roche Diagnostics GmbH», Германия) с использованием коммерческих наборов данного производителя. Концентрацию андростен-3,17-диона, дегидроэпиандростерон-сульфата (ДГЭАС) кортизола в сыворотке крови определяли иммунохемилюминесцентным методом на автоматическом иммунохимическом анализаторе IMMULITE®2000 («Siemens», США). Определение 17-a-OH-прогестерона и дигидротестостерона проводили твердофазным иммуноферментным методом с помощью коммерческих наборов ДРГ 17-α-ОН-Прогестерон ИФА («DRG Diagnostic», США) и Dihydrotestosterone (DHT) ELISA («Diagnostics Biochem Canada Inc», Канада). При подготовке образцов к ВЭЖХ-МС/МС измерениям использовали набор аналитических стандартов стероидных гормонов Steroid Hormones in Serum LC-MS/MS Analysis Kit («JASEM», Турция), который включал в себя 2 оптимизационных смеси, 4 калибровочных смеси и 2 уровня контроля качества в лиофилизированном виде, смесь внутренних стандартов (IS) и чистую сыворотку (Blank). Кроме того, в работе использовали дистиллированную воду Milli-Q, муравьиную кислоту (98%, «Sigma-Aldrich», США), ацетонитрил (99,9%, HPLC Gradient grade, «Fisher Chemical», США), метил-трет-бутиловый эфир (МТБЭ ≥99,5%, HPLC grade, «Fisher Chemical»), метанол (99,9%, HPLC Basic, «Scharlau», Испания). Стероидные экстракты извлекали из смеси предварительно перемешанных 460 мкл образца и 25 мкл IS методом двойной жидкостно-жидкостной экстракции МТБЭ (по 920 мкл для каждой экстракции) с последующим перемешиванием на вортексе и центрифугированием при 11300 g по 5 мин, отбором 800 мкл и 1000 мкл супернатанта соответственно, его дальнейшей сушкой в токе N2 при 50°C, растворением в 100 мкл 50 метанола. Извлеченный аналит переносился в виал со вставкой на 200 мкл для ВЭЖХ-МС/МС анализа. Разделение стероидных экстрактов осуществляли на хроматографе Agilent 1260 Infinity («Agilent», США) с использованием колонки Poroshel 120 EC-C18 (длина 100 мм, внутренний диаметр 2.1 мм, размером зерна сорбента 2.7 мкм, «Agilent») и следующих элюентов в качестве подвижной фазы: элюент А – 0.1% водный раствор муравьиной кислоты; элюент B - 0,1% раствор муравьиной кислоты в ацетонитриле. Температуру колонки поддерживали равной 50°C. Градиентное элюирование осуществляли в соответствии со следующей программой: от 0 до 2 мин – 5% B с резким подъемом до 20% B (за 0.1 мин) и медленным ростом до 60% B на 11 мин с последующим резким подъемом до 95 % (за 0.1 мин) при скорости потока 500 мкл/мин, далее скорость мгновенно увеличивали до 800 мкл/мин и сохраняли постоянной до 16 мин с последующим возвратом к элюенту первой ступени для уравновешивания колонки вплоть до 20 мин. Объем вводимого образца составлял 45 мкл, время измерения – 20 мин. Масс-спектрометрический анализ осуществляли с использованием тандемного масс-спектрометрического детектора QTRAP5500 9 («AD SCIEX PTE Ltd.», Сингапур) с источником электрораспылительной ионизации в режиме регистрации положительных и отрицательных ионов. Оптимизация параметров источника ионов и ионной оптики для мониторинга выбранных реакций (SRM) осуществляли в автоматическом режиме по каждому конкретному соединению отдельно с помощью ввода смеси стандартов через шприц с системой равномерной подачи. Полученные SRM переходы и времена удерживания веществ приведены в дополнительных материалах (табл. S1, S2). Калибровочная кривая состояла из 7 точек: 4 точки соответствовали четырем калибровочным уровням (Сal1-Сal4), три дополнительные точки были получены путем смешивания равных объемов соседних калибровочных уровней: Сal12 содержал по 230 мкл уровней Сal1 и Сal2; Сal23 – по 230 мкл уровней Сal2 и Сal3; Сal34 – по 230 мкл уровней Сal3 и Сal4. Количество уровней контроля качества также было увеличено до четырех за счет разбавления исходных уровней(QC1B, QC1, QC2B и QC2) чистой сывороткой из набора: уровень QC1B содержал 160 мкл уровня QC1 и 300 мкл сыворотки (Blank), уровень QC2B содержал 300 мкл QC2 и 160 мкл сыворотки. Концентрации гормонов в точках калибровочной кривой и контролях качества приведены в дополнительных материалах (табл. S3, S4). Доля контролей качества от общего числа проанализированных образцов составляла не меньше 10% (без учёта точек калибровочной кривой). Для контроля отсутствия загрязнения пробы посредством переноса проводили ВЭЖХ-МС/МС анализ бланка (чистая вода, прошедшая полный цикл пробоподготовки), введенного после контроля качества QC high (дополнительные материалы, рис. S1). Какого-либо отчетливого сигнала на бланке не обнаружено. Для минимизации эффекта переноса веществ между соседними анализами проводилась дополнительная промывка иглы, колонки (5 мин) и петли, для чего использовали индивидуальную программу закола с дополнительным уравновешиванием всей системы (4 мин), чтобы избежать изменения времени удерживания соединений и обеспечить постоянство воспроизведения результата. Хроматографические параметры приведены в таблице S5 (дополнительные материалы). Для статистического анализа полученных результатов использовались скрипты, написанные на языке программирования R [30]. Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка, поскольку численные значения концентраций гормонов не имели нормального распределения, результаты измерений были представлены в форме «медианное значение (Q1, Q3)» в таблицах 1 и 2. Для проверки отличий между несвязанными выборками использовался U критерий Манна-Уитни. С целью исследования возможности постановки диагноза дефицит андрогенов по данным стероидного профиля крови были разработаны модели логистической регрессии. Выбор в сторону логистической регрессии был сделан по следующим причинам: модель строили для небольшого количества данных (менее 20), с помощью данной модели удалось получить хорошее разделение между группами с наличием и отсутствие дефицита андрогенов, кроме того, логистическая регрессия является наиболее применяемой в медицинском сообществе для постановки диагноза. В качестве зависимых переменных в моделях рассматривали все возможные комбинации концентраций стероидных гормонов в крови, измеренных двумя разными методиками. В качестве независимой переменной выступала принадлежность пациентки к группе с симптомами дефицита андрогенов или к группе контроля. Из общего множества моделей для каждого метода измерения выбирали четыре с максимальными значениями площади под ROC-кривой (AUC). Для каждой модели определяли критерий Вальда, ошибки вычисления коэффициентов и p-value. С целью определения качества разработанных моделей строили ROC-кривые с определением площади под ними, вычисляли чувствительность и специфичность. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Результаты измерений стероидного профиля методом ВЭЖХ-МС/МС приведены в таблице 1. Статистически значимые различия между концентрациями стероидных гормонов в группе контроля и группе с симптомами дефицита андрогенов наблюдались для кортизола, кортикостерона, ДГЭАС и тестостерона.
В таблице 2 приведены результаты измерений стероидных гормонов методом ИХЛА для каждой группы пациентов. Статистически значимые отличия концентраций наблюдались для андростен-3,17-диона, дигидротестостерона, ДГЭАС и кортизола.
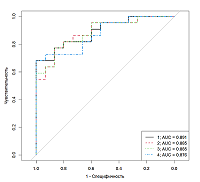
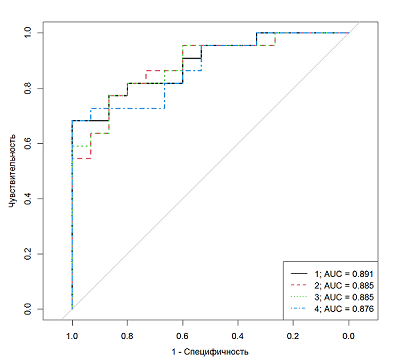
На рисунке 1 приведен ROC анализ по данным, полученных методом ИХЛА, в случае установки диагноза ДА по результатам опросника. Из всего множества кривых отображены 4 с максимальным AUC. Наилучший результат с AUC=0.891 наблюдался для кривой, обозначенной черным цветом. Для постановки диагноза по указанной модели требуются данные о концентрации четырех гормонов (измеренных методом ИХЛА): ДГЭАС, кортизол, 17-α-OH-прогестерон и андростен-3,17-дион.
Параметры и характеристики найденных логистических моделей, приведенных на рисунке 1, представлены в таблицах 3, 4. В целом для постановки диагноза недостаточно измерения одного гормона – наиболее точная модель должны содержать данные об уровне четырех гормонов: ДГЭАС, кортизол, 17-α--oh-прогестерон и андростен-3,17-дион.
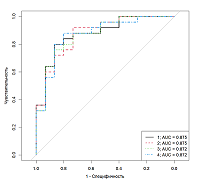
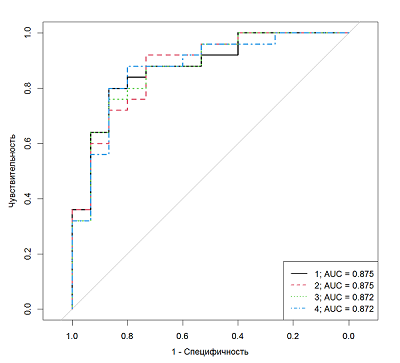
На рисунке 2 приведен ROC анализ данных, полученных методом ВЭЖХ-МС, в случае установки диагноза ДА по результатам опросника. Из всего множества кривых отображены 4 с максимальным AUC. Наилучший результат с AUC=0.875 наблюдался для кривой, обозначенной черным цветом. Для постановки диагноза по оптимальной модели требуется измерение панели из четырех гормонов: ДГЭАС, кортизол, андростен-3,17-дион и кортикостерон.
Параметры и характеристики найденных логистических моделей, построенных на основе данных измерений ВЭЖХ-МС/МС, представлены в таблицах 5, 6. Как и в случае с ИХЛА, для наиболее точной постановки диагноза необходимы данные об уровнях четырех гормонов: ДГЭАС, кортизол, андростен-3,17-дион и кортикостерон.
Среди всех возможных вариантов логистических кривых рассматривали все возможные модели, построенные по всем возможным комбинациям значений гормонов с длиной выборки от одного до четырех. Среди отобранных вариантов нет ни одного, способного выделить группу пациентов с ДА по значениям концентраций только одного или двух гормонов независимо от метода. Для диагностики дефицита андрогенов требуется измерение панели гормонов, при этом можно использовать как ВЭЖХ-МС/МС, так и ИХЛА. Обе модели для постановки диагноза на основе выраженности симптомов ДА, построенные на основании данных по концентрациям стероидных гормонов, измеренных методами ИХЛА и ВЭЖХ-МС/МС, имеют одинаковую клиническую значимость (AUC ~ 0.9). В обоих случаях среди ключевых гормонов, вошедших в модель, присутствуют ДГЭАС, кортизол и андростен-3,17-дион. В случае ИХЛА к перечисленным гормонам добавлялся 17-a-OH-прогестерон, а при измерениях ВЭЖХ-МС/МС – кортикостерон. Для модели на основании ВЭЖХ-МС/МС чувствительность и специфичность составили 84% и 87% соответственно, а для модели на основании ИХЛА – 77% и 100%. Оба метода показывают хорошее согласие при диагностике ДА при использовании панели из четырех гормонов. ЗАКЛЮЧЕНИЕ Предложенные модели логистических регрессий на основании уровня стероидных гормонов у женщин репродуктивного возраста со сниженным овариальным резервом и бесплодием имеют высокую диагностическую значимость (площадь под ROC-кривой составляет 0.9) и одинаково хорошо выделяют группу пациентов с ДА. Однако для корректной постановки диагноза необходимо измерение панели из четырех гормонов, состав которой зависит от метода измерения. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все клинические исследования проводили в соответствии с принципами, изложенными в Хельсинкской декларации. Все пациенты прочитали и подписали информированное согласие, одобренное этическим комитетом Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии имени ак. В.И. Кулакова (протокол №2 от 07.02.2019). ФИНАНСИРОВАНИЕ Работа выполнена в рамках государственного задания «Решение проблемы бесплодия в современных условиях путем разработки клинико-диагностической модели бесплодного брака и использования инновационных технологий в программах вспомогательной репродукции» №121040600410-7. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. Дополнительные материалы доступны на сайте журнала (https://doi.org/10.18097/BMCRM00182). ЛИТЕРАТУРА
|