|
ММП-9, ММП-2, VEGF и VEGFR2 как факторы инвазии и ангиогенеза при плоскоклеточной карциноме шейки матки Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121. Москва, ул. Погодинская. 10; *e-mail: ryzhakova.olga@list.ru Ключевые слова: ММП-2; ММП-9; VEGF; рецептор VEGF; опухолевая прогрессия; плоскоклеточная карцинома шейки матки DOI: 10.18097/BMCRM00187 ВВЕДЕНИЕ
Основными процессами, вовлеченными в опухолевую прогрессию, являются деструкция и ангиогенез, которые отвечают за рост и развитие опухоли, степень ее васкуляризации, способность к инвазии и метастазированию. Опухолевая инвазия и метастазирование начинаются с разрушения протеолитическими ферментами внеклеточного соединительнотканного матрикса (СТМ), окружающего опухоль, что запускает процесс перемещения опухолевых клеток в соседние ткани [1]. Ключевая роль в деструктивных процессах отводится матриксным металлопротеиназам (ММП) [2]. Следует отметить, что ММП также участвуют в различных биологических и физиологических процессах, освобождая из СТМ целый ряд биоактивных молекул – гормонов, факторов роста и цитокинов [3]. Семейство ММП включает 23 цинк-зависимых фермента с общими функциональными и структурными компонентами. Различное распределение ММП внутри клеток позволяет разделить их на ММР мембранного типа (МТ-ММП) и секретируемые ММП, а специфичность действия в отношении компонентов СТМ – на коллагеназы, желатиназы, стромелизины и матрилизины [4]. В целом, ММП способны расщеплять все основные компоненты СТМ, включая коллагены IV, III, V, I типов, а также желатин, эластин, фибронектин, витронектин и др. [4]. Существенная роль в развитии процессов инвазии и ангиогенеза отводится желатиназам А и В (ММП-2 и ММП-9), которые способны гидролизовать коллаген IV типа – основу базальных мембран, освобождая тем самым из СТМ различные факторы роста, такие как эндотелиальный фактор роста сосудов (VEGF), трансформирующие факторы роста (TGF-альфа, TGF-бета), фактор роста фибробластов (FGF) и целый ряд других [5, 6]. В настоящее время установлено, что ММП играют роль на всех стадиях опухолевой прогрессии, влияя на множество биологических функций, включая модификацию сигнальных путей, регуляцию цитокинов, участвующих в иммунном ответе и опухолевом росте, в частности, путем индуцирования ангиогенеза [7]. Повышенная экспрессия ММП обнаружена в целом ряде злокачественных опухолей, однако их спектр зависит от стадии развития опухоли, от вида опухоли и ткани. Следует отметить, что увеличение экспрессии ММП (в том числе ММП-2 и ММП-9) может наблюдаться в морфологически нормальной ткани, окружающей опухоль, что способствует опухолевой прогрессии [5, 6]. Эндотелиальный фактор роста сосудов (VEGF) и его рецепторы (VEGFR) играют важнейшую роль как в физиологическом, так и в патологическом ангиогенезе [8]. Семейство VEGF включает семь членов, имеющих гомодимерную структуру. В организме человека экспрессируется пять белков этого семейства: VEGF-A, VEGF-B, VEGF-C, VEGF-D и плацентарный фактор роста (PlGF). VEGF-A (или просто VEGF) играет наиболее важную роль в организме человека. Он является ключевым регулятором ангиогенеза [8]. Его действие направлено в основном на эндотелиальные клетки сосудов; кроме того, он оказывает влияние на ряд других типов клеток, например, стимулирует процесс миграции моноцитов, макрофагов и раковых клеток, что играет важную роль в канцерогенезе [9]. Избыточная экспрессия VEGF наблюдается в большинстве опухолей [10]. Белки семейства VEGF реализуют свои биологические эффекты при взаимодействии с рецепторами трех типов – VEGFR1 (или Flt-1), VEGFR2 (или KDR/Flk-1) и VEGFR3 (или Flt-4), которые представляют собой трансмембранные белки, обладающие тирозинкиназной активностью. Тирозинкиназы, входящие в состав каждого типа VEGFR, различаются, поэтому последующий сигналинг зависит от типа вовлеченного рецептора [10]. Основным медиатором биологического действия VEGF-А является VEGFR2. На моделях in vivo показано, что антитела к VEGFR2 ингибируют рост как первичных, так и метастатических опухолей, что указывает на решающую роль VEGFR2 в опухолевом ангиогенезе. В настоящее время VEGF-А и VEGFR2 являются основными мишенями антиангиогенной терапии [11]. Изучение экспрессии ММП при плоскоклеточной карциноме шейки матки (ПКШМ) проводится как в системах in vitro – на различных клеточных культурах рака шейки матки [12, 13], – так и на образцах опухолевых тканей [14]. Эксперименты, проводимые на культуре клеток, показывают, что взаимодействие опухолевых клеток с клетками опухолевого микроокружения может приводить к активации ММП и дальнейшей опухолевой прогрессии [13]. Целью данной работы было изучение взаимосвязи экспрессии основных факторов деструкции и ангиогенеза – ММП-2, ММП-9, VEGF и VEGFR2 при ранних и более поздних стадиях ПКШМ. МАТЕРИАЛЫ И МЕТОДЫ Клинический материал В работе был использован операционный материал, полученный от 14 пациентов с диагнозом ПКШМ, находившихся на лечении в НМИЦ онкологии им. Н.Н. Блохина. Возраст пациентов варьировал от 28 до 48 лет. Все случаи были классифицированы по TNM клинической классификации опухолей в соответствии с требованиями международного союза по борьбе с раком (UICC) (Табл. 1). Во всех образцах карцином экспрессировался ген Е7 HPV16. У 5 пациентов выявлены метастазы в регионарных лимфатических узлах (пациенты № 1-5). Операционный материал немедленно замораживали и хранили в жидком азоте. В работе были использованы 28 образцов тканей: 14 парных образцов, включающих плоскоклеточную карциному шейки матки и прилегающую к опухоли морфологически нормальную ткань.
Выделение РНК, синтез кДНК Выделение суммарной РНК из тканей проводили с использованием набора SV Total RNA Isolation System («Promega», США), обратную транскрипцию проводили с использованием набора реактивов MMLV RT kit («Евроген», Россия) согласно инструкции производителя. кДНК синтезировали с использованием случайных гексапраймеров, конечная концентрация РНК-матрицы – 50 нг/мкл. До использования образцы кДНК хранили при температуре -20°С. ПЦР в реальном времени Для подбора специфических праймеров были использованы данные GeneBank Nucleotide Sequence Database. Для оценки структуры праймеров использовали программу Oligo 4.1 Primer Analysis Software. Точное значение температуры подбирали экспериментальным путем. Подбор праймеров осуществлен с учетом интронно-экзон-
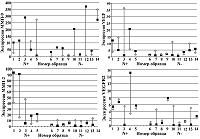
Иммуногистохимическое исследование Иммуногистохимическую (ИГХ) реакцию проводили по стандартному методу [16] с некоторыми модификациями. Образцы опухолей фиксировали раствором 10% нейтрального формалина в течение 24 ч, затем обезвоживали и пропитывали парафином в автоматизированном режиме в аппарате STP120 («Thermo Fisher Scientific», США). Срезы толщиной 4 мкм готовили на высокоадгезивных стеклах. Депарафинирование проводили по стандартной технологии. Восстановление антигенной активности проводили при температуре 97°C в течение 20 минут в цитратном буфере (10 мМ, рН 6.0). Использовали моноклональные антитела к ММП -2, ММП -9, VEGF, VEGFR2 («LabVision», США) в готовом разведении. ИГХ реакции проводили в автоматизированном режиме в иммуногистостейнере Avtosteiner («Dako», Дания). В качестве детекционной системы использовали систему Envision («Dako»), в качестве хромогена – 3,3' диаминобензидин. Затем срезы докрашивали гематоксилином. Микроскопирование проводили на микроскопе Leica Q 550 («Leica Microsystems», Германия). Интенсивность (выраженность) реакции оценивали полуколичественным способом по шкале от 0 до 3: 0 – отсутствие реакции, 1+ – слабая реакция, 2+ – умеренная реакция, 3+ – сильная реакция. РЕЗУЛЬТАТЫ Исследование генной экспрессии ММП-9, ММП-2, VEGF и VEGFR2 в образцах опухолевой и морфологически нормальной ткани Все исследуемые образцы были разделены на две группы: группа №1(N+) – парные образцы тканей (1-5), взятые от пациентов с метастазами в регионарных лимфоузлах, и группа №2(N-) – парные образцы тканей (6-14), взятые у пациентов без метастазов. Экспрессия ММП-2 была обнаружена во всех образцах групп №1(N+) и №2(N-) (рис. 1, Б). В большинстве парных образцов группы №1(N+) (1, 2, 4, 5) экспрессия ММП-2 была существенно выше в опухолевой ткани. Кроме того, в этой группе наблюдались самые значительные различия уровней экспрессии ММП-2 в образцах опухолевой и морфологически нормальной ткани. В группе №2(N-) уровень экспрессии ММП-2 практически во всех образцах был ниже, чем в группе №1(N+). В большинстве парных образцов этой группы (7, 9-13) экспрессия ММП-2 была выше в морфологически нормальной ткани. Экспрессия VEGFR2 была обнаружена во всех образцах групп №1(N+) и №2(N-) (рис. 1, Г). В девяти парных образцах обеих групп (1, 2, 5, 6, 8, 9, 11, 12, 14) уровни экспрессии VEGFR2 в опухолевой и морфологически нормальной ткани различались незначительно; в трех парных образцах из группы №1(N+) (1, 2, 5) и одном парном образце из группы №2(N-) (9) экспрессия VEGFR2 была на более высоком уровне в обоих видах ткани. Значительные различия между уровнями экспрессии наблюдались в пяти парных образцах обеих групп (3, 4, 7, 10, 13); в четырех из них (3, 7, 10, 13) экспрессия VEGFR2 была значительно выше в морфологически нормальной ткани, в одном образце (4) из группы №1(N+) – в опухоли, где ее уровень был наивысшим среди всех образцов. Суммируя полученные результаты, следует отметить, что существенные различия между уровнями экспрессии ММП-9, ММП-2 и VEGF в опухолевой и морфологически нормальной ткани наблюдались в большинстве парных образцов группы №1(N+), в то время как в большинстве парных образцов группы №2(N-) уровни экспрессии ММП-9, ММП-2 и VEGF различались значительно меньше (рис. 1, Б, В). Экспрессия VEGFR2 в большинстве парных образцов группы №1(N+) была выше, чем в парных образцах группы №2(N-) (рис. 1, Г). Более чем в половине парных образцов обеих групп не наблюдалось существенных различий между уровнями экспрессии VEGFR2 в опухолевой и морфологически нормальной ткани. Уровень экспрессии VEGFR2 был выше в тех образцах тканей (опухолевых или морфологически нормальных), в которых наблюдался и более высокий уровень экспрессии VEGF (рис. 1, В, Г).
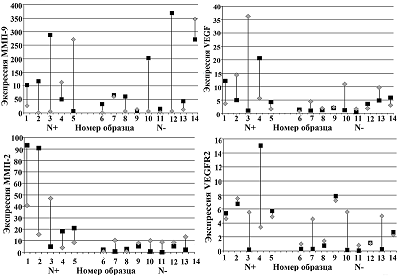
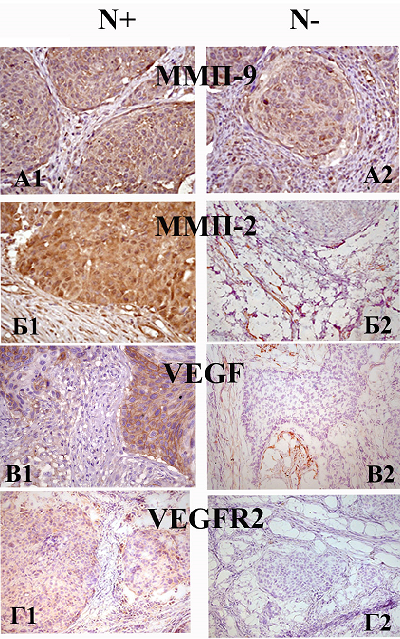
Иммуногистохимическое исследование образцов опухолевой ткани. Исследование экспрессии ММП-2, ММП-9, VEGF и VEGFR2 на уровне белка проведено методом ИГХ во всех опухолевых образцах групп №1(N+) и №2(N-). В качестве примера для каждого объекта исследования представлены фрагменты опухолевой ткани, интенсивность окрашивания которых наиболее типична для данной группы образцов (рис. 2). Экспрессия ММП-9 в образцах обеих групп была преимущественно на высоком уровне (3+/2+) (рис. 2, А1, А2). Экспрессия ММП-2 в четырёх из пяти образцов группы №1(N+) была максимальная (2+/3+) (рис. 2, Б1); в восьми образцах группы №2(N-) – отсутствовала или находилась на низком уровне (0/1+) (рис. 2, Б2), и только в одном образце экспрессия была выше (2+). Экспрессия VEGF наблюдалась во всех образцах группы №1(N+): в трёх – на уровне 3+ (рис. 2, В1), в двух – на уровне 1+ ; в группе №2(N-) в пяти образцах экспрессия либо отсутствовала, либо была на низком уровне (0/1+) (рис. 2, В2), в четырёх образцах была на уровне 2+. Экспрессия VEGFR2 в четырёх образцах группы №1(N+) была на уровне 2+/3+ (рис. 2, Г1), в одном образце – на уровне 1+; в образцах группы №2(N-) в семи случаях экспрессия была на уровне 0/1+ (рис. 2, Г2), в двух случаях – на уровне 2+/3+.
ОБСУЖДЕНИЕ Протеиназы играют важнейшую роль во множестве процессов, происходящих в течение опухолевой прогрессии; они функционируют как обширная протеолитическая сеть, включающая различные системы ферментов, находящиеся как в опухолевых тканях, так и в различных структурных компонентах опухолевого микроокружения [17]. Основными протеиназами, отвечающими за деградацию и ремоделирование СТМ во время опухолевой прогрессии, являются ММП [2, 18]. Они экспрессируются как опухолевыми клетками, так и клетками окружающих тканей, клетками опухолевых сосудов, опухоль-ассоциированными фибробластами и макрофагами, что способствует процессам инвазии и метастазирования [19, 20]. Одна из ключевых ролей в этих процессах отводится ММП-2 и ММП-9 [21] . Гидролизуя коллаген IV типа, они освобождают из СТМ множество биоактивных молекул, в том числе VEGF, имеющий решающее значение для процесса ангиогенеза [8]. Гиперэкспрессия VEGF наблюдается в большинстве опухолей человека, в том числе при ПКШМ, где коррелирует с инвазивностью, метастазированием, плотностью сосудов, рецидивами и негативным прогнозом [22, 23]. Ранее нами было показано, что при ПКШМ повышенная экспрессия и активность ряда ММП наблюдается как в опухолевых тканях (ММП-1, ММП-14 и ММП-9), так и в прилегающей к опухоли морфологически нормальной ткани (экспрессия ММП-1, ММП-2 и ММП-9) [24]. Мы предположили, что повышенная экспрессия ММП-2 и ММП-9 в морфологически нормальной ткани является неблагоприятным прогностическим фактором, поскольку может вносить дополнительный вклад в опухолевую прогрессию и способствовать развитию метастазирования, повышая секрецию VEGF при разрушении внеклеточного СТМ. Взаимосвязь между уровнями экспрессии VEGF, MMП-2 и MMП-9 в опухолях и выживаемостью пациентов была продемонстрирована при колоректальном раке и раке желудка [25, 26], а также при раке шейки матки [14, 27]. Однако экспрессия этих объектов была исследована только в опухолевых тканях (включая строму), но не в прилегающей к опухоли морфологически нормальной ткани. Сравнительный анализ генной экспрессии ММП-9, ММП-2 и VEGF показал, что практически во всех парных образцах группы №1(N+), полученных от пациентов с метастазами в регионарных лимфоузлах, наблюдается существенная разница в уровнях экспрессии в зависимости от типа ткани (рис. 1, А, Б, В). В большинстве парных образцов этой группы экспрессия ММП-9, ММП-2 преобладала в опухолевой ткани, где достигала наивысших значений, в то время как экспрессия VEGF в половине парных образцов была выше в морфологически нормальной ткани. И, наоборот, в образцах группы №2(N-), полученных от пациентов без метастазов, значительные различия в уровнях экспрессии ММП-9 наблюдались менее чем в половине парных образцов, уровни экспрессии ММП-2 различались не существенно, а в случае VEGF – единично. Экспрессия VEGFR2 в большинстве парных образцов группы №1(N+) была выше, чем в парных образцах группы №2(N-) (рис. 1, Г). Практически во всех парных образцах группы №2(N-), где наблюдалась разница в экспрессии VEGFR2, уровни ее были выше в морфологически нормальной ткани. Следует отметить, что уровень экспрессии VEGFR2 был выше в тех образцах тканей (опухолевых или морфологически нормальных), в которых наблюдался и более высокий уровень экспрессии VEGF (рис. 1, В, Г). Данные ИГХ исследования экспрессии ММП-9, ММП-2, VEGF и VEGFR2 в опухолевых образцах в целом согласуются результатами генного анализа этих объектов (рис.2). Таким образом, мы обнаружили, что уровень экспрессии ММП-9 был выше в опухолевой ткани пациентов независимо от наличия или отсутствия у них метастазов, хотя в нескольких случаях экспрессия ММП-9 была выше в морфологически нормальной ткани (рис. 1, А). ИГХ анализ образцов опухолевых тканей пациентов обеих групп (с метастазами и без метастазов) показал, что экспрессия ММП-9 практически во всех случаях была на высоком уровне (рис. 2, А1, А2). Эти данные согласуются с результатами более раннего исследования, в котором мы показали, что при ПКШМ наблюдается увеличение экспрессии ММП-9 в большинстве опухолей, а уровень экспрессии отражает метастатический и инвазивный потенциал опухоли [28]. Гиперэкспрессия ММП-9 в опухолях при ПКШМ была продемонстрирована также в ряде других исследований в тканях карцином шейки матки и образцах опухолей, находящихся на разных стадиях дифференцировки [29]. Представленные нами данные показывают, что в отличие от ММП-9, у большинства пациентов, имеющих метастазы, экспрессия ММП-2 в опухолевой ткани была значительно повышена по сравнению с окружающей тканью, в то время как у пациентов без метастазов существенных различий не наблюдалось (рис. 1, Б). Сравнение экспрессии ММП-2 в опухолевых тканях пациентов, проведенное методом ИГХ, показало, что экспрессия ММП-2 была ярко выражена у пациентов с метастазированием и находилась на низком уровне или отсутствовала у пациентов без метастазов (рис.2, Б1, Б2). Предполагается, что повышенная экспрессия MMP-2 в опухолях связана с плохим прогнозом при некоторых типах желудочно-кишечного и гинекологического рака [14, 30, 31]. Как и в случае ММП-9, у нескольких пациентов мы наблюдали повышенный уровень экспрессии ММП-2 в морфологически нормальной ткани, однако существенная разница была отмечена лишь в одном случае – в тканях пациента с метастазами (рис. 1, Б). Есть данные, что при инвазивной карциноме шейки матки экспрессия ММП-2 в клетках стромы, окружающей опухоль и находящейся в контакте с прилегающими тканями, постепенно растет по мере опухолевой прогрессии и коррелирует с клинической стадией заболевания [32]. Другие исследования, касающиеся экспрессии ММП и их эндогенных регуляторов при ПКШМ, показывают, что высокий уровень экспрессии MMП-2 в ткани стромы в значительной степени связан с плохой выживаемостью больных [14]. Таким образом, при ПКШМ неблагоприятным маркером течения заболевания может служить не только повышенная экспрессия ММП-2 в опухоли, но также и в окружающей ткани. Мы показали, что при ПКШМ существенная экспрессия VEGF наблюдалась не только в опухолевой, но и в морфологически нормальной ткани пациентов, имеющих метастазы; у большинства пациентов разница между уровнями экспрессии VEGF в опухоли и окружающей ткани была значительной (рис. 1, В). В тканях пациентов второй группы (не имеющих метастазы), экспрессия различалась не существенно, хотя в нескольких случаях более высокая экспрессия VEGF наблюдалась в морфологически нормальной ткани (рис. 1, В). Следует отметить, что характер различий в уровнях экспрессии VEGF в опухолевых и морфологически нормальных тканях пациентов обеих групп (с метастазами и без них) был близок к таковому, наблюдающемуся в случае экспрессии ММП-2, но не ММП-9 (рис. 1, В, Б, А); у пациентов с более высоким уровнем экспрессии VEGF в опухоли (по сравнению с окружающей тканью) уровень экспрессии ММП-2 был также выше в опухолевой ткани. ИГХ анализ экспрессии VEGF в опухолях показал, она была хорошо выражена более чем в половине образцов, полученных от пациентов с метастазами (рис. 2, В1), в то время как в аналогичных тканях пациентов без метастазов экспрессия была в основном слабой или отсутствовала (рис. 2, В2). О гиперэкспрессии VEGF в опухолевых тканях при раке шейки матки сообщалось также в ряде других публикаций [33]. Представленное исследование показывает, что при ПКШМ экспрессия VEGFR2 в опухолевых и окружающих опухоль тканях большинства пациентов с метастазами была выше, чем у пациентов без метастазов (рис. 1, Г). Следует отметить, что характер различий в уровнях экспрессии VEGFR2 в опухолевых и морфологически нормальных тканях пациентов обеих групп (с метастазами и без них) был близок к таковому, наблюдающемуся в случае экспрессии VEGF (рис. 1, В, Г). ИГХ анализ опухолевых тканей показал, что у большинства пациентов с метастазами экспрессия VEGFR2 была ярко выраженной, а у пациентов без метастазов экспрессия была в основном слабой или отсутствовала (рис.2 Г1, Г2). Полученные результаты согласуются с данными других авторов, которые обнаружили корреляцию между повышением сывороточной экспрессии VEGF и VEGFR2 и снижением выживаемости пациентов при инвазивной карциноме шейки матки [34]. ЗАКЛЮЧЕНИЕ Таким образом, полученные нами данные показывают, что при ПКШМ существенная экспрессия ММП-9 наблюдается в опухолях уже на ранних стадиях опухолевой прогрессии, что способствует увеличению инвазивного потенциала опухоли. В отличие от ММП-9, экспрессия ММП-2, VEGF и VEGFR2 заметно повышается на более поздних стадиях опухолевой прогрессии (при обнаружении у пациентов метастазов в регионарные лимфоузлы) как в самой опухоли, так в морфологически нормальной ткани, окружающей опухоль, что вносит дополнительный вклад в процессы деструкции, ангиогенеза и метастазирования. Мы предполагаем, что ММП-2, VEGF и VEGFR2 могут рассматриваться в качестве неблагоприятных маркеров течения ПКШМ. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Образцы плоскоклеточных карцином шейки матки были получены от пациенток НМИЦ онкологии им. Н.Н. Блохина в патологоанатомическом отделении согласно правилам этического комитета центра. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№ 122022800499-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|