|
β1-адренорецептор, солюбилизированный в форме нанодисков: скрининг различных амфипатических полимеров Национальный медицинский исследовательский центр кардиологии им. ак. Е.И. Чазова, 121552 Москва, ул. Академика Чазова, 15а; *e-mail: tanya.vlasik@gmail.com Ключевые слова: аутоантитела к β1-адренорецептору; нанодиски; амфипатические полимеры DOI: 10.18097/BMCRM00206 ВВЕДЕНИЕ
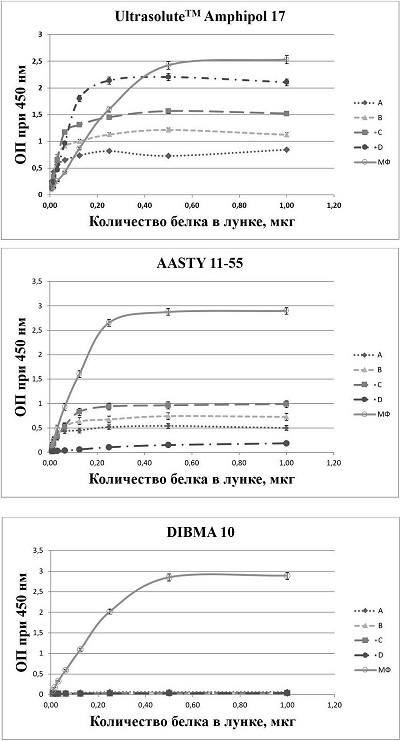
β1-адренорецептор (АДРБ1) принадлежит к классу G-белок сопряженных рецепторов. Аутоантитела к АДРБ1 (АДРБ1 АТ) часто обнаруживают в сыворотке крови больных с хронической сердечной недостаточностью (ХСН) различной этиологии. В частности, АДРБ1 АТ выявляют у больных болезнью Чагаса [1], дилатационной кардиомиопатией (ДКМП) [2, 3]), перипартальной кардиомиопатией [4]. Следует отметить, что методы выявления АДРБ1 АТ, использованные в этих работах, вследствие своей сложности плохо подходят для использования в повседневной клинико-диагностической практике. Так, в работе [1] активность АДРБ1 АТ определяли по влиянию сывороток крови больных на изолированные препараты предсердий крысы. В работе [2] тест-системой была культура спонтанно сокращающихся изолированных кардиомиоцитов крысы. Культуры клеток, трансфицированных АДРБ1, использовали в работе [3] для определения подъема концентрации цАМФ при обработке этих клеток IgG из крови больных с ХСН. Эпитопы, которые наиболее часто распознаются АДРБ1 АТ, находятся во второй внеклеточной петле АДРБ1 [5, 6]. Патогенетическая роль АДРБ1 АТ была продемонстрирована в опытах на различных лабораторных животных, что делает такие аутоантитела потенциальной терапевтической мишенью [7]. В работе [8] было показано, что неизбирательное удаление иммуноглобулинов из крови больных ДКМП приводило к увеличению сердечного индекса. Специфическое удаление АДРБ1 АТ из крови больных ДКМП (сорбенты на основе пептидов, воспроизводящих фрагменты второй внеклеточной петли АДРБ1) приводило к долгосрочному улучшению таких показателей, как фракция выброса левого желудочка и диастолический размер левого желудочка [9, 10]. В ряде работ высказывается мнение, что повышенный уровень АДРБ1 АТ в крови больных может иметь прогностическое значение. Так, наличие АДРБ1 АТ связано с существенным ухудшением функции левого желудочка при ДКМП [3]. Обнаружение стимулирующих АДРБ1 АТ (антитела, способные повышать уровень cAMP в клетках-мишенях, экспрессирующих АДРБ1) было ассоциировано с повышенной смертностью больных ДКМП и ишемической кардиомиопатией [11]. В работах [12, 13] было показано, что обнаружение антител (с помощью ИФА, где в качестве антигена использовали пептиды) являлось предиктором желудочковой тахикардии [12] и внезапной сердечной смерти [12, 13]. Сказанное выше позволяет заключить, что выявление АДРБ1 АТ в крови больных является насущной потребностью клинической практики. «Золотым стандартом» определения АДРБ1 АТ является функциональный тест, который разработали и в дальнейшем валидировали Wallukat с соавторами [14]. Первичную культуру спонтанно сокращающихся кардиомиоцитов, выделенных из желудочков сердца новорожденных крысят, обрабатывали иммуноглобулинами, выделенными из сыворотки крови больных. Оказалось, что в присутствии АДРБ1 АТ наблюдается положительный хронотропный эффект (увеличение частоты сокращений кардиомиоцитов), который можно блокировать добавлением бета-адреноблокатора (-)-пропанолола. Это доказывает обусловленность хронотропного эффекта взаимодействием АДРБ1 АТ с адренорецепторами. Хотя метод неоднократно применялся в научных исследованиях, он плохо подходит для использования в клинических лабораториях вследствие своей сложности. Кроме того, он не является количественным. Твердофазный ИФА представляет собой один из самых распространённых и простых методов определения различных биологически активных субстанций. До недавнего времени для обнаружения АДРБ1 АТ широко применяли ИФА с использованием в качестве антигена пептидов, воспроизводящих аминокислотные последовательности второй внеклеточной петли АДРБ1 [3, 12, 13, 15, 16]. Однако оказалось, что результаты таких ИФА показывают значительное число ложноотрицательных значений в сравнении с вышеупомянутым методом определения хронотропного эффекта АДРБ1 АТ [18]. По-видимому, это объясняется тем, что АДРБ1 АТ узнают преимущественно лабильный конформационно-зависимый эпитоп, присутствующий на нативных молекулах рецептора [16]. Среди иммунологических методов определения АДРБ1 АТ, в которых в качестве антигена выступает нативная молекула рецептора, следует упомянуть работу [17]. Авторы использовали клетки фибросаркомы HT1080, трансфицированные АДРБ1. Связывание аутоантител анализировали при помощи проточной цитофлуориметрии. Данный метод также не является удобным для использования в повседневной клинико-лабораторной практике, поскольку в нем применяется живая клеточная культура. Поэтому применение выделенной молекулы АДРБ1 в нативной конформации в качестве антигена для ИФА может являться оптимальным решением такой задачи. Сохранение нативной конформации и функциональной активности мембранных белков при их выделении и очистке является сложной задачей. На начальном этапе при выделении мембранных белков из клеток-продуцентов применяется их солюбилизация. Традиционный способ солюбилизации мембранных белков – использование детергентов. Однако детергенты удаляют липиды, связанные с трансмембранным доменом, что может приводить к нестабильности, денатурации и последующей деградации белка. Многообещающей альтернативой применению детергентов является солюбилизация мембранных белков в форме нанодисков. Нанодиски представляют собой планарные фрагменты бислойной мембраны, опоясанные тем или иным амфипатическим агентом, содержащие в своем составе мембранный белок в той же конформации и с той же топологией, что и в исходной клеточной мембране. В качестве амфипатического агента могут выступать мембранные каркасные белки (membrane scaffold proteins, MSP), например, полученные на основе природных аполипопротеинов, пептиды, а также различные амфипатические полимеры [19]. При получении нанодисков с помощью MSP на предварительном этапе мембранные белки экстрагируют обработкой клеток детергентами, которые удаляют на заключительном этапе при сборке нанодисков [20]. Использование амфипатических полимеров представляет особый интерес, поскольку позволяет полностью исключить применение детергентов. Амфипатические полимеры способны напрямую экстрагировать мембранные белки в нативном липидном окружении непосредственно из живых клеток либо мембранных везикул [19, 21]. Это особенно важно для сохранения исходной функциональной активности мембранного белка, которая зависит от свойств окружающих его липидов, их заряда, гибкости и длины молекулы [22]. В настоящее время синтезировано большое количество различных амфипатических полимеров, пригодных для солюбилизации мембранных белков в форме нанодисков ([19], https://www.smalp.net/polymers.html). Многие из этих полимеров являются коммерчески доступными. Целью настоящей работы была оценка способности различных полимеров солюбилизировать АДРБ1 в форме, пригодной для использования в твердофазном ИФА, то есть препарат АДРБ1 после солюбилизации должен был сохранять способность к адсорбции на пластик планшета для ИФА, а также способность распознаваться специфическими антителами. МЕТОДИКА В качестве продуцента АДРБ1 в функционально активном состоянии использовали линию клеток ADL-7A, полученную нами ранее путем трансфекции клеток HEK293 плазмидой, содержащей ген АДРБ1, с последующим отбором стабильных трансфектантов. Получение, характеристика и условия культивирования описаны в работе [23]. Получение мембранной фракции (МФ) клеток ADL-7A Клетки линии ADL-7A выращивали в чашках Петри диаметром 10 см (“Corning Inc.”, США) до плотности около 106 клеток на чашку, отмывали фосфатно-солевым буфером (ФСБ), снимали силиконовым скребком. Клетки осаждали при 300 g в течение 15 мин, после чего ресуспендировали в 5 мл буфера, содержащего 20 мМ HEPES, 1 мМ EDTA, 250 мМ сахарозe, 10 мМ ацетат магния, 1 мМ PMSF, 5 мкг/мл апротинина и лейпептина, pH 7.5. Суспензию клеток обрабатывали ультразвуком, дебрис осаждали при 1000 g в течение 15 мин. Супернатант отбирали, переносили в пробирки для ультрацентрифугирования и осаждали МФ при 100000 g, 4оС в течение 1 ч. Осадок ресуспендировали в буфере, содержащем 50 мМ NaH2PO4, 200 мМ NaCl, 5 мкг/мл апротинина и лейпептина, pH 8.0, аликвотировали и хранили при -70оС. Солюбилизация мембранных белков амфипатическими полимерами В настоящей работе были использованы 17 различных амфипатических полимеров (Synthetic Nanodisc Screening Kit MAXI,”Cube Biotech”, Германия;). Готовили 10% (вес/объем) сток-растворы полимеров в соответствии с рекомендациями производителя. Образцы МФ размораживали и определяли в них концентрацию белка методом Бредфорда. Для солюбилизации использовали образцы МФ с концентрацией белка 600-700 мкг/мл. К аликвотам МФ добавляли сток-раствор каждого из 17 полимеров до конечных концентраций 0,5%, 0,25%, 0,125% и 0,0625%. Образцы инкубировали при 37оС с перемешиванием на ротаторе Hematology Chemistry Mixer model 346 (“Fisher”, США) в течение 1 ч, затем центрифугировали при 100000 g, 4оС в течение 1 ч. Супернатанты, содержащие МФ, солюбилизированную полимерами (МФ+ПОЛ), отбирали и использовали в дальнейшей работе. Иммуноферментный анализ Образцы исходной МФ и МФ+ПОЛ адсорбировали на поверхности 96-луночных полистироловых планшетов для ИФА (“Corning Inc.”) в ФСБ при 4оС в течение ночи. Готовили серии последовательных разведений в ФСБ каждого образца в диапазоне от 10 мкг/мл до 0.08 мкг/мл с шагом 2 и вносили их в лунки по 100 мкл. На следующий день лунки планшетов промывали 4 раза ФСБ с 0.1% Tween-20 и вносили в них по 100 мкл раствора химерных (мышь/человек, 1,5 мкг/мл) рекомбинантных антител hAB2367 ко второй внеклеточной петле АДРБ1, полученных нами ранее [23], в блокирующем растворе, содержащем 20% казеинового концентрата CBC1 (“SDT GmbH”, Германия), 0,02% консерванта Proclin 300 (“Sigma”, США) и 0.1% Tween-20 в ФСБ. Инкубацию проводили в течение 1 ч при комнатной температуре с перемешиванием на орбитальном шейкере (Kodak Amerlite Shaker Incubator, model code ZLE 164, “Kodak” Великобритания), при скорости 750 об/мин. Затем лунки промывали 4 раза ФСБ с 0.1% Tween-20 и инкубировали 30 мин в тех же условиях с мышиными моноклональными антителами к человеческим IgG, конъюгированными с пероксидазой хрена [24] , которые вносили в рабочем разведении в блокирующем растворе по 100 мкл в каждую лунку. Количество связавшегося конъюгата определяли при помощи хромогенного субстрата 3,3',5,5'-тетраметилбензидина (ТМБ). Значения оптической плотности (ОП) при 450 нм (после остановки реакции раствором серной кислоты) считывали при помощи микропланшетного ридера Stat Fax-2100 (“Awareness Technology”, США). Анализ каждого образца проводили дважды, полученные значения ОП усредняли. Представление результатов ИФА Результаты ИФА представляли в виде графиков (рис.1) зависимости ОП от концентрации МФ и соответствующих разведений препаратов МФ+ПОЛ. Помимо этого, результаты ИФА представлены как отношение значения ОП для образцов МФ+ПОЛ к значению ОП для МФ (ОПМФ+ПОЛ/ОПМФ), взятых в одинаковых разведениях (табл.1). Условный показатель солюбилизации (УПС) вычисляли как среднее арифметическое двух значений ОПМФ+ПОЛ/ОПМФ, соответствующих максимальным концентрациям белка 10 мкг/мл и 5 мкг/мл. При таких концентрациях значения ОП для МФ и препаратов МФ+ПОЛ близки к выходу на плато (рис.1)
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Целью настоящей работы был подбор амфипатических полимеров, способных солюбилизировать АДРБ1 в форме, пригодной для использования в качестве антигена в прямом твердофазном ИФА. Такой твердофазный ИФА должен служить инструментом для определения аутоантител к АДРБ1в крови пациентов. Поэтому в качестве интегрального критерия эффективности солюбилизации было выбрано максимальное связывание адсорбированных на пластике планшета препаратов МФ+ПОЛ со специфическими рекомбинантными антителами к АДРБ1 по отношению к препарату исходной МФ. Структурные формулы и расшифровка названий использованных в работе полимеров приведены на рисунке S1 дополнительных материалов. Для оценки способности солюбилизировать АДРБ1 каждый из 17 полимеров тестировали испытывали в 4-х концентрациях (вес/объем) : 0,0625%, 0,125%, 0,250% и 0,5%. Результаты ИФА препаратов МФ+ПОЛ представлены на рисунке 1 и в таблице 1. На рисунке 1 приведены типичные кривые зависимости ОП от разведения препаратов МФ и МФ+ПОЛ, характерные для высоких (UltrasoluteTM Amphipol 17), средних (AASTY 11-55) и близких к нулевым показателей эффективности солюбилизации. Как можно видеть, при максимальных концентрациях белка (1 мкг/на лунку и 0,5мкг/на лунку) наблюдается насыщение (кривые выходят на плато). Условный показатель солюбилизации (УПС – среднее арифметическое двух значений ОПМФ+ПОЛ/ОПМФ, соответствующих указанным максимальным концентрациям белка, см. табл. 1), варьировал в широком диапазоне значений в зависимости от типа полимера и его концентрации: от высоких (УПС 87% для UltrasoluteTM Amphipol 17, взятом в концентрации 0.0625%) до близких к нулю (DIBMA 10). Большинство использованных полимеров продемонстрировали обратную зависимость эффективности солюбилизации от их концентрации: при низких концентрациях (0,0625% и 0,125%) адсорбированные препараты МФ+ПОЛ связывали больше специфических антител hAB2367 (УПС до 87%). Исключением оказался DIВМA Glycerol: УПС возрастал при повышении концентрации этого полимера (от 16,5% до 21,5%). Можно предположить, что высокие концентрации полимеров блокируют связывание антител hAB2367 с АДРБ1.
Действительно, наши предварительные эксперименты с использованием метода дот-блоттинга показали, что при концентрации полимеров 2% наблюдалось практически полное подавление связывания препаратов МФ+ПОЛ с антителами (неопубликованные данные). Подобное свойство высоких концентраций амфипатических полимеров описано в литературе: избыток полимера может связываться с представляющим интерес белком и блокировать его функциональную активность [25, 26]. Нельзя исключить и другого объяснения обратной зависимости УПС от концентрации полимера. Так, известно, что повышение концентрации полимера приводит к уменьшению размера получающихся нанодисков [21]. Можно предположить, что слишком маленькие нанодиски не способны полноценно включать молекулу АДРБ1, в результате функциональность (структура) белка нарушается. В работе [27] исследовали эффективность солюбилизации мембранных белков клеток HEK293 с помощью амфипатических полимеров SMALP, DIBMA, AASTY, UltrasoluteTM Amphipol 17 и 18 (“Cube Biotech”) в сравнении с детергентами. Авторы применили «протеомику дробовика» (shotgun proteomics) с использованием жидкостной хроматографии и масс-спектрометрии для анализа состава и общей массы выделяемых белков. Оказалось, что как полимеры, так и детергенты солюбилизируют тем больше мембранных белков (как по составу, так и по количеству), чем выше концентрация солюбилизатора. Следовательно, в нашем случае можно предположить, что более низкие значения УПС при повышенных концентрациях полимеров (0.5% и 0.25%) обусловлены подавлением связывания антител к АДРБ1, в то время как истинная эффективность солюбилизации является высокой. Именно по этой причине мы назвали используемый нами показатель солюбилизации условным. Понятно, что чем выше УПС, тем больше он соответствует истинной солюбилизации. Как видно из данных, приведенных в таблице 1, наибольшую эффективность солюбилизации АДРБ1 демонстрируют полимеры UltrasoluteTM Amphipol 17 (УПС 87%) и UltrasoluteTM Amphipol 18 (УПС 62%), а также AASTY 11-45 (76%), 11-50 (77%) и 6-50 (78.5%). Это наблюдение согласуется с результатами работы [27], где указанные полимеры показали наивысшую способность к солюбилизации мембранных белков клеток HEK293, сопоставимую с таковой для детергентов. Эти полимеры также эффективно солюбилизировали мембранные белки бактерий [28]. Следующими по эффективности солюбилизации АДРБ1 оказались полимеры группы AASTY, затем SMALP, и, наконец, полимеры группы DIBMA. В таблице 2 приведены некоторые характеристики использованных полимеров (молекулярный вес и соотношение гидрофобных/гидрофильных звеньев) и соответствующие максимальные значения УПС. Как можно видеть, на эффективность солюбилизации влияют оба названных параметра, однако каких-либо явных закономерностей зависимости УПС от этих параметров выявить не удается (кроме, возможно, SMALP, см. ниже).
На сегодняшний день в литературе обнаружены только две работы, описывающие получение АДРБ1-содержащих нанодисков [29, 30] с помощью белка MSP. Работ, где для этой цели использовалиамфипатические полимеры, найти не удалось, хотя применение таких полимеров было описано для солюбилизации β2-адренорецептора (АДРБ2), имеющего структуру, сходную с АДРБ1 [31, 32]. В статье [31] описана солюбилизация с помощью DIBMA, а в работе [32] – с помощью SMA. В нашем исследовании значения УПС для DIBMA оказались низкими (табл. 1). Наиболее часто применяемым амфипатическим полимером является SMA, который был с успехом использован для солюбилизации различных рецепторов, связывающих G-белок [33]. Однако в условиях, использованных в нашей работе, полимер SMA (или SMALP согласно обозначению, принятому компанией “Cube Biotech”) продемонстрировал достаточно низкую способность к солюбилизации (УПС составлял от 4% до 26.5% в зависимости от модификации SMALP). Возможно, эффективность солюбилизации АДРБ1 полимерами SMALP определяется соотношением гидрофобных и гидрофильных звеньев. Из данных, представленных в таблице 2, следует, что чем выше содержание гидрофобных звеньев в SMALP, тем выше УПС. Также видно, что полимеры SMALP различаются по молекулярному весу. Согласно опубликованным ранее результатам, размер пустых нанодисков мало зависит от молекулярного веса полимера SMA (и, соответственно, от длины цепи). С другой стороны, показано, что полимеры с меньшей длиной цепи обеспечивают более эффективную солюбилизацию мембран [21]. Тот факт, что в нашей работе более высокие показатели УПС наблюдались в случае полимеров с большей длиной цепи, в которых было выше содержание гидрофобных стирольных звеньев, позволяет предположить, что эффективность солюбилизации АДРБ1 полимерами SMALP определяется именно соотношением гидрофильных и гидрофобных звеньев в полимерной цепи. Необходимо отметить, что настоящая работа является только первым шагом в разработке диагностикума для выявления АДРБ1 АТ. Полученные препараты МФ+ПОЛ не могут быть использованы в качестве антигена для такого диагностикума, поскольку содержат (как и исходный препарат МФ) посторонние мембранные белки. Клеточная линия ADL-7A, которая была использована как источник АДРБ1, была получена путем трансфекции клеток линии HEK293 соответствующей конструкцией. Поскольку данная линия имеет человеческое происхождение, препараты МФ+ПОЛ могут реагировать с аутоантителами к компонентам клеточных мембран, не имеющих отношения к АДРБ1. Следовательно, необходима очистка полученных препаратов от посторонних белков. Оптимальным путем для решения этой задачи представляется использование в качестве источника АДРБ1 клеточной линии, стабильно трансфицированной конструкцией, содержащей АДРБ1 с полигистидиновым тэгом, что позволит осуществить очистку АДРБ1-содержащих нанодисков с помощью афинной хроматографии. ЗАКЛЮЧЕНИЕ Нами впервые продемонстрирована возможность солюбилизации АДРБ1 с помощью амфипатических полимеров в форме, пригодной для использования в качестве антигена в прямом твердофазном ИФА. Протестирована широкая панель различных полимеров и выявлены те из них, которые демонстрируют высокий УПС: UltrasoluteTM Amphipol 17 (87%) и 18 (62%), а также AASTY 11-45 (76%), 11-50 (77%) и 6-50 (78,5%). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ /p> Настоящая работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. БЛАГОДАРНОСТИ Авторы благодарят эксперта лаборатории клеточной инженерии Института экспериментальной кардиологии им. ак. В.Н. Смирнова Национального медицинского исследовательского центра кардиологии им. ак. Е.И.Чазова Слинкина М.А. за критические замечания и помощь в оформлении рукописи. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Минздрава РФ (государственной задание по теме №152 «Разработка метода иммуноферментного анализа для определения аутоантител к β1 –адренорецептору у кардиологических больных с использованием в качестве антигена очищенного рекомбинантного β1-адренорецептора в нативной конформации», рег. № НИОКТР 122020400212-0) и Обществом с ограниченной ответственностью «Мона», (Москва, ОГРН 5087746251896). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00206) на сайте журнала. ЛИТЕРАТУРА
|