|
Модификация пероксинитритом как способ улучшения цитосовместимости гидрогелей на основе альгината натрия
Рязанский государственный медицинский университет имени академика И.П. Павлова, Ключевые слова: альгинат натрия; желатин; пероксинитрит; гидрогель; фибробласты; цитосовместимость. DOI: 10.18097/BMCRM00207 Список принятых сокращений: ALG – альгинат натрия; ALG(2)mALG1(2)G(3) - гидрогель, содержащий 2% альгината натрия, 2% модифицированного альгината натрия №1 и 3% желатина; ALG(2)mALG1(2)G(3)TG - гидрогель, содержащий 2% альгината натрия, 2% модифицированного альгината натрия №1 и 3% желатина, дополнительно обработанный трансглутаминазой; ALG(2)mALG2(2)G(3) - гидрогель, содержащий 2% альгината натрия, 2% модифицированного альгината натрия №2 и 3% желатина; ALG(2)mALG2(2)G(3)TG - гидрогель, содержащий 2% альгината натрия, 2% модифицированного альгината натрия №2 и 3% желатина, дополнительно обработанный трансглутаминазой; ALG(2)G(3) – гидрогель, содержащий 2% альгината натрия и 3% желатина; ALG(2)G(3)TG - гидрогель, содержащий 2% альгината натрия и 3% желатина, дополнительно обработанный трансглутаминазой; G – желатин; mALG1 – образец модифицированного альгината натрия №1; mALG2 – образец модифицированного альгината натрия №2; TG – микробиальная трансглутаминаза ВВЕДЕНИЕ
По данным ВОЗ сердечно-сосудистые заболевания являются основной причиной смертности и инвалидизации человечества. Основным патогенетическим звеном заболеваний сердца и сосудов считается атеросклероз – генерализованный процесс формирования липопротеиновых бляшек в интиме сосудов и их воспаления, приводящий к развитию инфарктов миокарда, инсультов, тромбозов. Несмотря на постоянное развитие методов лечения и профилактики, распространённость сердечно-сосудистых заболеваний растёт. В последнее время данная группа патологий привлекает всё большее внимание специалистов в области регенеративной медицины [1]. Данная наука основывается на применении биоматериалов и технологий клеточного культивирования для создания биоинженерных конструкций, которые могли бы заменить в организме человека органы с нарушенным функционированием или стимулировать процессы регенерации в повреждённых тканях и органах [2, 3]. В качестве биоматериалов в регенеративной медицине применяются, в том числе, гидрогели на основе модифицированных альгинатов натрия [4], получение которых осложняется дороговизной реактивов и трудоёмкостью процесса очистки от избытков цитотоксических реагентов. Цель нашего исследования – испытание окислительной модификации альгината натрия пероксинитритом как активной формой кислорода и азота и оценка перспективы применения химически и химико-ферментативно сшитых гидрогелей на основе данного биополимера для клеточного культивирования. МЕТОДИКА Получение пероксинитрита и оценка чистоты его раствора Раствор пероксинитрита был синтезирован во льду путём добавления к смеси 10 мл 3% (масса/объём) пероксида водорода (“Самарамедпром”, Россия) и 340 мкл 96% (масса/объём) серной кислоты (“Компонент-Реактив”, Россия) моментально 10 мл 1 М раствора нитрита натрия (“Уралхим”, Россия) и 15 мл 2 М раствора гидроксида натрия (“Компонент-реактив”). Для разложения избытка пероксида водорода вносили порошок диоксида марганца (“Югреактив”, Россия), выдерживали до затухания реакции и отфильтровывали осадок. Полученная жидкость представляла собой готовый раствор пероксинитрита, концентрацию которого исследовали спектрофотометрически на спектрофотометре СФ-2000 (“Спектр”, Россия) при длине волны 302 нм (Е302 = 1670 моль-1cм-1). В готовом растворе пероксинитрита определяли примеси непрореагировавших реагентов – пероксида водорода и нитрита натрия. Предварительно в 1 мл аликвоты раствора пероксинитрит разлагали подкислением 0.1 М соляной кислотой (“Химпром”, Россия) до полного обесцвечивания, т.к. в кислой среде пероксинитрит переходит в пероксинитритную кислоту, спонтанно изомеризующуюся в азотную. В полученном растворе пероксид водорода определяли йод-титриметрией: в конической колбе смешивали 1 мл подкисленного раствора пероксинитрита, 3 мл 0.1 М раствора йодида калия (“Югреактив”) и 6 мл дистиллированной воды. Колбу выдерживали при комнатной температуре в тёмном месте 20 мин, затем оттитровывали 1% (масса/объём) раствором тиосульфата натрия (“РеаХимЛаб”, Россия) до бледно-жёлтой окраски, а далее – в присутствии 1% (масса/объём) раствора крахмала до полного обесцвечивания. Анализ выполнялbв трёх повторностях. Нитриты определяли колориметрическим методом: 80 мкл подкисленного раствора пероксинитрита в лунках 96-луночного планшета смешивали с 80 мкл раствора реактива Грисса (“Крезол”, Россия) в 12% (масса/объём) уксусной кислоте (“Компонент-Реактив”), выдерживали 30 мин при 37°C и исследовали оптическую плотность на планшетном ридере StatFax-2100 (“Awareness Technology”, США) в режиме 492/630 нм. Концентрацию нитритов определяли на основании уравнения зависимости оптической плотности от концентрации стандартных растворов нитрита натрия, приготовленных непосредственно перед исследованием. Анализ выполняли в 5 повторностях. Модификация альгината натрия Модификацию альгината натрия раствором пероксинитрита проводили следующим образом: 4 г альгината натрия (ALG) (“Tianjin Hwashin Biotechnology Co. Ltd.”, Китай) помещали в мерные колбы, добавляли смесь раствора пероксинитрита и 95% этанола в соотношении 1:1. Модификацию проводили в течение 20 ч при 37°C, после чего модифицированный альгинат натрия отделяли фильтрованием, трижды промывали 95% этанолом и высушивали. Таким образом получали 2 образца модифицированного альгината: №1 (mALG1) – в присутствии 10 мл пероксинитрит-спиртовой смеси, №2 (mALG2) – при 50 мл смеси. Для подтверждения модификации альгината натрия получали спектры поглощения 0.1% (масса/объём) растворов модифицированных и интактного альгинатов, рН которых предварительно доводили до 7.0-7.1, в диапазоне 180-1000 нм и сравнивали между собой. В случае обнаружения отличий в спектрах проводили анализ на определение в образцах карбонильных, карбоксильных и нитрогрупп. Карбонильные группы определяли гидроксиламинным титрованием: готовили 1% (масса/объём) растворы модифицированного и интактного альгинатов с рН = 6.98-7.02, в конической колбе смешивали 1 мл полученного раствора, 5 мл 5% (масса/объём) раствора хлорида гидроксиламмония (“Крезол”) и 4 мл дистиллированной воды. Через 15 мин инкубации в тёмном месте при комнатной температуре растворы оттитровывали 0.05 М раствором гидроксида натрия в присутствии метилоранжа до жёлтой окраски. Каждое титрование проводили в трёх повторностях. Насыщенность модифицированных образцов альгината натрия карбонильными группами рассчитывали по формуле (1).
Определение карбоксильных групп проводили, основываясь на адсорбции альгинатными гранулами красителя метиленового синего из раствора: по 1 мл 1% растворов модифицированных и интактного альгината натрия по каплям добавляли в 2% (масса/объём) раствор хлорида кальция и выдерживали в течение 15 мин до формирования гранул альгината натрия. Гранулы отфильтровывали от раствора, трижды промывали дистиллированной водой и добавляли 10 мл 0.05% (масса/объём) раствора метиленового синего. Гранулы выдерживали в растворе в течение часа, затем удаляли из раствора и сравнивали оптические плотности опытных растворов с контрольным на спектрофотометре СФ-2000 при длине волны 665 нм. В качестве контроля использовали 0,05% раствор метиленового синего, в который не добавляли гранулы. Насыщенность модифицированных образцов альгината натрия карбоксильными группами рассчитывали по формуле (2).
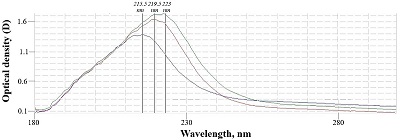
Определение нитрогрупп проводили спектрофотометрически посредством цветной реакции с реактивом Грисса подобно описанному выше. Отличием было предварительное подщелачивание 0,1% растворов модифицированных альгинатов при 50°C в течение 30 мин для перехода нитрогрупп в свободные нитрит-ионы в щелочной среде. Определение нитрогрупп в образце интактного альгината натрия не проводили из-за отсутствия нитрогрупп в его природной химической структуре. Приготовление гидрогелей Для приготовления гидрогелей 2 г каждого образца альгината натрия растворяли в 100 мл физиологического раствора (“СОЛОфарм”, Россия) при 40°C, после чего добавляли 3 г желатина (GEL) (“Sigma-Aldrich”, Германия). К гелям на основе модифицированных альгинатов натрия добавляли также 2 г интактного альгината натрия. Образцы стерилизовали автоклавированием (“Certoclav Essential”, Австрия). Так получали гели ALG(2)G(3), ALG(2)mALG1(2)G(3), ALG(2)mALG2(2)G(3). В условиях ламинарного бокса в 96-луночных планшетах гели в объёме 50 мкл/лунка охлаждали при 4°C для застывания желатиновой составляющей, затем полимеризовали 50 мкл 2% раствора хлорида кальция в течение 15 мин и трижды промывали физиологическим раствором. Ровно половину каждого геля дополнительно полимеризовали раствором микробной трансглутаминазы Streptoverticillium mobaranse (mTG) 300 МЕ/мл (“Biological Co. Ltd”, Китай), которую добавляли в культуральную среду в соотношении 1:1. Таким образом, были дополнительно получены гидрогели ALG(2)G(3)TG, ALG(2)mALG1(2)G(3)TG, ALG(2)mALG2(2)G(3)TG. Каждый из 6 гелей выполняли в 5 повторностях. Клеточное культивирование В качестве экспериментальной культуры использовали первичную культуру фибробластов человека, полученную эксплантационным методом, из банка клеток Центральной научно-исследовательской лаборатории Рязанского государственного медицинского университета. Фибробласты культивировали на поверхности культуральных флаконов площадью 25 см2 (“ПанЭко”, Россия) до состояния монослоя в присутствие базовой среды DMEM/F12, содержащей 10% эмбриональную телячью сыворотку (“Biosera”, Франция) и 1% пенициллин-стрептомицин (“ПанЭко”), в условиях инкубатора при 37°C и 5% CO2. Фибробласты высаживали на поверхность гидрогелей в 96-луночных планшетах (“Corning”, США) в расчёте 20000 клеток/лунка в 100 мкл культуральной среды. Среда для ферментативно сшитых гелей содержала также раствор микробной трансглутаминазы в соотношении 1:1. Рост клеток оценивали путём фазово-контрастной и светлопольной микроскопии при помощи инвертированного микроскопа Olympus CKX53 (“Olympus”, Япония) на 3 день и 7 день культивирования. Оценка жизнеспособности клеток Жизнеспособность фибробластов на поверхности гелей оценивали на 3 день и 7 день культивирования при помощи МТТ-теста: в культуральную среду добавляли 20 мкл 0.5% (масса/объем) раствора МТТ-реактива (“Sigma-Aldrich”) в дистиллированной воде и инкубировали в течение 3 ч. Далее жидкость над гелями заменяли на 100 мкл диметильсульфоксида (“ДИА-М”, Россия). Оптическую плотность растворов считывали на планшетном ридере StatFax 2100 (“Awareness Technology”, США) в режиме 492/630 нм после 30 мин инкубации в шейкере-инкубаторе при 37° C. Статистический анализ Статистический анализ данных проводили в программе SPSS Statistics 23.0. Анализ выборок на нормальность не проводили в виду количества повторностей менее 10, распределение считали ненормальным. Сравнение пары выборок осуществляли критерием Манна-Уитни, множественные сравнения – критерием Краскела-Уоллиса и последующим критерием Манна-Уитни с поправкой Бонферрони. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Нами был получен раствор пероксинитрита с концентрацией 37 мМ, содержащий 1.46% примесей пероксида водорода (0.54 мМ) и 8.37% нитрита натрия (3.1 мМ). Раствор представлял собой прозрачную жидкость жёлтого цвета со слабым образованием пузырьков бесцветного газа на стенках лабораторной посуды. В ходе инкубации альгината натрия с пероксинитритом были получены 2 образца модифицированных альгинатов натрия. Анализ спектров модифицированных альгинатов натрия (рис. 1) показал наличие батохромного сдвига пика с 215.5 нм у интактного образца до 219.5 нм и 223 нм у первого и второго модифицированных образцов соответственно.
Также присутствовал гиперхромный сдвиг с увеличением оптической плотности с 1.4 до 1.65 и 1.72. Учитывая то, что рН и вид растворителя были стандартизированы для всех проб, можно сделать вывод, что изменения в спектрах поглощения вызваны изменением именно химической структуры образцов. Дальнейший анализ модифицированных альгинатов выявил увеличение количества карбонильных, карбоксильных и нитрогрупп, что отражено в таблице 1.
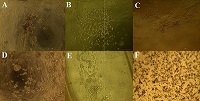
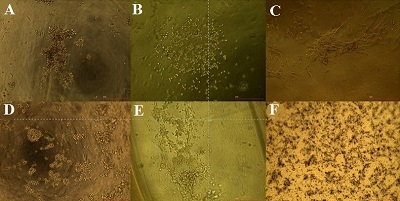
Для изучения влияния степени модификации альгината натрия на адгезию фибробластов человека готовили и сравнивали между собой гидрогели ALG(2)G(3), ALG(2)mALG1(2)G(3), ALG(2)mALG2(2)G(3). На рисунке 2 представлены микрофотографии гидрогелей на 7 день культивирования, отражающие распределение и морфологию клеток.
Исходя из данных микроскопии, можно заметить следующее:
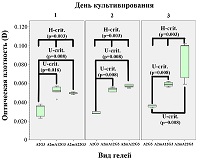
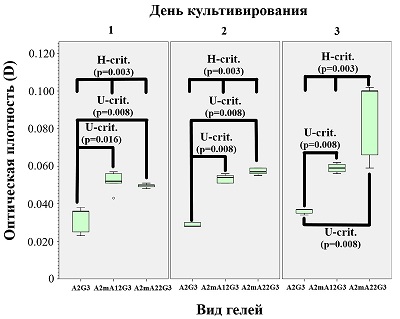
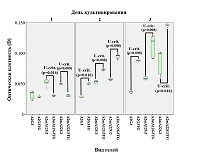
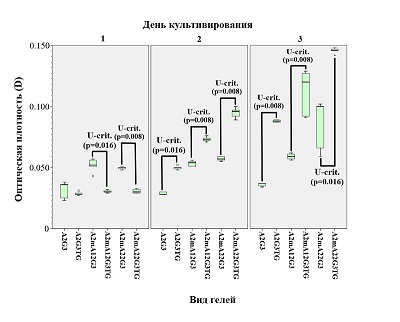
Данные, полученные при микроскопии, в определённой степени подтверждаются МТТ-тестом (рис. 3), который показывает, что на модифицированных гидрогелях фибробласты во все сроки культивирования проявляют большую метаболическую активность, чем на интактном гидрогеле.
Получив данные, свидетельствующие об улучшении метаболической активности клеток в модифицированных альгинатных ионно-сшитых гидрогелях, мы решили получить гидрогели с комбинированной ионно-ферментативной сшивкой. Такие гидрогели имеют большую плотность, а взаимодействие между их цепями за счёт ферментативной сшивки должно теоретически давать больше сайтов для адгезии клеток. В качестве фермента для сшивки гидрогеля нами была выбрана микробная трансглутаминаза. Как видно из рисунка 4, дополнительная сшивка гидрогелей трансглутаминазой не влияет существенно на морфологию клеток на поверхности гидрогеля с интактным альгинатом натрия: они остаются округлой формы и формируют скопления друг с другом. На морфологию фибробластов на поверхности модифицированных гелей дополнительная сшивка трансглутаминазой действует, усиливая адгезивный потенциал скаффолда: увеличивается число вытянутых фибробластов, как и общее число фибробластов. Стоит отметить, что ферментативная сшивка альгинатно-желатиновых гидрогелей приводит к их помутнению, что затрудняет использование рутинных методов микроскопии и вынуждает использовать окраску клеток (в нашем случае, МТТ-реактивом) или иные методы визуализации (например, наборы для live/dead-исследования, предназначенные для флуоресцентной микроскопии).
Данные МТТ-теста (рис. 5) показывают, что дополнительная сшивка гидрогелей трансглутаминазой способна снижать метаболическую активность клеток в первые сутки культивирования (возможно, на ещё не прикрепившиеся фибробласты трансглутаминаза действует токсически), однако, уже начиная с 3 дня и далее, метаболическая активность фибробластов на комбинированно сшитых гидрогелях значимо возрастает в сравнении со сшитыми лишь ионами Ca2+.
Проблема создания биоинженерных скаффолдов является критически важной для регенеративной медицины. Согласно стандартам Good Manufacture Practice (GMP) [5], биоматериалы должны обладать свойствами биосовместимости, гемосовместимости и биодеградации. В настоящее время в качестве сырья для получения биомедицинских изделий рассматривается множество полимеров, как природных, так и искусственных [6]. Одним из таких соединений является альгинат натрия – полисахарид бурых водорослей, натриевая соль альгиновой кислоты, мономерами которой являются остатки глюкуроновой и маннуроновой кислот. Различное соотношение звеньев гулуроната и маннуроната натрия в полимерной цепи определяет неоднородность физико-химических свойств (вязкости, растворимости, степени связывания ионов кальция) у образцов альгината натрия, полученных от различных источников. Это объясняет некоторое снижение посвящённой альгинатам публикационной активности, хотя этот материал прочно занял свою нишу, например, в биопринтинге [7, 8]. Достоинствами альгината натрия являются отсутствие цитотоксичности, дозозависимое изменение вязкости растворов, тиксотропия, возможность химической сшивки под действием двух- и трёхвалентных катионов, поддержание приданной сшитым гидрогелям формы. Однако данный полимер обладает и рядом недостатков: трудно прогнозируемой и сильно зависящей от окружающих условий биодеградацией, отсутствием сайтов адгезии для клеток и для прочных взаимодействий с адгезивными молекулами (RGD-пептидом, поли-L-лизином, коллагеном, желатином и др.), относительной химической инертностью, ограничивающей ремоделирование клетками биоинженерных скаффолдов на основе нативного альгината натрия. Для решения перечисленных проблем было предложено несколько методов модификации альгината натрия, наиболее популярным из которых стало окисление периодатом натрия [9-11]. Данный реактив позволяет селективно внести в мономерные звенья карбонильные группировки в положении С3 и С4 за счёт разрыва пиранозного кольца. Получаемый окисленный альгинат натрия способен ковалентно связываться с пептидными соединениями через образование Шиффовых оснований, что улучшает адгезивные свойства гидрогелей. Ещё одним плюсом такого подхода является очень низкая степень разрыва 1,4-гликозидных связей, что позволяет сохранить целостность полимерной цепи и не снижать чрезмерно вязкость растворов альгината натрия. Однако, у данного метода есть и свои недостатки, основными из которых являются дороговизна реактивов, необходимость длительной и тщательной очистки образующегося полимера от токсичных для клеток реагентов и возможность внесения в структуру молекулы альгината лишь карбонильных группировок, что ограничивает реакционный потенциал получаемого вещества. Мы предложили способ модификации альгината натрия активной формой кислорода и азота – пероксинитритом. Данный подход уступает периодатному окислению по своей специфичности (т.к. активные формы кислорода и азота значительно расщепляют молекулы полисахаридов за счёт диссоциации 1,4-гликозидных связей) и стандартизируемости (за счёт сложности получения растворов пероксинитрита фиксированной концентрации), но имеет свои преимущества: отсутствие дорогих реактивов, простота проведения модификации альгината натрия и, самое главное, возможность внесения в полимер различных функциональных групп (как карбонильных, так и карбоксильных и нитрогрупп), что потенциально повышает реакционную способность вещества и адгезивность получаемых на его основе гидрогелей. Как видно из результатов работы, степень модификации альгината натрия пероксинитритом значительно улучшает цитосовместимость и адгезивность биополимерных гидрогелей на основе альгината натрия и желатина, особенно в совокупности с ферментативной сшивкой трансглутаминазой. Важным является отсутствие цитотоксического действия у полученных в результате модификации гидрогелей. Полученные нами результаты говорят о том, что гидрогели на основе модифицированного пероксинитритом альгината натрия и желатина могут быть перспективным материалом для 3D-культивирования клеток и возможного получения биоинженерных скаффолдов из них. ЗАКЛЮЧЕНИЕ Таким образом, нами предложена методика модификации альгината натрия пероксинитритом, позволяющая внести в молекулу полимера карбонильные, карбоксильные и нитрогруппы. Полученные ионно- и ионно-ферментно сшитые гидрогели на основе модифицированного альгината натрия и желатина проявляют удовлетворительные адгезивные свойства и не снижают метаболическую активность фибробластов на своей поверхности. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит описания каких-либо исследований с участием людей или использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Исследование не имело дополнительных внешних источников финансирования. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|