|
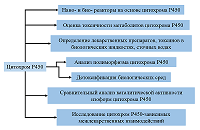
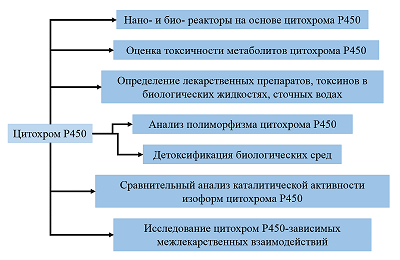
Сравнительный анализ биоэлектрокаталитических систем, содержащих цитохром Р450 3А4 Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, ул. Погодинская, 10 стр. 8, Москва, 119121; *e-mail: viktoria.shumyantseva@ibmc.msk.ru Ключевые слова:электроанализ; лекарственные препараты; цитохром Р450 3А4; биореактор; ферментативный катализ; электроферментативные системы; флавиновые нуклеотиды; бактосомы DOI: 10.18097/BMCRM00210 ВВЕДЕНИЕ Цитохромы P450 (CYP) – обширное семейство ферментов, относящихся к классу оксидоредуктаз и катализирующих монооксигеназные реакции (рис. 1). Основной функцией CYP является метаболизм эндогенных и экзогенных соединений. Лекарственные препараты, токсические соединения, компоненты пищевых добавок или же продуктов питания при попадании в организм подвергаются I фазе биотрансформации благодаря реакциям, катализируемым цитохромами P450. С этой точки зрения цитохромы Р450 являются аналогами антител, нейтрализующих низкомолекулярные токсичные соединения. Реакции, характерные для CYP, являются по механизму действия бисубстратными, так как в каталитическом акте принимает участие органический субстрат и молекулярный кислород. CYP катализируют различные типы химических реакций: гидроксилирование насыщенного атома углерода, O-, S-, N-деалкилирование, эпоксидирование, сульфоокисление, дезаминирование, дегалогенирование [1]. Такие реакции приводят к образованию более полярного, по сравнению с субстратом, продукта реакции, способствуя протеканию реакций II фазы биотрансформации с участием ферментов «второй линии защиты», таких как N-ацетилтрансферазы, глутатион-S-трансферазы, глюкуронозилтрансферазы, эпоксидгидролазы и метилтрансферазы. Окисление лекарственного препарата, осуществляемое при участии изоферментов цитохрома Р450, может приводить к снижению, инактивации или изменению фармакологических свойств лекарственного препарата, или наоборот, повышать его фармакологические свойства. CYP 3A4 (CYP3A4) участвует в метаболизме примерно 50% всех лекарственных препаратов и ряда эндогенных биологически активных соединений, к числу которых относятся, например, стероидные гормоны. CYP являются потенциальными биореакторами для получения соединений, которые сложно получить химическим синтезом вследствие стереонаправленности реакций. Одним из примеров применения CYP в качестве биореакторов на промышленном уровне является синтез правастатина – ингибитора 3β-гидрокси-3-метилглутарил-КоА (HMG-CoA) редуктазы, которая является ферментом, контролирующим биосинтез холестерина. Правастатин был синтезирован компанией “Daiichi-Sankyo” (Япония) из соединения компактина, гидроксилирование которого в положении C6 осуществляется с использованием бактериального фермента CYP105A3 (P450sca2) из Streptomyces carbophilus в процессе. Такие биореакторы разработаны с использованием дополнительных редокс белков-партнеров, NADPH как донора электронов и системы, регенерирующей NADPH [2]. Синтетические возможности CYP в качестве биореакторов реализованы только на единичных примерах. Препятствием для создания таких биореакторов является сложность организации CYP-систем: необходимость участия белков редокс партнеров (редуктаза, цитохрома b5, адренодоксины, флаводоксины), необходимость использования в качестве донора электронов дорогостоящего реагента NADPH, а также регенерирующей системы (например, глюкозо-6-фосфат-дегидрогеназы как дополнительного фермента), несопряженность каталитического цикла, что приводит к низкому практическому выходу метаболита, часто низкая растворимость органических соединений в водных растворах [1, 3-6].
Электрохимическое восстановление CYP может служит адекватной заменой природным донорам электронов NADPH или NADH [9-11]. Такой подход является технологичным, что может проецироваться на создание биореакторов для электроферментативного синтеза метаболитов, для исследования их токсичности, для моделирования метаболизма ксенобиотиков [12]. Ранее были разработаны методы прямого электрохимического восстановления этого класса гемопротеинов без использования дополнительных медиаторов [10, 11], что позволило эффективно применять CYP-электроды для поиска новых субстратов, ингибиторов, активаторов, модуляторов CYP, а также для исследования межлекарственных взаимодействий [5, 11, 12]. Для разработки экспериментальных подходов с целью повышения каталитической активности электрохимических CYP-систем и сравнения результатов, полученных в разных каталитических системах, были исследованы электрохимические и электрокаталитические параметры CYP3A4 и маркерного субстрата – антибиотика группы макролидов эритромицина. В настоящей статье описаны алгоритмы, разработанные для повышения электроферментативной активности CYP. МАТЕРИАЛЫ И МЕТОДЫ Электрохимические измерения проводили с использованием потенциостата PGSTAT 12 Autolab, (“Metrohm Autolab Ins.”, Нидерланды) с программным обеспечением GPES, (версия 4.9.7) и PGSTAT 312N Autolab с программным обеспечением NOVA (версия 2.0). В работе использовали трехконтактные электроды, получаемые методом трафаретной печати (ПГЭ) (“КолорЭлектроникс”, Россия) с графитовыми рабочим и вспомогательным электродами и хлоридсеребряным электродом сравнения. Диаметр рабочего электрода составлял 0.2 см (площадь 0.0314 см2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (отн. Ag/AgCl). В работе были использованы следующие реактивы: ацетат аммония (“Sigma-Aldrich”, США), ацетилацетон (“Fluka”, Швейцария), гидроксид калия (“Спектр-Хим”, Россия) дигидрофосфат калия (“Спектр-Хим”), дидодецилдиметиламмония бромид (“Sigma-Aldrich”), эритромицин (“Sigma-Aldrich”), уксусная кислота (“Fisher Scientific”, США), хлорид натрия (“Спектр-Хим”), хлороформ (“Sigma-Aldrich”), рибофлавин (“Sigma-Aldrich”), флавинаденинмононуклеотид (FMN) (“Фармстандарт”, Россия), флавинадениндинуклеотид (FAD) (“Fluka”), стрептолизин О из Streptococcus pyogenes (“Sigma-Aldrich”), бактосомы, содержащие CYP3A4 (концентрация CYP3A4 4 мМ), CYP-зависимую редуктазу человека и цитохромом b5 (CYP3A4BR) в Трис-ацетатном буфере (pH 7.6), содержащем 250 мМ сахарозы, 0.025 ЭДТА (“Cypex Ltd”, Великобритания). Рекомбинантный CYP3A4 в 550 мМ калий-фосфатном буфере, рН 7.2, содержащем 0.2% CHAPS, 1 мМ дитиотреитол и 20% глицерин (по объёму), получен и выделен по методике, подробно описанной в работе [13] и предоставлен А.А. Гилепом (Институт биомедицинской химии). Концентрацию фермента (142 мкМ) определяли спектрофотометрически по образованию комплекса восстановленной формы гемопротеина с монооксидом углерода; коэффициент поглощения ε450-490 = 91 мМ-1см-1 [14]. Чистоту препарата контролировали электрофорезом в ПААГ. Для модификации ПГЭ на рабочую поверхность электрода наносили 1 мкл 0.1 М дидодецилдиметиаммоний бромида (ДДАБ) в хлороформе, после испарения хлороформа на электрод наносили 1 мкл 142 мкМ CYP3A4. Для иммобилизации нековалентного комплекса CYP3A4 c рибофлавином, FMN и FAD, растворы флавиновых нуклеотидов и CYP3A4 смешивали в эквимолярных концентрациях, инкубировали 5 мин и наносили на поверхность ПГЭ, модифицированную ДДАБ (ПГЭ/ДДАБ). В качестве трехмерного пористого материала были использованы мембраны из анодного оксида алюминия, содержащие сонаправленные поры диаметром 0.1 мкм (Anodisc 13, Whatman™, “Cytiva”, США) и 0.2 мкм (Anodisc 13, Whatman™, “Cytiva”). На рабочий электрод, модифицированный ДДАБ (ПГЭ/ДДАБ), помещали мембраны с диаметром, соответствующим диаметру рабочего электрода. Иммобилизацию фермента проводили по методике, описанной выше. Для модификации электрода порообразующим белком стрептолизином O на ПГЭ/ДДАБ наносили 1 мкл предварительно проинкубированной в течение 30 мин смеси равных объемов 4 мг/мл стрептолизина O и 10 мМ DL-дитиотреитола. После полного высыхания предыдущего слоя наносили 1 мкл 142 мкМ CYP3A4. Для иммобилизации бактосом, содержащих CYP3A4 (CYP3A4BR), 2 мкл CYP3A4BR наносили на электроды, модифицированные ДДАБ (ПГЭ/ДДАБ) по методике, описанной выше. Для всех типов модификаций для иммобилизации фермента электроды оставляли при 4°С на 12 ч во влажной камере для предотвращения дегидратации фермент-содержащего слоя на поверхности рабочего электрода. Для оценки эффективности электрокатализа CYP3A4 проводили электролиз в присутствии 100 мкМ эритромицина в течение 20 мин при рабочем потенциале Е= -0.5 В (отн. Ag/AgCl). Полученный после электролиза раствор, содержащий непрореагировавший субстрат эритромицин и метаболиты электроферментативной реакции, смешивали в равных пропорциях с реактивом Nash и спектрофотометрически при длине волны 240 нм определяли концентрацию формальдегида как основного продукта реакции N-деметилирования эритромицина [15]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Электроферментативные системы на основе CYP 3А4 CYP обладают сложным и многостадийным каталитическим циклом, в котором участвуют ряд белков редокс-партнеров, таких как ферредоксины, адренодоксины, NADPH-зависимая CYP редуктаза, цитохром b5. Использование электрохимических систем позволяет сократить многостадийный процесс, поставляя электроны непосредственно к гему как основному каталитическому центру цитохрома P450. Кроме того, электрохимические системы на основе цитохрома P450 обладают рядом преимуществ по сравнению с другими подходами для создания биосенсоров и биореакторов:
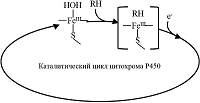
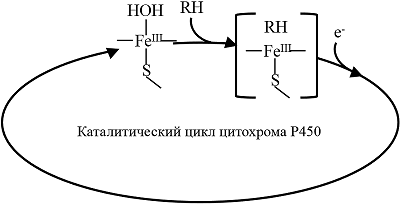
Перечисленные выше преимущества электрохимических систем цитохрома P450 делают их эффективным инструментом для поиска субстратов и ингибиторов CYP, для анализа возможных межлекарственных взаимодействий, а также для создания эффективных электроферментативных каталитических систем для получения продуктов реакций, катализируемых цитохромами P450. Модификация рабочей электродной поверхности Для создания биосенсора на основе цитохрома P450 необходимо создать систему, обеспечивающую сохранение каталитических свойств фермента, способствующих протеканию электрохимической реакции. Для иммобилизации CYP на поверхности электродов разработаны различные подходы, использующие наноматериалы и модификаторы, обеспечивающие сохранение нативной конформации и каталитических свойств фермента [10-12, 16, 17]. Разработан метод эффективной иммобилизации CYP3A4 с использованием электродов, получаемых методом трафаретной печати (печатные электроды) с графитовым рабочим электродом, модифицированным липидоподобным соединением дидодецилдиметиламмоний бромидом (ДДАБ), моделирующим мембранное микроокружение ферментов. Такой тип электродов был применен для исследования межлекарственных взаимодействий в системах омепразол/эритромицин, абиратерон/эритромицин, диклофенак/эритромицин, кортизол/эритромицин, кетоконазол/абиратерон [18-25]. Кроме модификаторов на основе ДДАБ, для иммобилизации CYP нами были использованы золотые наночастицы, а также дисперсии углеродных нанотрубок, стабилизированных различными полимерными композициями [26, 27]. Каталитический механизм функционирования CYP как основа для создания эффективных биореакторов. Образование продуктивного фермент-субстратного комплекса Особенностью каталитического цикла CYP является многостадийность процесса. Первая стадия в катализе этого класса гемопротеинов – образование комплекса ферри-формы FeIII с субстратом (FeIII-RH). Электроны начинают участвовать в каталитическом процессе только после образования фермент-субстратного комплекса [19]. Перенос первого электрона приводит к образованию комплекса восстановленной ферро-формы FeII с субстратом, а затем и с кислородом в качестве второго субстрата [16, 28-30] (рис. 2).
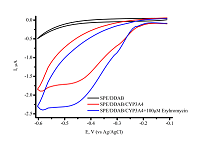
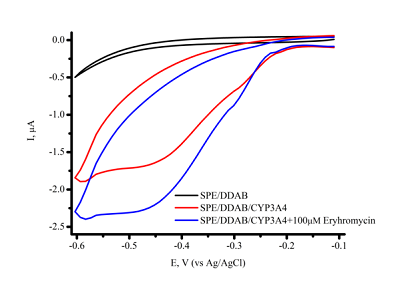
Электрохимические процессы CYP-зависимых реакций характеризуются режимом тонкой пленки белка (сорбционный режим) на поверхности электрода. Эти процессы не являются диффузионно-контролируемыми, что проявляется в линейной зависимости максимальной амплитуды анодного и катодного тока от скорости сканирования, как было показано ранее [1, 10, 33]. Количественные закономерности электрохимических методов позволяют оценить количество электроактивного фермента на электроде для адекватного расчета кинетических параметров электроферментативной реакции (рис. 3) [10, 11, 33]. Для фермента, иммобилизованного (ковалентно или нековалентно) на электроде или включенного в матрицу модификатора, образование фермент-субстратного комплекса может потребовать больше времени за счет диффузии субстрата к активному центру фермента. Нами был предложен подход, при котором первой стадией электрокатализа была не стадия восстановления иона железа гема, а именно стадия образования фермент-субстратного комплекса для дальнейшей продуктивной работы системы. Предварительная инкубация CYP 3А4, нековалентно иммобилизованного на электроде за счет включения в матрицу ДДАБ с субстратом (антибиотиком группы макролидов эритромицином) до стадии получения электронов, положительно влияла на каталитические функции фермента [32]. Выход продукта реакции N-деметилирования эритромицина - формальдегида, возрос в 1.46 раза, а максимальная скорость реакции увеличилась с 9.21 × 10–11 M/мин до 1.40 × 10–10 M/мин. Флавиновые нуклеотиды как диффузионные медиаторы переноса электронов и низкомолекулярные модели NADPH-зависимой CYP редуктазы Флавиновые нуклеотиды являются кофакторами редуктаз – белков редокс-партнеров CYP – и, соответственно, посредниками в передаче электронов между восстановительным эквивалентом NADPH и CYP, согласно общепринятой схеме электронного транспорта [32]. Для моделирования классической электрон-транспортной схемы на электроде были использованы различные подходы, основанные на образовании комплексов или на включении флавиновых кофакторов или флавин-содержащих доменов в структуру CYP в роли диффузионных медиаторов переноса электронов.
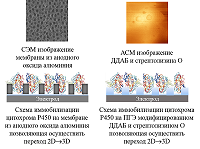
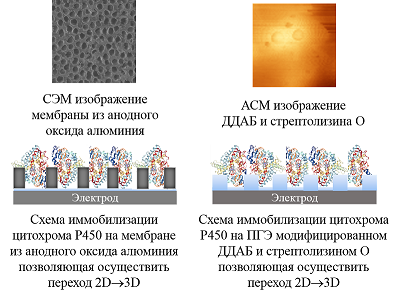
Была исследована электрохимическая система, в которой нековалентный комплекс CYP3A4 с рибофлавином, FMN или FAD был иммобилизован на электроде [32]. Флавиновые нуклеотиды, как низкомолекулярные модели редуктазы, являются медиаторами электронного транспорта, способствуя эффективному восстановлению иона железа гема. При использовании флавиновых нуклеотидов в качестве низкомолекулярных моделей редуктазы удалось достичь улучшения электрохимических характеристик системы, таких как электроактивная концентрация фермента, а также рост такого параметра, как каталитический ток в присутствии субстрата, который является одной из важнейших характеристик эффективности электрокатализа. Каталитическая активность CYP 3А4-зависимой реакции N-деметилирования эритромицина возросла в 1.3, 1.7 и 2.1 раза в системе с рибофлавином, FAD и FMN соответственно. Максимальная скорость реакции для системы без флавинов, составила 9.21 × 10–11 М/мин, 1.24 × 10–10 М/мин – в случае рибофлавина, 1.57 × 10–10 М/мин и 1.87 × 10–10 М/мин для FAD и FMN соответственно [32]. Модификация поверхности электродов трехмерными структурами для включения фермента в ограниченный объем и перехода от 2D- к 3D-режиму. Электроды, применяемые в биоэлектрохимии, как правило, представляют собой плоские структуры. Для эффективного электронного транспорта к активному центру фермента требуется иммобилизация белка на рабочей поверхности электрода. При этом существует проблема взаимодействия белка с «твердыми» 2D-поверхностями [34], что может приводит к изменению третичной и четвертичной структуры белка, влияющей на каталитическую активность. Для преодоления плоскостной структуры электродов был предложен алгоритм модификации поверхности электрода нанопористыми неорганическими или органическими (порообразующие белки) компонентами. В качестве неорганических структур использовались материалы на основе мезопористого оксида кремния, оксида алюминия, оксида титана, мезопористого графена, оксида олова, допированного индием (indium doped tin oxide, (ITO) [35-41]. Применение нанопористых материалов для электрохимического изучения ферментативных реакций обеспечивает переход электродной поверхности от 2D- к 3D-режиму, способствует более упорядоченному расположению белка на электроде, а также повышению локальной концентрации фермента в нанопорах, что выражается в увеличении эффективности электроферментативных реакций [36, 39, 41, 42]. В качестве нанопористых материалов могут использоваться структуры, обладающие следующими свойствами: химическая инертность, биосовместимость, электрохимическая нейтральность при сохранении электронтранспортных и проводящих свойств электрода. Проведение ферментативных реакций в «замкнутых» пространствах (нанопорах, наноканалах, мицеллах, обращенных мицеллах) позволяет смоделировать микроокружение ферментов и их молекулярную скученность («краудинг») в биологических системах, где ферменты находятся в высоких концентрациях в ограниченных объемах [39, 42, 43]. Такие подходы перспективны для создания нанореакторов на основе ферментов, каскадов ферментативных реакций и ансамблей ферментов [44]. Нами была разработана система, в которой в качестве нанопористого материала использовался анодный оксид алюминия для модификации поверхности электрода (рис. 5).
Совмещение двух подходов – создание мембраноподобного слоя и иммобилизация цитохрома P450 3А4 в замкнутом пространстве, моделирующим краудинг-эффект – было реализовано нами в работе [46]. Для этого был использован липидоподобный модификатор электрода ДДАБ и мембранный белок стрептолизин O (рис. 5). При послойном нанесении на электрод ДДАБ, а затем стрептолизина O в мембранной пленке, образованной ДДАБ, наблюдалось появление полостей, визуализируемых на изображениях, полученных с помощью атомно-силовой микроскопии (АСМ). Данный подход позволил зарегистрировать увеличение каталитического тока CYP 3А4 в присутствии субстрата эритромицина в 2 раза (с 0.6 мкА до 1 мкА) и повысить эффективность электрокатализа реакции N-деметилирования эритромицина в 2.97 раза [47]. Микросомы как активные биотрансформирующие системы. Иммобилизация микросом на электроде Электрон-транспортный путь в CYP-системах реализуется с помощью белков-партнеров [28, 31]. Поэтому использование наиболее близких к природным системам конструкций является эффективных путем для повышения каталитических свойств биокатализаторов. Микросомы представляют собой морфологически замкнутые везикулы, содержащие компоненты CYP-монооксигеназной системы, которые образуются из эндоплазматического ретикулума при гомогенизации ткани [47-52]. Микросомы печени, содержащие CYP и их редокс-партнеры (CPR и цитохром b5) используются как источник ферментов CYP для анализа токсичности in vitro и разработки новых лекарственных препаратов. Основным преимуществом использования микросом является сохранение стабильности структуры фермента и каталитической активности за счет микроокружения, которое не изменяется после выделения микросомальной фракции. Кроме того, белки редокс-партнеры также способствуют повышению скорости переноса электронов от электрода к активному центру CYP [53]. Однако использование собственно микросом человека и животных имеет этические проблемы. С развитием методических подходов молекулярной биологии и технологий экспрессирования белков стала доступна коэкспрессия в культурах клеток, инфицированных рекомбинантными бакуловирусами, или в бактериальных клетках одновременно CYP, редуктазы и цитохрома b5. Получаемые данным методом биологические материалы коммерчески доступны и реализуются под названиями бактосомы (BactosomesTM, компания «Cypex»), суперсомы (SupersomesTM, «Gen Test») или бакулосомы (BaculosomesTM, «ThermoFisher») [49, 54]. Для иммобилизации бактосом, содержащих CYP3A4, были применены электроды, модифицированные ДДАБ. В присутствии субстрата эритромицина регистрируется каталитический ток, что свидетельствует об активности и взаимодействии ключевого фермента CYP3A4 с субстратом (табл. 1). Бактосомы продемонстрировали высокую скорость электроферментативных реакций по отношению к эритромицину. Были получены следующие значения максимальной скорости электрохимической реакции 2.34±0.48×10-10 М/мин для электрода с иммобилизованными бактосомами, содержащими CYP3A4, и 1.52±0.34×10-10 М/мин для электрода с иммобилизованным CYP3A4.
ЗАКЛЮЧЕНИЕ В данной работе представлены разработанные нами подходы расширения области применения CYP не только в качестве биосенсоров для поиска субстрат-ингибиторного потенциала этого класса гемопротеинов, но и для реализации электроферментативных систем в качестве биореакторов. Использование CYP 3A4 в комплексе с флавиновыми нуклеотидами как низкомолекулярной модели редуктазы, модификация электродов нанопоровыми материалами, иммобилизация CYP 3А4-бактосом на электродах, способствует повышению каталитической активности. Образование фермент-субстратного комплекса на электроде как первой стадии электроферментативной реакции также дает в результате повышение каталитической активности системы. Включение ферментов в неорганические (анодный оксид алюминия) и органические (стрептолизин О) нанопоры также приводит к улучшения как электроаналитических, так и электрокаталитических характеристик системы. Функционирование ферментов в режиме «структурного краудинга» за счет концентрирования фермента в нанопорах является существенным фактором для перевода фермента в режим биореактора и для повышения выхода продукта реакции. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период 2021 - 2030 годы (№122030100168-2). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|