|
Изменение метаболизма фукозосодержащих биополимеров в тканях желудочно-кишечного тракта крыс при иммобилизационном стрессе
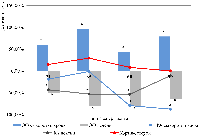
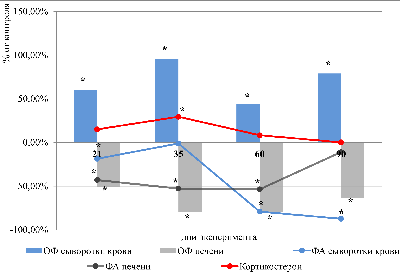
Ижевская государственная медицинская академия, 426034, Ижевск, ул. Коммунаров, 281; Ключевые слова: иммобилизационный стресс; фукозосодержащие биополимеры; ткани печени, желудка, тонкой кишки DOI: 10.18097/BMCRM00214 ВВЕДЕНИЕ На сегодняшний день роль стресса как фактора этиологии и патогенеза нарушений различных функций организма человека представляет особый интерес для врачей-специалистов различных областей. В основе характерных повреждений, развивающихся в результате стрессорных воздействий, лежат вегетативные и гуморальные нарушения, которые выражаются в сдвигах в тканевом метаболизме [1]. Известно, что стресс стимулирует активацию гипоталамо-гипофизарно-надпочечниковой системы. В аденогипофизе на фоне повышенной выработки адренокортикотропного гормона резко снижается выделение соматотропного, тиреотропного, гонадотропного гормона, следствием которого являются понижение активности щитовидной, половых и других желез внутренней секреции, а также угнетение тимуса, селезенки и лимфоидной ткани. На почве угнетения центральных и периферических органов иммунитета снижается активность антигенчувствительных и эффекторных клеток. В крови повышается содержание нейтрофилов со сдвигом ядра влево, снижается количество эозинофилов, уменьшается число и активность лимфоцитов. В итоге развивается так называемый вторичный иммунодефицит [2]. Кроме того, гипертрофия надпочечников вызывает резкое повышение уровня глюкокортикоидных гормонов, угнетающих процессы пролиферации клеток и синтеза биополимеров соединительной ткани, являющейся важнейшим компонентом межклеточного матрикса, в том числе и желудочно-кишечного тракта [3, 4]. Защитные свойства слизистого секрета органов желудочно-кишечного тракта определяются наличием в его составе гликопротеинов [5]. Гликопротеины – это сложные белки, состоящие из 85% белков и 15% углеводов. Их углеводный компонент — это олигосахарид, состоящий 10-15 мономерных единиц (минорных моносахаридов), одним из которых является L-фукоза. На конце олигосахаридов имеется еще одно производное моносахаридов: сиаловые кислоты (ацильные производные нейраминовой кислоты). При этом сиаловые кислоты в наибольшей степени обеспечивают гидрофильность и связывание воды к белкам, а остатки фукозы создают гидрофобные участки в молекуле. Последние могут обеспечить фиксацию гликопротеинов к гидрофобным участкам мембран эпителиоцитов желудка. Кроме того, фукоза может оказывать пребиотическое действие и поддерживает нормальную микрофлору желудочно-кишечного тракта [6, 7]. По результатам проведенных ранее исследований известно, что при обострении эрозивного гастродуоденита в биологических жидкостях изменяется содержание фракций сиаловых кислот и фукозы, с максимальным их ростом в желудочном соке, что обуславливает дестабилизацию защитных функций слизистых оболочек [8]. Изменения защитных компонентов слизистых оболочек органов желудочно-кишечного тракта при стрессорных воздействиях изучены недостаточно и особую значимость представляют исследования по моделированию иммобилизационного стресса у экспериментальных животных, позволяющих определить особенности обмена фукозосодержащих биополимеров в тканях желудочно-кишечного тракта. Цель исследования – установить изменение метаболизма фукозосодержащих биополимеров в тканях желудочно-кишечного тракта экспериментальных животных при иммобилизационном стрессе. МЕТОДИКА Эксперименты были проведены на 32 взрослых белых беспородных крысах-самцах массой 180-230 г. Иммобилизационный стресс (ИС) у животных вызывали путем их ежедневной двухчасовой фиксации на спине на специальных досках в течение 45 дней [2]. Животные находились на обычном рационе вивария со свободным доступом к воде. Смоделированную стрессовую реакцию определяли по изменению содержания кортикостерона в сыворотке крови иммуноферментным методом с использованием набора Corticosterone ELISA («LDN», Германия). Обмен фукозосодержащих биополимеров в крови, гомогенатах печени, мукозной оболочке и стенке желудка и тонкой кишки оценивали на 21, 35, 60 и 90 дни. В указанные дни животных декапитировали под кратковременным эфирным наркозом. Учитывая циркадные ритмы выработки надпочечниками гормонов, забор материала производили в одно и то же время суток — 12 ч дня. В сыворотке крови, в слизистой оболочке и стенке желудка и тонкого кишечника, а также гомогенатах печени определяли общее количество фукозы (ОФ) с использованием 3% раствора солянокислого цистеина по методу Дише в модификации Шараева [8] и фукозидазную активность (ФА) по методу Е.М. Бейер и соавт. в модификации П.Н. Шараева и соавт. [8]. В качестве контрольных значений были использованы данные, полученные нами ранее [3] для группы из 8 животных, не подвергавшихся иммобилизационному стрессу. Статистическую обработку данных, полученных в ходе проведенных опытов, проводили непараметрическими методами оценки с использованием программ MicrosoftExcel и Statistica 6.0. В группах выборки оценивали значения медианы, нижний и верхний квартили. Определение значимости различий полученных данных (р) в сравниваемых выборках проводили по критерию Манна-Уитни. Различия между показателями считали статистически значимыми при p <0.05. Коэффициент корреляции (r) для пар вариант считали по формуле Спирмена с достоверностью p <0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Уровень кортикостерона в сыворотке крови иммобилизованных животных возрастал относительно контроля на 35 день на 29.5% (р=0.0037); в остальные дни наблюдения уровень гормона практически не изменялся. На протяжении всего эксперимента в сыворотке крови иммобилизованных животных наблюдался рост концентрации фукозы с наибольшим их количеством на 35 и 90 дни (158 мг/л и 144.8 мг/л соответственно, что на 95.5% (р=0.0009) и 79% (р=0.0009) выше контроля). При этом активность фукозидазы достоверно снижалась, достигая максимума на 90 день наблюдения (87.3% (р=0.0009) ниже контрольных значений). Одновременно вышеописанный показатель имел отрицательную корреляционную связь с концентрацией кортикостерона на 90 день (r=-0.8; p=0.017) (рис. 1). рреляции (r) для пар вариант считали по формуле Спирмена с достоверностью p <0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В гомогенатах печени иммобилизованных животных содержание фукозы снижалось в течение всего эксперимента с наибольшими изменениями на 35 и 60 дни опыта (79.5 % (р=0.0009) и 79.3 % (р=0.0009) соответственно) относительно показателей контрольных животных. Параллельно с этим фукозидазная активность с 21 по 60 дни достоверно уменьшалась, а к 90 суткам приближалась к контролю. Между показателями уровня кортикостерона сыворотки крови животных и ОФ в гомогенатах исследуемой ткани выявлена сильная положительная корреляционная связь на 35 и 60 день (r=0.8; p=0.017). В мукозном слое желудка иммобилизованных животных было выявлено значимое cнижение ОФ на 21, 60 и 90 дни наблюдения (на 75.7% (р=0.0009), 61,4% (р=0.0009) и 57.1% (р=0.002) соответственно) относительно группы сравнения, а также имела место выраженная корреляционная связь между показателями глюкозы и кортикостерона на 90 день (r=0.8; p=0.017). Активность ферментов, разрушающих фукогликопротеины, к 21 дню резко уменьшалась (на 54.7%, р=0.02), а к 35 дню повышалась (на 85,4%, р=0,0009) и затем приближалась к контрольным значениямю В то же время отмечена сильная отрицательная корреляционная связь между ФА и ОФ к 21 дню (r=-0.8; p=0.017). В стенке желудка иммобилизованных животных статистически значимое снижение количества ОФ было выявлено только на 60 сутки (на 75% (р=0.0009) относительно контроля), а в остальные дни наблюдения показатель практически не изменялся. При этом ФА достоверно не изменялась на протяжении всего эксперимента. В интестинальной слизи иммобилизованных животных уровень ОФ изменялся фазно: на 21 день снижался на 61% (р=0.0009), на 35 сутки возрастал на 34.6% (р=0.013), а на 60 и 90 дни вновь уменьшался на 30% (р=0.006) и 34% (р=0.002) соответственно относительно контрольных значений. ФА достоверно возрастала на 35 и 60 дни (145.5% (p=0.0009) и 57.6% (p=0.002) соответственно) в сравнении с группой контрольных животных. В стенке тонкой кишки иммобилизованных животных уровень ОФ достоверно уменьшался на протяжении всего опыта с максимумом на 90 сутки (на 64.9% (р=0.0009) относительно контроля), при этом ФА практически не изменялась (табл. 1).
Динамика изменений в обмене фукозосодержащих гликопротеинов в тканях желудка и тонкой кишки иммобилизованных крыс показала разнонаправленный характер:в начале и в конце всего периода наблюдения уровень ОФ и ФА снижался, что может свидетельствовать об изменении метаболизма гликопротеинов в сторону анаболизма. ЗАКЛЮЧЕНИЕ Таким образом, факт повышения в сыворотке крови концентрации фукозы и одновременное снижение в тканях печени ОФ и ФА может свидетельствовать об активации процессов анаболизма фукогликопротеинов в печени. Однако к 35 дню иммобилизации в слизи желудка и тонкой кишки животных выявлен рост фукозы и ФА. Данный биохимический путь можно трактовать как маркер катаболизма фукогликопротеинов, что подтверждает реализацию модели иммобилизационного стресса. Разнонаправленные изменения в метаболизме фукозосодержащих биополимеров в установленные сроки опыта выявляют пути адаптационной защитной функции слизистой оболочки желудка и тонкой кишки крыс в условиях иммобилизационного стресса. Данные проявления могут быть связаны с максимальным ростом кортикостерона в крови, который вызывает активацию процессов дефукозилирования [3, 9-11]. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Экспериментальное моделирование иммобилизационного стресса проводили с соблюдением общепринятых норм гуманного отношения к лабораторным животным. ФИНАНСИРОВАНИЕ Работа не имела внешних источников финансирования. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов ЛИТЕРАТУРА
|