К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ СИНТЕЗ ФТАЛОЦИАНИНОВЫХ ЛИГАНДОВ И КОМПЛЕКСОВ Рисунок 1 Синтез фталодинитрилов. Рисунок 2 Побочные продукты, выделенные при синтезе фталодинитрилов. Рисунок 3 Синтез фталоцианинов. Рисунок 4 Структура модифицированных фталоцианинов. Рисунок 5 ЭСП соединения (R=3a, М=Н) в различных растворителях. Таблица 1 Липофильно-гидрофильные свойства фталоцианинов. |
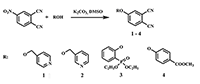
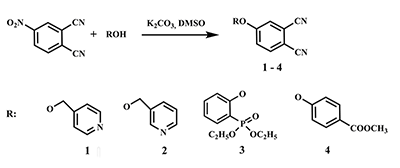
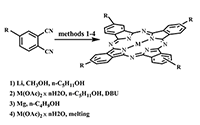
Синтез водорастворимых фталоцианинов и модификация их периферических фрагментов как метод направленного изменения липофильно-гидрофильных свойств Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: ikalashn@ipac.ac.ru Ключевые слова: водорастворимые фталоцианины; фотосенсибилизатор; периферические заместители; темплатная конденсация DOI: 10.18097/BMCRM00024 ВВЕДЕНИЕ В настоящее время успешно развивается принципиально новый метод диагностики и лечения рака, базирующийся на способности фотосенсибилизаторов селективно накапливаться в пораженных тканях и при локальном облучении определенной мощности и длины волны генерировать кислородосодержащие свободные радикалы, приводящие к гибели опухолевых клеток [1-3]. Многочисленные исследования подтверждают возможность практического применения водорастворимых фталоцианинов в качестве подобных фотосенсибилизаторов, так как эти соединения обладают необходимыми свойствами: имеют интенсивный максимум поглощения в области 650-800 нм, малотоксичны, способны к эффективной генерации синглетного кислорода [4-7]. Давно известно, что незамещенные фталоцианиновые лиганды и металлокомплексы практически нерастворимы в органических растворителях и абсолютно не растворимы в воде. Подобными свойствами обладают и многочисленные фталоцианины с разнообразными периферическими заместителями. В последнее время постоянно появляются сообщения об успехах в синтезе водорастворимых фталоцианиновых лигандов и комплексов, которые достигаются введением в молекулу периферийных заместителей катионного или анионного типа, содержащих структурные фрагменты, обеспечивающие гидрофильность лигандов и комплексов [8-11]. Чрезвычайно желательным свойством идеального сенсибилизатора является одновременная водо- и жирорастворимость. В группе химии комплексообразователей ИФАВ РАН синтезирован ряд замещенных фталоцианинов, обладающих растворимостью в водных средах. Особенностью полученных продуктов является возможность легкого превращения гидрофильных соединений в гидрофобные и обратно, кроме того, благодаря разработанным методам модификации периферических заместителей, получены соединения растворимые одновременно в воде и органических растворителях. Данные фталоцианины могут являться потенциальными фотосенсибилизаторами, а кроме того имеют перспективы применения в качестве комплексообразователей. СИНТЕЗ ФТАЛОЦИАНИНОВЫХ ЛИГАНДОВ И КОМПЛЕКСОВ Среди периферических заместителей, обеспечивающих гидрофильность фталоцианинов, рассматривались: производные пиридинов [12], 2-оксифенилфосфоновой кислоты [13] и п-гидроксибензойной кислоты. Исходными соединениями для получения фталоцианиновых лигандов и комплексов стали замещенные динитрилы, синтезированные в ИФАВ с помощью модификаций широкоизвестного метода на основе 4-нитрофталонитрила в среде абсолютного ДМСО в присутствии избытка безводного K2CO3 (рис. 1). Описанные в литературе синтезы отличаются широким диапазоном температур и времени реакции в зависимости от реакционной способности реагентов [14-17]. Оптимальная температура реакции была определена опытным путем для каждого реагента ROH и варьировалась от 25°С для фосфоната до 80°С в случае метилового эфира бензойной кислоты. Продолжительность реакции также определялась экспериментально и составляла 16-24 ч.
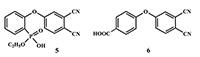
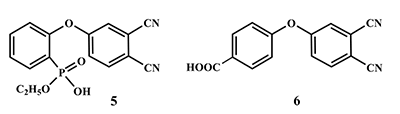
Исходные реагенты, содержащие в молекуле эфирные фрагменты (3, 4) в данных условиях частично гидролизуются с образованием смеси продуктов. Так, в случае реакции 4-нитрофталонитрила с Оꞌ,Оꞌ-диэтил-(2-оксифенил)фосфонатом (3) происходит побочный гидролиз одной этокси-группы. При взаимодействии 4-нитрофталонитрила с п-гидроксиметилбензоатом частично гидролизуется сложноэфирная группа с образованием остатка п-гидроксибензойной кислоты. Структурные формулы побочных продуктов 5, 6 представлены на рисунке 2. В обоих случаях смеси динитрилов, могут быть успешно разделены благодаря способности гидролизованных кислых продуктов растворяться в растворах неорганических оснований (например, 10% раствор NaOH), тогда как эфиросодержащие продукты остаются в органической фазе. После последовательного подкисления водной фазы HCl и экстракции хлороформом, выделялись динитрилы 5 и 6.
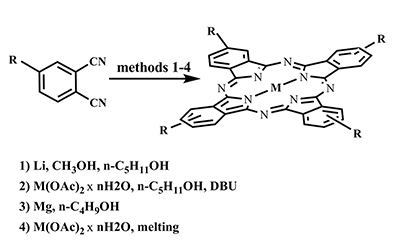
Принимая во внимание неизбежность побочных реакций при проведении темплатных синтезов с применением динитрилов 5, 6, содержащих активные ОН-группы, мы сочли разумным не разделять соединения 3 и 5, а проэтерефицировать смесь этих динитрилов в среде триэтилортоформиата при температуре 146°С, периодически отгоняя летучие продукты, что позволяет получить чистый фталодинитрил 3. Фталогены 1-4, 6 применялись для синтеза свободных фталоцианиновых лигандов, и фталоцианиновых комплексов MgII, CoII, ZnII. Надежным способом получения свободных лигандов является синтез через промежуточные продукты - соответствующие фталоцианинаты дилития, проводимый в смеси метанола и н-пентанола в инертной атмосфере. Дилитиевые комплексы без выделения были деметаллированы с помощью обработки уксусной кислотой. Для фталоцианинатов магния наиболее предпочтительным оказался темплатный синтез на основе динитрилов и металлического магния в абсолютном н-бутаноле. Недостатком данного метода является длительное (около 80 ч) время реакции, но это оправдано воспроизводимостью результатов для различных исходных фталодинитрилов и хорошими выходами продуктов. Магниевые комплексы могут быть деметаллированы с образованием соответствующих свободных лигандов в растворе концентрированной HCl при 50°С в течение 5-6 ч. Металлокомплексы CoII, ZnII синтезированы из фталодинитрилов и соответствующих ацетатов металлов в кипящем н-пентаноле в присутствии 1,8-диазабицикло[5.4.0]ундецен-7-ена (ДБУ). В случае с фталонитрилами 4, 6 наиболее эффективным способом синтеза металлокомплексов оказалось сплавление при температуре 220-240°С.
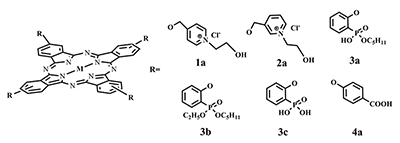
Полученные пиридинсодержащие фталоцианиновые комплексы (R=1,2) практически нерастворимы в обычных органических растворителях – хлороформе, ацетоне, спирте, но при этом растворимы в пиридине. В чистой воде эти соединения также не растворимы, но они растворяются в водных растворах соляной и бромоводородной кислот с образованием гидрохлоридов или гидробромидов пиридиния. Периферические пиридиновые заместители могут быть кватернизованы по атому азота с образованием заряженных четвертичных пиридиниевых соединений, обеспечивающих повышение гидрофильности молекулы. Нами осуществлена кватернизация пиридинсодержащих фталоцианинатов в среде 2-хлорэтанола. Комплексы, содержащие четвертичные пиридиновые фрагменты (рис. 4, R=1a, 2a), нерастворимы в ацетоне, хлороформе, но хорошо растворимы в воде, водных растворах оснований, ДМСО. Для фосфорилсодержащих фталоцианинов (R=3) обнаружено, что в результате конденсации динитрила 4 в избытке н-пентанола в присутствии оснований (алкоголята лития или ДБУ) происходит гидролиз одной и одновременно переэтерификация другой этоксигруппы фосфонатного фрагмента, в результате чего образуются фталоцианины, содержащие фрагмент пентилового полуэфира 2-оксифенилфосфоновой кислоты (рис. 4, R=3a).
Присутствие в молекуле четырех липофильных алифатических заместителей C5H11O- и четырех ОН-групп при атоме фосфора обеспечивает растворимость соединений как в органических растворителях (хлороформе, метаноле и др.), так и в водных растворах оснований. Соединения, обладающие амфифильностью (R=3a), при кипячении в триэтилортоформиате этерифицируются с образованием фталоцианинов, имеющих две различные эфирные группы: C2H5O- и C5H11O- при атоме фосфора, которые проявляют гидрофобные свойства (рис. 4, R=3b). С другой стороны, гидролиз эфирных групп амфифильных фталоцианинов (R=3a) позволяет получить комплексы, содержащие фрагменты фосфоновой кислоты, которые нерастворимы в воде, спирте, ацетоне, хлороформе, но прекрасно растворимы в водных растворах щелочей и органических оснований, т.е. проявляют гидрофильные свойства (рис. 4, R=3c). Наилучшие результаты получены при гидролизе методом кипячения исходных соединений с избытком триметилбромсилана в среде абсолютного ацетонитрила в течение 5 ч и последующим (без выделения) алкоголизом образовавшихся триметилсилиловых эфиров. При необходимости гидрофильные комплексы (рис. 4, R=3c) вновь могут быть проэтерефицированы вышеописанным методом с выделением гидрофобных соединений, растворимых в органических растворителях. Таким образом фосфорилзамещенные фталоцианины обладают наибольшей вариативностью липофильно-гидрофильных свойств. Фталоцианиновые комплексы CoII, ZnII синтезированы из фталодинитрила (4) и ацетатов металлов в кипящем н-пентаноле в присутствии 1,8-диазабицикло[5.4.0]ундецен-7-ена (ДБУ). Время реакции составило 6-10 ч. После удаления растворителя и обработки реакционной смеси последовательно горячим гексаном и метанолом, осушки и последующей очистки методом колоночной хроматографии (SiO2, элюент - первоначально хлороформ, затем смесь СНCl3-СН3ОН, соотношение 7:1) продукты выделены в виде темно-зеленого масла. Спектрофотометрические исследования показывали, что металлокомплексы являются достаточно чистыми, их электронные спектры поглощения (ЭСП) типичны для данного класса соединений: нерасщепленная Q-полоса, наличие колебательного спутника и полосы Соре, интенсивность которой составляла 30% от интенсивности Q-полосы. Однако, по данным ЯМР-спектроскопии, продукт содержит примесь амиловых эфиров как результат процесса переэтерификации, которую не удается отделить хроматографически. После гидролиза эфирных групп в 10% растворе NaOH при 100°С в течение 5 ч выделены в твердом состоянии металлокомплексы, содержащие фрагмент оксибензойной кислоты в качестве периферических заместителей (рис. 4, R=4а). Подобная структура способствует растворимости комплексов в водных растворах оснований. Качественные характеристики растворимости синтезированных фталоцианиновых комплексов представлены в таблице 1.
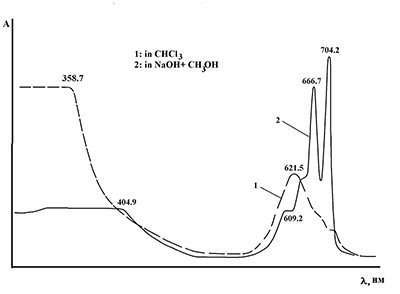
Избежать побочных реакций переэтерификации удается при синтезе фталоцианинов без растворителя методом сплавления. Реакции исходя из фталодинитрилов 4 и 6 и солей цинка проводили при температуре 220 - 230°С в течение 1 ч. Затем остывший расплав промывали водой, метанолом, высушивали на воздухе. Метилбензоатные производные очищались хроматографически. Комплекс, содержащий фрагмент оксибензойной кислоты (рис. 4, R=4a), после обработки водой растворили в разбавленном растворе NaOH, профильтровали, экстрагировали органические примеси CH2Cl2, затем подкислили водную фазу, отфильтровали осадок, промыли водой до нейтральной реакции, сушили. Фталоген 6 также расплавляли без растворителя в присутствии ДБУ при 240°С в течение 2 ч. В результате получали соответствующий свободный лиганд, который обрабатывали 10% HCl, водой. Дополнительную очистку проводили с помощью переосаждения из концентрированной серной кислоты с последующим промыванием большим количеством воды. Все синтезированные соединения охарактеризованы методом УФ-спектроскопии. ЭСП всех безметальных фталоцианинов и металлокомплексов являются типичным для соединений данных классов. ЭСП фталоцианинов, не содержащих ОН-групп, указывают, что соединения находятся в растворе в мономерном состоянии. ЭСП пиридинсодержащих фталоцианинов записаны в пиридине, ЭСП фталоцианинов, содержащих сложноэфирные группы фосфоновой и оксибензойной кислот зарегистрированы в хлороформе. Данные ЭСП для фталоцианинов кислотного типа, имеющих в составе ОН-группы и способных к образованию межмолекулярных водородных связей, указывают на образование ассоциатов и значительно уширены. При добавлении оснований соединения переходят в мономерное состояние. Пример ЭСП фталоцианина (R = 3a, М = Н) в хлороформе и в растворе метилата натрия показан на рисунке 5.
ЗАКЛЮЧЕНИЕ Таким образом, с целью поиска новых подходов к получению фталоцианинов, обладающих растворимостью в водных средах исследованы особенности синтеза и получены опытные образцы фталоцианинов, содержащих фрагменты пиридина, 2-оксифенилфосфоновой кислоты и п-гидроксибензойной кислоты. В качестве исходных соединений использовались специально синтезированные фталонитрилы. Особенностью полученных фталоцианинов является возможность в большинстве случаев превращения гидрофильных соединений в гидрофобные и обратно, кроме того, благодаря разработанным методам модификации периферических заместителей, получены соединения растворимые одновременно в воде и органических растворителях. Синтезированные соединения представляют интерес в качестве комплексообразующих соединений и потенциальными фотосенсибилизаторами для фотодинамической терапии окологических заболеваний. БЛАГОДАРНОСТИ Работа выполнена в рамках Государственного задания 2018 года (темы №0090-2017-0024 и 0081-2014-0015) и частичной финансовой поддержке Программы Президиума РАН № 34 и РФФИ (грант № 18-03-00743). ЛИТЕРАТУРА
|