К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ Рисунок 2 Фосфорилсодержащий ациклический поданд I. Рисунок 4 Замещенный циклен II (a) и предполагаемая структура комплексного соединения Ga3+ (b). Рисунок 6 Cпектры ЯМР 13С{H} лиганда IV: исходный лиганд (a); при добавлении 0.2 (b) и 0.5 (c) мольных эквивалента Ga(NO3)3.
Таблица 1 Расчетные параметры комплексов СаСl2 и Са(NО3)2 с 15-краун-5 и их стандартные отклонения.
|
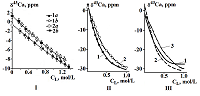
Исследования комплексообразования в растворах методом ЯМР Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: zvl@ipac.ac.ru Ключевые слова: ЯМР-спектроскопия; комплексообразование; лиганд; краун-эфиры; поданд; циклен DOI: 10.18097/BMCRM00025 ВВЕДЕНИЕ Комплексообразование играет существенную роль в целом ряде биологических процессов, без которых невозможно функционирование живых организмов. Комплексные структуры непосредственно участвуют в процессах катализа [1,2], экстракции катионов металлов в биологических системах [3], играют существенную роль в трансмембранном переносе ионов [4], во взаимодействии субстрат – рецептор [5], что стимулирует изучение динамики и механизмов комплексообразования, установление центров координации в молекулах лигандов, уточнения их роли и степени участия в образовании связи металл-лиганд. Изучение процессов комплексообразования органических лигандов с катионами биологически значимых металлов – одно из научных направлений, традиционно развивающееся в ИФАВ РАН, при этом большинство органических лигандов синтезировано в лабораториях института. Основной задачей данной работы являлось изучение процесса комплексообразования методом ЯМР некоторых органических лигандов, с биологически значимыми ионами металлов - Li+, Na+, Ca2+, Ga3+. Биологическая важность соединений кальция и натрия широко известна и изучение комплексообразования с этими элементами постоянно остается актуальной задачей. Соединения лития, участвуя в углеводном и жировом обменах [6], снижая нервную возбудимость [7], эффективно применяются в медицине [8,9]. Интерес к изучению соединений галлия обуславливается возрастающей ролью в ядерной медицине радиоизотопа 68Ga, входящего в состав современных радиофармпрепаратов [10-13]. Давно известно, что концентрация кальция внутри и снаружи живой клетки различается на три порядка и что изменение этого соотношения ведет к серии биохимических и физиологических процессов [14]. Повлиять на транспорт ионов кальция через биологические мембраны можно с помощью различных полидентатных лигандов [15]. Среди таких систем особое внимание привлекают макроциклические полиэфиры (краун-эфиры), которые можно рассматривать не только как удобные модели распознавания [16], но и как биологически активные вещества [17]. Структура краун-эфиров, их поведение в растворах и, в особенности, процессы комплексообразования давно являются предметом многочисленных исследований, среди которых существенные результаты получены при использовании методик ЯМР [18,19]. Ациклические аналоги краун-эфиров – поданды также являются эффективными лигандами, обладающими высокой селективностью к катионам биологически значимых металлов. Интенсивно изучаемые в последнее время лиганды, содержащие фрагменты 1,4,7,10-тетраазациклододекана (циклена), эффективно связывающие катионы d- и f-элементов, широко применяются в качестве компонентов радиофармпрепаратов [20,21] По сравнению с другими методами исследований, спектроскопия ЯМР имеет значительные преимущества. Концентрационные зависимости параметров ЯМР-спектров на ядрах металлов – химического сдвига и ширины линии соответствующих сигналов, позволяют установить константы устойчивости комплексов и их стехиометрию, а также дают возможность наблюдать брутто-эффект комплексообразования (динамический ЯМР на ядрах металлов – 43Ca, 7Li, 23Na и пр.). Можно полагать, что химический сдвиг в спектрах ЯМР металлов в комплексах является мерой ковалентности связи металл-лиганд, а ширина линии сигнала ЯМР - мерой устойчивости комплекса [22]. ЯМР на различных ядрах лиганда (1Н, 31Р, 13С), в первую очередь атомов, непосредственно связанных с металлом, позволяет различить отдельные центры координации в молекуле лиганда, устанавливать электронную структуру комплекса, возможные конформационные изменения в молекуле лиганда при комплексообразовании и изучать отдельные центры координации в лиганде [23]. В данной статье описаны результаты некоторых наиболее интересных исследований, потенциально представляющих практический интерес для различных областей техники и медицины. Цель данной работы – показать, что применение ЯМР- спектроскопии для определения особенностей взаимодействия лиганда и катиона металла может быть простым, удобным и информативным подходом для первичной оценки перспективы применения органических лигандов в качестве комплексообразователей. МАТЕРИАЛЫ И МЕТОДЫ Соли СаСl2 и Са(NО3)2 марки “ч.” прокаливали при 200°C в токе сухого аргона в течение 25 - 30 ч. до постоянной массы и хранили в эксикаторе над Р2О5. Тиоцианаты щелочных металлов LiNCS × H2O и NaNCS (98%) («Aldrich») перед исследованием обезвоживали по методике, описанной в работе [24]. Ga(NO3)3 × 6H2O «Acrus organics» 99.9% применяли без дополнительной очистки. В качестве лигандов применялись краун-эфиры: 15-краун-5 (98%) и 18-краун-6 99% («Aldrich»). Согласно методикам, опубликованным ранее синтезированы трис-[(о-дифенилфосфиноилметил)-феноксиэтил]амин [25] и 1,4,7,10- тетраазациклододекан-1,4,7,10-тетраметиленфосфоновой кислоты [23,26]. Спектральные исследования проводили в растворе D2O (Deuteriumoxide, for NMR, 100.0 atom % D, «Acrus organics»). Спектры ЯМР 43Са, 7Li и 23Na записаны на импульсном Фурье-спектрометре ЯМР «Bruker-СXP-200» (резонансные частоты 13.46, 77.7 и 52.9 МГц соответственно) во внешнем магнитном поле 4.67 Тл при температуре 291К. Для получения спектров ЯМР исследуемые растворы коаксиально размещались в откалиброванных 10-мм ампулах. В качестве внешнего эталона для 43Са использован 3,2 М раствор СаС12 в D2О. В спектрах 7Li, 23Na 0.1 М растворы LiCl и NaCl в D2О, использовались качестве внешних эталонов, а также для стабилизации поля. Спектры ЯМР 31Р и 13С регистрировали в откалиброванных 5-мм ампулах на спектрометре «Bruker-DPX-200» при частотах соответственно 81.0 и 50.04 МГц. В качестве стандартов использовались тетраметилсилан (внутренний эталон) и 85% Н3РО4 (внешний эталон). Образцы готовили путем объединения растворов точно отмеренных навесок соли и лиганда в D2O. Для анализа схемы комплексообразования, расчета констант равновесий, и химических сдвигов комплексов концентрационные зависимости параметров ЯМР-спектров обрабатывали с привлечением программ ЕQ [27], FLEXI и симплекс-метода [28]. Экспериментальные кривые, представляющие зависимость химического сдвига 43Са от концентрации лиганда, обработаны методом наименьших квадратов с использованием универсальной программы расчета равновесий в растворах, включающей использование уравнений материального баланса, констант равновесия и уравнения, связывающего наблюдаемый химический сдвиг с химическими сдвигами и концентрациями компонент равновесия [29]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ С позиции биологической активности наибольший интерес представляют данные о механизмах комплексообразования и структуре комплексов в водной среде. Комплексообразование хлорида кальция с 18-краун-6 в воде исследовалось ранее методом титрационной калориметрии, однако тепловой эффект взаимодействия обнаружен не был ввиду малой величины энтальпии и (или) константы взаимодействия [30]. Применяя ЯМР 43Са, позволяющий наблюдать за атомом кальция - нуклидом, непосредственно участвующим в комплексообразовании, удалось обнаружить взаимодействие 15-краун-5 и 18-краун-6 с солями СаХ2 (Х = NО3-, Сl-) в воде [31]. Следует подчеркнуть, что естественное содержание магнитного изотопа 43Са ничтожно – лишь 0.143%. Точность измерения химического сдвига составила ± 0,3 м.д. Изменения химического сдвига в зависимости от концентрации (рис.1) свидетельствуют о комплексообразовании в системе [СаСl2, Са(NО3)2, - краун-эфиры]. В условиях быстрого обмена наблюдаемый химический сдвиг d аддитивен относительно химических сдвигов компонент равновесия [29]:
Варьируемыми параметрами были константы устойчивости и химические сдвиги комплексов. Степень согласия найденного решения с экспериментом характеризовалась величиной R-фактора в %:
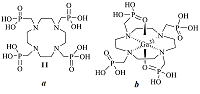
Концентрационные константы устойчивости и химические сдвиги комплексов вычислялись по схеме Ca2+ + L ↔ СаL2+, где L - лиганд. Параметры этой модели определяли в двух вариантах (табл. 1).
В первом варианте вычислялись концентрационные константы устойчивости и химические сдвиги комплексов. Как видно из таблицы 1, логарифм константы равновесия LgК, для СаСl2 больше, чем для Са(NО3)2. Такое различие в константах может быть обусловлено разными значениями средних коэффициентов активности исследуемых солей. Во втором варианте для проверки этого предположения был проведен расчет, в котором для получения термодинамических констант равновесия данные по d(43Са) обрабатывали с учетом средних коэффициентов активности солей. Поскольку эти данные получены при практически постоянной концентрации соли, коэффициенты активности СаС12 и Са(NO3)2 принимали равными 0,445 и 0,372 соответственно [32]. Коэффициенты активности остальных частиц приняты равными единице (для лиганда L - в силу электронейтральности, а для CaL2+- из-за малой концентрации образующегося комплекса). Как оказалось, различие термодинамических констант устойчивости остается вполне заметным и лежит за пределами ошибок определения. Таким образом, полученные результаты показывают, что при использованных концентрациях компонентов устойчивость комплексов CaL2+ в водной среде зависит от природы аниона. Рассчитанные химические сдвиги и термодинамические величины комплексообразования 18-краун-6 с CaCl2 и Ca(NО3)2 по данным ЯМР 43Са приведены в таблице 2. Из данных таблицы следует, что с возрастанием ионной силы при комплексообразовании 18-краун-6 с Ca(NО3)2 LgК уменьшается, а с CaCl2 возрастает. Анализируя результаты исследования взаимодействия солей кальция с 18-краун-6, необходимо отметить, что замена аниона NO3- на Сl- в составе соли кальция привела к изменению всех термодинамических величин комплексообразования, а также химических сдвигов комплексов. Эти выводы представляются важными, поскольку в предшествующих исследованиях комплексообразования краун-эфиров с солями различных металлов влияние природы аниона на термодинамические характеристики реакций не учитывалось.
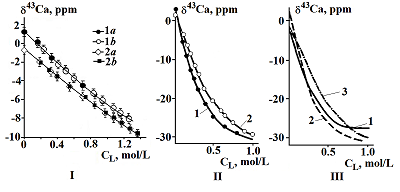
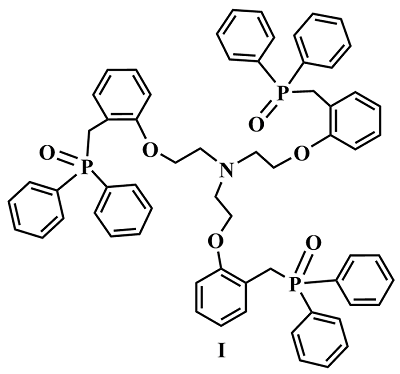
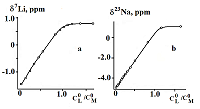
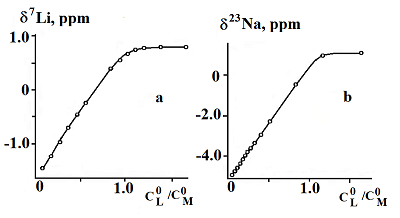
Ациклические аналоги краун-эфиров – поданды также являются интересными лигандами, предоставляющими возможность синтеза рецепторов с выраженными, заранее заданными катион - селективными и спектральными свойствами. Систематические исследования координации неорганических катионов такими подандами в растворах методами мультиядерного динамического ЯМР предоставляют интересную информацию об электростатических, гидрофобных и донорно - акцепторных взаимодействиях при комплексообразовании. Нами проведены исследования взаимодействия фосфорилсодержащего ациклического поданда - трис-[(о-дифенилфосфиноилметил)-феноксиэтил]амина I (рис. 2), с образованием комплексов с солями лития и натрия методом ЯМР 7Li и 23Na [25].
Спектры ЯМР 7Li получены при концентрации соли LiNCS = 8 ммоль/л титрованием ее раствором лиганда, концентрация которого изменялась в диапазоне 0.7-12.0 ммоль/л. Аналогичные кривые титрования для ядра 23Na получены при концентрации соли NaNCS и лиганда соответственно 20.0 и 0.7-28.4 ммоль/л. Спектры ЯМР 7Li и 23Na представляют собой синглеты, ширина которых растет с увеличением концентрации лиганда. Сигнал при этом смещается в слабое поле. Погрешность измерения химических сдвигов в спектрах ЯМР 7Li составляла ±0.006 м. д., а в спектрах ЯМР 23Na - ±0.08 м. д. вследствие существенно большей ширины сигнала. Эти погрешности на два порядка меньше наблюдаемых изменений в химических сдвигах, обусловленных комплексообразованием. На рис. 3 представлены кривые зависимости химического сдвига в спектрах ЯМР 7Li(а) и 23Na(b) от концентрации поданда I. Расчет констант равновесия комплексов и химических сдвигов по экспериментальным зависимостям рис.3 проводился вышеупомянутой методикой [29].
В таблице 3 приведены логарифмы констант устойчивости и значения химических сдвигов комплексов триподанда I с роданидами лития и натрия в ацетонитриле, полученные из экспериментов ЯМР 7Li и 23Na.
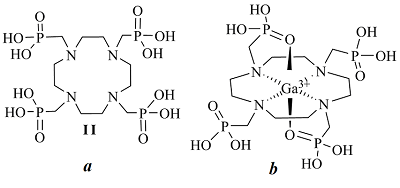
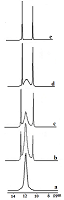
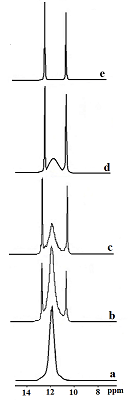
Кроме краун-эфиров и их ациклических аналогов перспективными комплексообразующими лигандами являются производные тетраазациклододекана (циклена), входящего в состав современных остеотропных радиофармпрепаратов (РФП). Интересные результаты получены при комлексообразовании фосфорилированного производного циклена - 1,4,7,10-тетраазациклододекан-1,4,7,10-тетраметиленфосфоновой кислоты (II), рис. 4а) с катионом Ga3+ [23,33]. В этом случае природа сделала нам подарок, позволив наблюдать редкое явление, когда в спектрах ЯМР сигналы связанных и свободных в динамике комплексообразования ядер разделяются.
Спектр 31Р{H} соединения (II) представляет собой уширенный синглет с шириной Δ~33Гц с химическим сдвигом δ=11.83 м.д. Анализ экспериментальных спектральных данных показывает, что взаимодействие (II) с катионом Ga3+ приводит к уменьшению интегральной интенсивности сигнала свободного лиганда при неизменной, в пределах погрешности эксперимента, его ширине и значении химического сдвига и, одновременно, к появлению двух новых, значительно более узких (Δ~4Гц и Δ~4.5Гц), сигналов близкой интенсивности при δ = 12.63 и 10.68 м.д., которые, по-видимому, можно отнести к образованию галлиевого комплекса. Одна из возможных его форм представлена на рис. 4b Увеличение концентрации Ga3+ в исследуемом образце приводит к постепенному возрастанию интегральной интенсивности сигналов комплексного соединения, причем сигнал исходного лиганда, постепенно уменьшаясь, полностью исчезает при достижении эквимолярных концентраций лиганда и Ga3+. Полученные результаты представлены на рис.5.
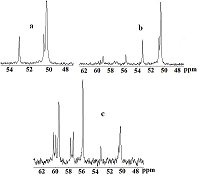
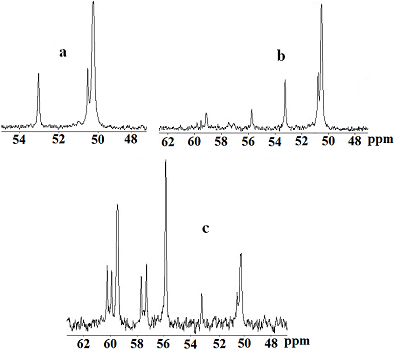
Предположительно, внедряясь в азотную нишу плоскости цикла, катион Ga3+ фиксируется в ней с двух сторон атомами кислорода фосфорильных фрагментов, попадая в своеобразную «ловушку» (рис. 4б). В результате обмен лиганд ⇄ комплекс практически отсутствует, вследствие чего в спектре одновременно фиксируются сигналы как образующегося комплекса, так и исходного свободного лиганда. Заметное сужение сигналов комплексного соединения по сравнению с сигналом свободного (IIa), можно объяснить тем, что атомы азота и частично фосфорильные атомы кислорода, связываясь с катионом галлия, не участвуют в процессе протонного обмена при образовании внутри- и межмолекулярных ассоциатов. При этом наблюдается противоположное направление сдвигов сигналов различных фосфорильных групп комплекса относительно сигнала лиганда. Сигнал атомов фосфора, связанных с катионом Ga3+, в результате дезэкранирования сдвигается в слабое поле относительно сигнала лиганда, в то время как магнитное экранирование ядер в несвязанных с катионом Ga3+ фосфорильных фрагментах способствует смещению сигнала в сильное поле. Несколько большая ширина сигнала, находящегося в сильном поле также указывает на то, что его можно отнести к несвязанным с катионом галлия фосфорильным фрагментам. Cпектр ЯМР 13С{H} циклена IIa содержит слабо расщепленный сигнал при 50.27 м.д, соответствущий атомам цикленового фрагмента и дублет с 1JCР=132.8 Гц, отнесенный к атомам углерода внешнециклической метиленовой группы (рис.6а). При добавлении соли галлия в спектрах ЯМР 13С наблюдается уменьшение интенсивности сигналов свободного лиганда, и отмечается появление двух новых групп сигналов как экзоциклических, так и цикленовых -СН2- фрагментов, указывающих на неэквивалентность не только метиленфосфорильных фрагментов, но и углеродных атомов цикла, которая появляется при образовании комплекса (рис. 6 b, c). Сигналы эти заметно сдвинуты в слабое поле. Незначительно изменяются также величины 1JСP.
ЗАКЛЮЧЕНИЕ Методами спектроскопии ЯМР исследованы процессы комплексообразования краун-эфиров, их ациклических аналогов (подандов) и производных циклена - органических лигандов, имеющих перспективы доля практического применения в технике и медицине, с катионами биологически значимых металлов (Li+, Na+, Ca2+, Ga3+). Установлено, что, несмотря на очень малую природную концентрацию магнитного изотопа кальция, чувствительность метода ЯМР 43Ca оказалась существенно выше, чем при калориметрических измерениях. Это позволило не только зафиксировать образование комплекса с небольшими константами устойчивости, но и установить его константы равновесия. Показано, что устойчивость комплексов СаL2+ с краун-эфирами и ациклическими подандами в водной среде существенно зависит от природы аниона. Установлена высокая селективность ациклического поданда к катионам лития и, в меньшей степени, натрия. Показана возможность применения метода ЯМР 31Р и 13С для первичного тестирования комплексообразования цикленсодержащих фосфоновых кислот с катионом Ga3+ в D2O. С помощью ЯМР 31Р наглядно продемонстрировано, что циклен проявляет высокую способность к комплексообразованию с катионами Ga3+, при этом процесс обмена лиганд-комплекс в растворе практически отсутсвует, что открывает возможности для создания перспективных водорастворимых фосфорилированных лигандов для ядерной медицины. БЛАГОДАРНОСТИ Работа выполнена в рамках Государственного задания 2018 года (темы №0090-2017-0024 и 0081-2014-0015), РФФИ (грант № 18-03-00743) и частичной поддержке Программы Президиума РАН № 38. ЛИТЕРАТУРА
|