К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ 1. КАРБОКСИЛЭСТЕРАЗЫ – ВАЖНЫЙ ФЕРМЕНТ МЕТАБОЛИЗМА ЛЕКАРСТВ СО СЛОЖНОЭФИРНЫМИ ГРУППАМИ 2. ТЕРАПЕВТИЧЕСКАЯ РОЛЬ ИНГИБИТОРОВ КАРБОКСИЛЭСТЕРАЗ 3. НЕОБРАТИМЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ 4. ОБРАТИМЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ 5. СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ Рисунок 1 Примеры лекарственных препаратов, которые гидролизуются КЭ. Рисунок 2 Механизм КЭ-гидролиза субстратов. Рисунок 3 Роль КЭ и ее ингибиторов в механизме действия пролекарств. Рисунок 4 Роль КЭ и ее ингибиторов в механизме действия лекарств со сложноэфирными группами. Рисунок 5 Ковалентные селективные ингибиторы карбоксилэстераз. Рисунок 6 Известные селективные обратимые ингибиторы карбоксилэстераз. Рисунок 7 Новые перспективные ингибиторы КЭ, имеющие 2-имино-3-полифторалкил-1,3-дионовый скаффолд. |
Селективные ингибиторы карбоксилэстеразы для повышения эффективности, безопасности и рационального применения лекарственных препаратов, содержащих сложноэфирные группы
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
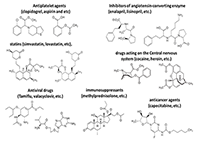
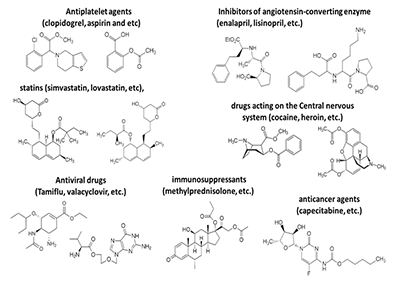
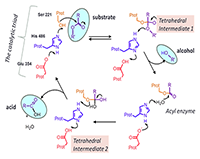
*e-mail: boltneva@ipac.ac.ru Ключевые слова: карбоксилэстеразы; пролекарства; лекарства со сложноэфирными группами; ингибиторы; полифторалкил-2-имино-1,3-дионовый скаффолд DOI: 10.18097/BMCRM00026 ВВЕДЕНИЕ В последние годы наблюдается лавинообразный рост числа публикаций по гидролитическому метаболизму с участием карбоксилэстераз (КЭ, КФ 3.1.1.1) – разнообразных по химической структуре лекарственных препаратов, содержащих сложноэфирную, карбаматную или амидную группировку. Это препараты различных фармакологических групп, отдельные представители которых показаны на рисунке 1 [1,2].
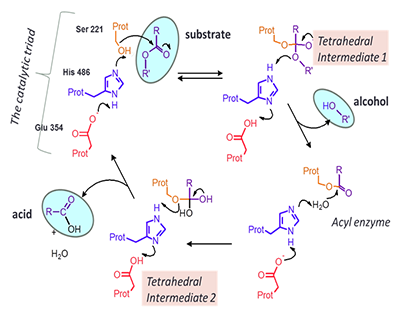
Возросший интерес к данной проблеме обусловлен в значительной степени широким использованием концепции этерифицированных пролекарств для улучшения абсорбции и биодоступности фармакологически активных молекул [3,4], а также появлением информации о том, что генетический полиморфизм, различные заболевания, лекарственные взаимодействия и ксенобиотики могут изменять активность КЭ у пациента, изменяя таким образом терапевтическую эффективность лекарственных препаратов – субстратов КЭ [1,5,6]. 1. КАРБОКСИЛЭСТЕРАЗЫ – ВАЖНЫЙ ФЕРМЕНТ МЕТАБОЛИЗМА ЛЕКАРСТВ СО СЛОЖНОЭФИРНЫМИ ГРУППАМИ КЭ – это сериновые гидролазы, принадлежащие к ферментам фазы I метаболизма ксенобиотиков, содержащих сложноэфирные, амидные или карбаматные группы. Эти ферменты найдены в различных тканях животных (преимущественно в печени, сыворотке крови, лёгких, почках, кишечнике, гемато-энцефалическом барьере), растениях, грибах, дрожжах. Распределение КЭ по тканям коррелирует с их вовлечением в метаболизм ксенобиотиков. Реакция катализируемого КЭ гидролиза сложного эфира до спирта и кислоты, как и в случае других сериновых эстераз, происходит с участием каталитической триады Ser-His-Glu и образованием двух тетраэдрических промежуточных соединений – на стадиях ацилирования и деацилирования (рис. 2).
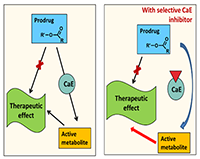
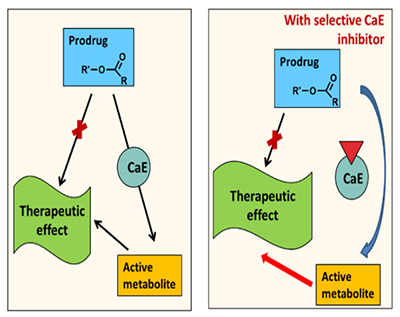
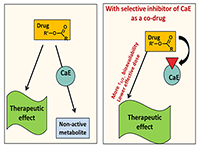
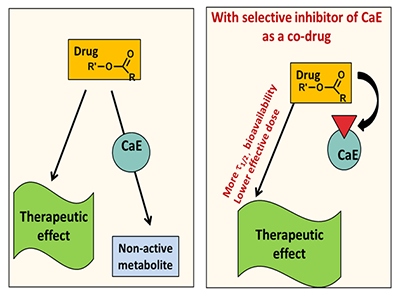
В метаболизме лекарственных препаратов у человека участвуют два основных изофермента КЭ: это карбоксилэстераза 1 – hCE-1 (CES1), локализованная преимущественно в печени, и карбоксилэстераза 2 – hCE-2 (CES2, hiCE), которая находится преимущественно в тонком кишечнике [7,8]. Изоферменты различаются по своей субстратной специфичности: hCE-1 предпочтительнее действует на эфиры с большой разветвленной ацильной группой и маленькой спиртовой. Примером таких субстратов являются противовирусный препарат тамифлю, ингибитор ангиотензинпревращающего фермента (АПФ) эналаприл и другие. hCE-1 способна также катализировать реакцию переэтерификации. hCE-2 гидролизует преимущественно субстраты с маленькой ацильной и большой спиртовой группой [9]. Например, именно под действием hCE-2 происходит гидролиз антиагреганта прасугрела до его активного метаболита [1] и гидролиз героина в морфин, обладающий высоким сродством к опиатным рецепторам. Соответственно, для медицинского применения нужны ингибиторы как hCE-1, так и hCE-2. 2. ТЕРАПЕВТИЧЕСКАЯ РОЛЬ ИНГИБИТОРОВ КАРБОКСИЛЭСТЕРАЗ КЭ ответственны за активацию многих пролекарств и инактивацию многих применяемых на практике лекарственных средств [10]. В связи с этим ингибиторы КЭ, влияющие на скорость гидролиза таких лекарственных препаратов и таким образом определяющие скорость превращения пролекарства в действующее лекарство (рис. 3) или, наоборот, увеличивающие полупериод жизни активного препарата, гидролизующегося КЭ (рис. 4), имеют важное терапевтическое значение [11,12].
Так, для пролекарств, которые активируются путем катализируемого КЭ гидролиза, в частности для эффективного противоракового средства иринотекана (CPT-11), ингибиторы КЭ снижают скорость появления активного и при этом токсичного метаболита и таким образом уменьшают опасный для жизни побочный эффект препарата - позднюю диарею [11]. Селективные ингибиторы КЭ позволяют снизить скорость катализируемого КЭ превращения героина в токсичный метаболит морфин и увеличить таким образом время для оказания экстренной медицинской помощи при передозировке героина [13,14].
Селективные ингибиторы КЭ могут быть использованы также как безопасные вспомогательные лекарственные средства (компоненты комбинированной лекарственной терапии, адъюванты), повышающие полупериод жизни используемых в клинической практике препаратов короткого действия. Например, флестолола и эсмолола - бета-адреноблокаторов, содержащих сложноэфирные группы, которые быстро гидролизуются и инактивируются КЭ. Полупериод жизни этих препаратов в плазме менее 10 мин, т.е. это препараты сверхкороткого действия. Применение селективных ингибиторов КЭ может увеличить полупериод жизни таких препаратов, которые являются на данный момент единственным средством, снижающим риск летального исхода у больных ИБС [11]. 3. НЕОБРАТИМЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ Решением проблемы создания селективных и нетоксичных ингибиторов КЭ в мире занимаются уже достаточно давно, однако в связи с большим структурным сходством сериновых эстераз имеется лишь ограниченное число сообщений о селективных ингибиторах КЭ. Это, прежде всего, фосфорорганические ингибиторы (ФОИ), необратимо и продолжительно ингибирующие КЭ (рис. 5).
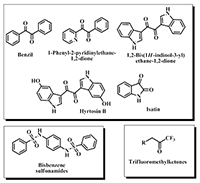
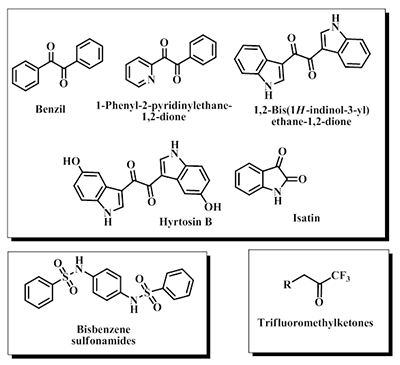
Известно всего несколько ФОИ, селективно ингибирующих КЭ. Это бис(пара-нитрофенил)фосфат (BNPP) [15], циклические производные фосфорной кислоты Bomin-1, 2, и 3 [16] и селективные ингибиторы КЭ из ряда О-фосфорилированных 1-гидроперфторизопропанолов [17-19]. Однако, практическое применение фосфорорганических ингибиторов КЭ, особенно для человека, вызывает известную настороженность в связи с их возможным отставленным нейротоксическим эффектом. Селективные псевдо-необратимые ингибиторы КЭ с низкой острой токсичностью найдены в ряду О-карбамоилированных 1-гексафторизопропанолов [20,21]. 4. ОБРАТИМЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ Анализ литературных данных показал, что известно довольно ограниченное количество соединений, обладающих способностью селективно обратимо ингибировать КЭ. Основные и чрезвычайно активные исследования по поиску селективных ингибиторов КЭ ведутся в лаборатории проф. P. Potter в сотрудничестве с R.M. Wadkins, C.E. Wheelock и M. Ross. Этими исследователями были найдены два основных класса эффективных и селективных обратимых ингибиторов КЭ – это бис-арилсульфамиды, которые специфически ингибируют КЭ тонкого кишечника (hCE-2) со значениями Ki в наномолярной области [22,23], но обладают очень низкой растворимостью и слабой проницаемостью через мембраны (рис. 6) [12], и соединения ряда ароматических 1,2-дионов, ингибирующие как КЭ печени (hCE-1), так и КЭ кишечника (hCE-2) [24]. Установлено, что именно 1,2-дионовый фрагмент обусловливает эффективное ингибирование КЭ. Так, эффективными ингибиторами КЭ оказались изатины (индол-2,3-дионы) [25], 1-фенил-2-пиридинилэтан-1,2-дионы [26] (рис. 6), ряд природных соединений с 1,2-дионовым фрагментом, в том числе таншиноны, β-лапахоны и 1,2-дионсодержащие дитерпеноиды [27-33]. Имеются только предположения о механизме действия дионовых ингибиторов КЭ. В лаборатории P. Potter в настоящее время ведутся активные исследования в области дионовых структур с задачей найти ингибиторы КЭ для клинического применения.
К известным высокоактивным обратимым ингибиторам КЭ относятся также производные трифторметилкетонов (рис. 6) [34]. Предполагают, что механизм их действия связан с образованием гем-диолов по трифторацетильной группе при взаимодействии с серином активного центра КЭ, которые являются аналогом переходного состояния при гидролизе субстратов данными ферментами [35]. Трифторметилкетоны эффективнее ингибируют КЭ по сравнению с холинэстеразами, но их селективность невысока. Соединения довольно гигроскопичны. Таким образом, анализ литературы свидетельствует, с одной стороны, о высокой потребности в ингибиторах КЭ для биомедицинского применения, с другой стороны - о наличии весьма ограниченного числа имеющихся в настоящее время структур с необходимыми свойствами. Данный факт подчеркивает важность и актуальность задачи создания новых эффективных и селективных ингибиторов КЭ. 5. СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ КАРБОКСИЛЭСТЕРАЗ, НАЙДЕННЫЕ В СОТРУДНИЧЕСТВЕ ИФАВ РАН и ИОС УрО РАН К настоящему времени найдены высокоэффективные и селективные ингибиторы КЭ - алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионаты I [36,37], которые мы назвали Фоксины (Foxins). В результате исследования ингибиторной активности 2-арилгидразинилиден-3-оксоэфиров I в отношении КЭ и структурно близких сериновых эстераз - ацетилхолинэстеразы (АХЭ) и бутирилхолинэстеразы (БХЭ) установлено, что данные соединения эффективно ингибируют КЭ с величинами IC50 в наномолярном диапазоне, проявляя существенно более низкую активность в отношении АХЭ и БХЭ. Полученные величины IC50, характеризующие эстеразный профиль наиболее активных соединений I, представлены в таблице 1.
Полученные данные по ингибиторной активности семейства фоксинов I в отношении КЭ указывают на перспективность дальнейших расширенных исследований по поиску в данном ряду активных и селективных ингибиторов КЭ с фармакокинетическими и токсикологическими характеристиками для применения in vivo. Следует также отметить, что соединения I являются легкодоступными, их синтез малостадиен, хорошо отработан и легко масштабируем. Сначала конденсацией Кляйзена из коммерческих реактивов, полифторкарбоновых кислот и алкилацетатов получают фторированные 3-оксоэфиры, из которых реакцией азосочетания с солями арилдиазония синтезируют целевые 2-арилгидразинилиден-3-оксоэфиры I [38-40]. Эффективные и селективные ингибиторы КЭ также были найдены при исследовании 7-гидрокси-7-полифторалкил-4,7-дигидроазоло[5,1-c][1,2,4]триазинов II, которые являются циклическими изомерами алкил-2-гетарилгидразинилиден-3-оксо-3-полифторалкилпропионатов [41]. Соединения II легко образуются в результате азосочетания 3-полифторалкил-3-оксоэфиров с солями гетеарилдиазония, содержащими в α-положении NH группу [42-44]. При исследовании эстеразного профиля соединений II найдены эффективные и высокоселективные ингибиторы КЭ среди представителей пиразоло-, триазоло- и тетразолотриазинов (табл. 2). Как видно из таблицы 2, данные соединения практически не ингибируют структурно близкие сериновые эстеразы АХЭ и БХЭ. Повышению ингибиторной активности соединений в отношении КЭ способствует удлинение полифторакильного радикала, при этом этиловые эфиры проявляют большую активность по сравнению с метиловыми аналогами.
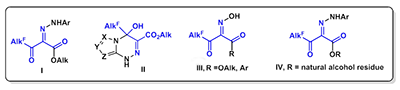
Следует отметить, что потенциал данных структур как ингибиторов КЭ для последующей модификации далеко не исчерпан. Об этом свидетельствуют недавно полученные данные о высокой ингибиторной активности и селективности в отношении КЭ для полифторалкил-2-имино-1,3-дионов, содержащих вместо ариламиногруппы в иминном фрагменте гидроксильный заместитель (соединения III, рис. 7).
Другим не менее перспективным направлением структурной модификации алкил-2-арилгидразинилиден-3-оксо-3-полифторалкилпропионатов (фоксинов) I как эффективных и селективных ингибиторов КЭ является введение в их структуру остатка высшего или природного спирта. По нашим предварительным данным такая модификация 3-оксо-2-толилгидразоно-4,4,4-трифторбутаноатов (соединения IV, рис. 7) приводит к сохранению высокой анти-КЭ активности. Следует отметить, что данная структурная модификация применена нами в связи с проводимыми в последнее время исследованиями, показавшими, что ряд веществ растительного происхождения и их синтетически модифицированные производные обладают высокой антикарбоксилэстеразной активностью и низкой токсичностью [29-32]. ЗАКЛЮЧЕНИЕ КЭ являются ключевыми ферментами гидролитического метаболизма многочисленных лекарственных препаратов, содержащих сложноэфирную, карбаматную или амидную группировку, который в значительной степени определяет их фармакокинетику, биодоступность, эффективность и возможные токсические эффекты. Быстрый КЭ гидролиз может быть как причиной высокой токсичности препаратов, так и причиной их низкой эффективности, особенно учитывая широкую вариабельность активности КЭ у индивидуумов. Создание и использование селективных ингибиторов КЭ как компонентов комбинированной лекарственной терапии - это новый перспективный подход в медицинской химии и фармакологии, открывающий возможность тонкой регуляции активности КЭ и рационального применения лекарственных препаратов, повышения их терапевтической эффективности, снижения токсичности и других побочных эффектов. В качестве новых перспективных ингибиторов КЭ нами предложены соединения, имеющие 2-имино-3-полифторалкил-1,3-дионовый скаффолд, среди которых уже обнаружены эффективные селективные ингибиторы данного фермента. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке гранта РФФИ № 16-03-00417; Биологические исследования выполнены в соответствии с Государственным заданием (тема № 0090-2017-0019), химическая часть выполнена в рамках государственного задания АААА-А18-118020290121-9. ЛИТЕРАТУРА
|