К 40-летию Института физиологически активных веществ РАН
|
Влияние размера цикла и структуры спейсера конъюгатов такрина и его циклопентильного гомолога с 5-(4-трифторметил-фениламино)-1,2,4-тиадиазолом на спектр биологической активности
Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
*e-mail: kovalevanv@ipac.ac.ru
Ключевые слова: такрин; 1,2,4-тиадиазол; ацетилхолинэстераза; бутирилхолинэстераза; антиоксиданты; болезнь Альцгеймера DOI: 10.18097/BMCRM00027 ВВЕДЕНИЕ Болезнь Альцгеймера (БА) является наиболее распространенным прогрессирующим нейродегенеративным расстройством среди пожилых людей. Она характеризуется нарушениями памяти, дисфункцией когнитивных способностей, поведенческими отклонениями вплоть до полной деградации личности. По оценкам специалистов, в настоящее время около 20 миллионов людей страдают от БА, и это число достигнет 114 миллионов к 2050 году [1,2]. Несмотря на огромные усилия по поиску новых эффективных средств для лечения БА, за последние 12 лет на рынок не было выведено ни одного нового препарата [3]. Одним из подходов к поиску новых лекарственных препаратов является создание гибридных структур – конъюгатов, содержащих два или более различных фармакофоров, объединенных спейсером [4]. В качестве одного из фармакофоров часто используют молекулу, обладающую антихолинэстеразными свойствами, поскольку при БА страдает холинергическая нервная система, и использование ингибиторов холинэстераз повышает уровень нейромедиатора ацетилхолина [5]. Учитывая, что окислительный стресс и агрегация бета-амилоида являются одними из ключевых этиологических факторов патогенеза нейродегенеративных расстройств, в качестве второго фармакофора вводят фрагменты, придающие конъюгатам антиоксидантные и/или антиагрегантные свойства [6,7]. В настоящей работе в качестве ингибитора ацетилхолинэстеразы (АХЭ, КФ 3.1.1.7) и бутирихолинэстеразы (БХЭ, КФ 3.1.1.8), мы использовали молекулу такрина и его циклопентильного аналога. В качестве второго фармакофора мы использовали 1,2,4-тиадиазольный скаффолд. Производные 1,2,4-тиадиазола, как известно, обладают широким спектром биологической активности [8,9]. Среди соединений этого класса найдены ингибиторы АХЭ, антиоксиданты, лиганды глутаматных рецепторов ЦНС [10-12]. Целью работы был направленный синтез новых гибридных соединений на основе такрина и его циклопентильного гомолога - 2,3-дигидро-1H-циклопента[b]хинолин-9-иламина, модифицированных через пентиламинопропановый и пентиламинопропеновый спейсеры 5-(4-трифторметил-фениламино)-1,2,4-тиадиазолом, исследование их антихолинэстеразной активности, способности вытеснять пропидий из периферического анионного сайта (ПАС) АХЭ и связывать свободные радикалы. МАТЕРИАЛЫ И МЕТОДЫ В работе использованы следующие реактивы: ацетилхолинэстераза эритроцитов человека, ацетилхолинэстераза из Electrophorus electricus (ЕеАХЭ, фракция VI-S), бутирилхолинэстераза сыворотки лошади, карбоксилэстераза печени свиньи, ацетилтиохолина иодид, 4-нитрофенил ацетат, 5,5'-дитио-бис(2-нитробензойная кислота), АБТС (2,2′-азино-бис(3-этилбензтиазолино-6-сульфоновая кислота), гидрофосфат натрия дигидрат, такрин (9-амино-1,2,3,4 тетрагидроакридина гидрохлорид), донепезил ((±)-2-[(1-бензил-4-пиперидил)метил]-5,6-диметокси-1-инданона гидрохлорид), пропидий иодид (3,8-диамино-5-[3-(диэтилметиламмонио)пропил]-6-фенилфенантридиния дииодид), L-аскорбиновая кислота, S-бутирилтиохолина иодид, бис-пара-нитрофенилфосфат, тролокс (6-гидроки-2,5,7,8-тетраметилхроман-2-карбоновая кислота), диметилсульфоксид, дигидрофосфат калия, персульфат калия (K2S2O8), трис(гидроксиметил)аминометан гидрохлорид (Трис), этанол (этиловый спирт), («Sigma-Aldrich», США); 3-амино-5-метил-изоксазол, 4-трифторметиланилин, тиофосген, метиленхлорид, боргидрид натрия (NaBH4), метанол, дейтерохлороформ («Cambridge isotope laboratories inc.» США).
Синтез Спектры ПМР регистрировали на приборе Bruker DPX-200 (Германия), химические сдвиги приведены в δ-шкале относительно Me4Si. Температуры плавления определяли на нагревательном столике Бётиуса без коррекции. Общая методика синтеза соединений 4a,b и 5a,b Раствор аминопентильного производного такрина или его гомолога 1 (0.01 М), в 5 мл метанола прибавляли к раствору 5-(4-трифторметил-фениламино)-1,2,4-тиадиазола 2 (0.01 М) в 10 мл метанола и оставляли при комнатной температуре до выпадения осадка - целевого конъюгата 4 (енамина). Осадок отфильтровывали, суспендировали в 30 мл метанола, нагревали до 50°С и при интенсивном перемешивании прибавляли порциями боргидрид натрия (0.01 М). Полученную реакционную смесь перемешивали до полного растворения суспензии. По окончании реакции метанол упаривали, прибавляли 50 мл метиленхлорида и промывали водой (2 х 50 мл), насыщенным водным раствором хлористого натрия, сушили над сульфатом натрия. Осушитель отфильтровывали, фильтрат упаривали. При необходимости (оценка чистоты методом ЯМР-спектроскопии) продукт очищали с помощью колоночной хроматографии и получали целевой коньюгат 5 (амин). Выходы, физические и спектральные данные для соединений 4a и 5a,b приведены ниже. N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-винил}-пентан-1,5-диамин (4a). Светло-желтые кристаллы, Т.пл. 210-212°С. Выход 66 %. ПМР (ДМСО-d6, δ, м.д., J/Гц): 1.68 (м, 6H, N(CH2)3), 2.04 (с, 3H, =СCH3), 2.12 (м, 2H, CH2CH2CH2), 3.05 (кв, J = 7.8 Гц, 2H, CH2), 3.21 (кв, J = 7.3 Гц, CH2), 3.29 (кв, J = 6.5 Гц, 2H, CH2N), 3.66 (кв, J = 6.5 Гц, 2H, CH2N), 4.93 (уш. с., 1H, NH), 5.22 (с, 1Н, =СН), 7.35 (м, 1H, Harom), 7.50 (м, 1H, Harom), 7.53 (д, J = 8.6 Гц, 2H, Harom), 7.62 (д, J = 8.6 Гц, 2H, H arom), 7.73 (д, J = 8.3 Гц, 1H, Harom), 7.92 (д, J = 8.3 Гц, 1H, Harom), 8.35 (т, J = 5.5 Гц, 1H, NН), 10.10 (уш. с, 1Н, NН).
2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-винил-N'-(1,2,3,4 N-(2,3-Дигидро-1Н-циклопента[b]хинолин-9-ил-N'-{1-метил-2-[5-(4-трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-этил}-пропан-1,5-диамин (5a). Кристаллизующееся масло. Выход 60 %. ПМР (CDCl3, δ, м.д., J/Гц): 1.15 (д, J = 6.4 Гц, 3H, CH3), 1.75 (м, 2H, CH2CH2CH2), 2.05 (м, 2H, СН2CH2CH2), 2.66 (м, 2H, СНCH2), 3.14 (м, 2H, CH2), 3.17 (м, 1H, СНCH 2), 3.24 (кв, J = 6.5 Гц, 2H, CH2N), 3.64 (кв, J = 6.5 Гц, 2H, CH2N), 4.74 (уш. с, 1H, NH), 7.37 (м, 1H, Harom), 7.46 (м, 1H, Harom), 7.56 (д, J = 8.6 Гц, 2H, Harom), 7.66 (д, J = 8.6 Гц, 2H, Harom), 7.70 (м, 1H, Harom), 7.824 (д, J = 7.8 Гц, 1H, Harom).
N-{2-[5-(4-Трифторметил-фениламино)-[1,2,4]тиадиазол-3-ил]-1-метил-этил}-N'-(1,2,3,4 Исследование эстеразного профиля соединений Для кинетических исследований использовали коммерческие препараты АХЭ эритроцитов человека, БХЭ сыворотки лошади и карбоксилэстеразы (КЭ, КФ 3.1.1.1) печени свиньи. Активность АХЭ и БХЭ определяли методом Эллмана (l = 412 нм) [14] с использованием в качестве субстрата ацетилтиохолина (1 мM) и бутирилтиохолина (1 мM), соответственно. Условия определения активности АХЭ и БХЭ: 100 мМ фосфатный буфер рН 7.5, 25°С. Активность КЭ определяли спектрофотометрически по выделению 4-нитрофенола (l = 405 нм), субстрат – 4-нитрофенилацетат (1 мM) [15]; условия определения: 100 мМ фосфатный буфер рН 8.0, 25°С. Измерения проводили на микропланшетном спектрометре FLUOstar OPTIMA («BMG LABTECH», Германия). Соединения растворяли в ДМСО, инкубационная смесь содержала 2% растворителя. Первичную оценку ингибиторной эффективности соединений проводили путем определения ингибирования активности ферментов при концентрации соединения 20 мкМ. Для этого образец соответствующего фермента инкубировали с исследуемым соединением в течение 5 мин, затем определяли остаточную активность фермента. Каждый эксперимент проводили в трех повторах. Определение величин IC50 для ингибирования АХЭ, БХЭ и КЭ Ингибиторную активность соединений характеризовали величиной IC50 – концентрацией ингибитора, которая требуется для снижения активности фермента на 50%. Для определения IC50 ингибирования АХЭ, БХЭ и КЭ образец соответствующего фермента инкубировали с исследуемым соединением в диапазоне концентраций 1 х 10-12 - 1 х 10-4 М (концентрация ДМСО 2 об. %) в течение 5 мин, затем определяли остаточную активность фермента. Каждый эксперимент проводили в трех повторах. Вычисление IC50 проводили с использованием программы Origin 6.1 («OriginLab», США). Определение степени вытеснения пропидия иодида из периферического анионного сайта EeАХЭ синтезированными соединениям Способность соединений конкурентно вытеснять пропидий иодид – селективный лиганд ПАС АХЭ, оценивали флуоресцентным методом [16,17]. В качестве источника фермента использовали EeАХЭ из Electrophorus electricus как высокоактивный и более дешевый фермент по сравнению с АХЭ человека, характеризующийся высокой степенью очистки. Интенсивность флуоресценции пропидия иодида в связанном состоянии с АХЭ возрастает в несколько раз. Снижение интенсивности флуоресценции в присутствии исследуемых соединений показывает их способность связываться с ПАС АХЭ, и, соответственно, блокировать агрегацию бета-амилоида. Для определения степени вытеснения пропидия иодида из ПАС АХЭ Ее АХЭ (7 мкМ) инкубировали с исследуемым соединением в концентрации 20 мкМ в 1 мM трис-HCl буфере pH 8.0, 25°С в течение 15 мин. Затем добавляли раствор пропидия иодида (конечная концентрация 8 мкМ), инкубировали 15 мин и снимали спектр флуоресценции (l = 530 нм (возб.) и l = 600 нм (эмис.)). Донепезил и такрин использовали как референсные соединения. Бланк содержал пропидий иодид той же концентрации в 1 мM трис-HCl буфере pH 8.0. Измерения проводили в трипликате на микропланшетном ридере FLUOstar OPTIMA. Степень вытеснения пропидия иодида из периферического анионного сайта АХЭ (% вытеснения) рассчитывали по формуле:
Исследование антирадикальной активности соединений Антирадикальную активность соединений определяли в АБТС тесте по их способности связывать катион-радикал AБТС•+ [18]. AБТС•+-радикал получали в результате реакции 7 мМ водного раствора АБТС с 4.9 мМ водным раствором персульфата калия, взятых в равных объемах. Реакция протекает в течение 12 - 16 ч при комнатной температуре в темноте. Перед проведением измерений полученный раствор AБТС•+-радикала разбавляли 96% этиловым спиртом до получения величины оптической плотности образца 0.75 - 0.95 при l = 734 нм. Исследуемые соединения вносили в раствор AБТС•+ и тщательно перемешивали. Реакцию проводили при 30°С в темноте, время инкубации 1 ч. Степень обесцвечивания раствора AБТС•+-радикала определяли при длине волны 734 нм на микропланшетном спектрометре BioRad хMark (Япония). Величину антирадикальной активности соединений представляли в единицах TEAC (trolox equivalent antioxidant capacity, антиоксидантная способность, выраженная в тролокс-эквивалентах). Значения TEAC рассчитывали, сравнивая разности (A0–Atest) для исследуемого соединения и (A0–Atrolox) для Тролокса (при концентрации обоих 20 мкМ) по формуле:
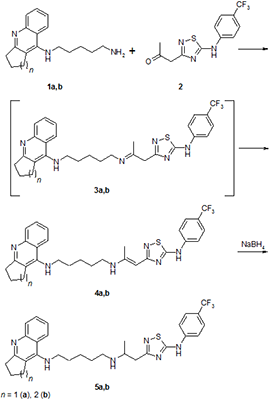
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Целевые соединения 4a,b и 5a,b были получены взаимодействием аминопентильного производного такрина или его гомолога 1a,b, полученных по описанной ранее методике [19], с 5-(4-трифторметил-фениламино)-1,2,4-тиадиазолом 2, полученным взаимодействием 3-амино-5-метилизоксазола и 4-трифторметил-фенилизотиоцианата [20] по схеме, представленной на рисунке 1.
При конденсации первичного амина 1 с кетоном 2 сначала происходит образование «классического» основания Шиффа – имина 3, который in situ перегруппировывается в целевой конъюгат 4 (енамин), выпадающий в осадок. Отфильтрованный енамин при перемешивании в горячем метаноле восстанавливается добавлением эквимольного количества боргидрида натрия. Полное растворение осадка означает окончание реакции гидрирования. Реакционная смесь упаривается, остаток растворяется в хлористом метилене, борные примеси удаляются промыванием водой. Упаривание органической фазы дает достаточно чистый целевой конъюгат 5 со средними выходами. Исследование биологической активности синтезированных конъюгатов включало в себя оценку их эстеразного профиля - ингибиторной активности в отношении АХЭ, БХЭ и структурно близкого фермента – КЭ, способности связываться с ПАС АХЭ и антирадикальной активности.
Как видно из таблицы 1, синтезированные конъюгаты проявляют высокую ингибиторную активность в отношении обеих холинэстераз, проявляя селективность в отношении БХЭ. Вариация размера алифатического цикла такринового фрагмента показала, что соединения с 6-членным алифатическим циклом в целом эффективнее ингибируют все эстеразы, по сравнению с соединениями с 5-членным циклом. Для соединений 5a,b при ингибировании БХЭ влияние размера цикла выражено в наименьшей степени. Влияние структуры спейсера оказалось более значительным: наличие в нем енаминового (соединения 4a,b) или аминового (5a,b) фрагментов в большой степени определяет проявление того или иного вида биологической активности гибридного соединения. Так, конъюгаты с пентиламинопропеновым спейсером (4a,b) ингибируют БХЭ на уровне базового фармакофора такрина, с величинами IC50 порядка 10-8 М. Ингибирование АХЭ слабее и наблюдается в микромолярном диапазоне, несколько ниже активности такрина (табл. 1). В то же время конъюгаты с пентиламинопропановым спейсером (5a,b) проявляют более высокую ингибиторную активность в отношении обеих холинэстераз по сравнению с аминопропеновыми аналогами, при этом особенно существенно возрастает анти-БХЭ активность: соединения 5a,b ингибируют БХЭ на 1 - 2 порядка более эффективно по сравнению с конъюгатами, содержащими аминопропеновый фрагмент. Величины IC50 для соединений 5a,b находятся в наномолярном диапазоне, т.е. конъюгаты с пентиламинопропановым спейсером являются самыми мощными ингибиторами БХЭ в изученной серии соединений. Известно, что в здоровом мозге ацетилхолин преимущественно гидролизуется АХЭ, тогда как БХЭ играет вспомогательную роль [21]. Однако при прогрессии БА отмечено снижение активности АХЭ, в то время как активность БХЭ постепенно увеличивается [22]. В связи с этим возрастает роль БХЭ как терапевтической мишени для компенсации холинергического дефицита, наблюдаемого при БА. Полагают, что соединения, ингибирующие обе холинэстеразы – АХЭ и БХЭ, повышают эффективность лечения [23], а применение селективных ингибиторов БХЭ делает его более безопасным в связи с отсутствием у них побочных эффектов, присущих ингибиторам АХЭ [24]. Следует отметить, что ингибиторная активность большинства исследованных соединений в отношении БХЭ значительно выше, чем в отношении КЭ. При этом наибольшая селективность ингибирования БХЭ по сравнению с КЭ наблюдается у конъюгатов с пентиламинопропановым спейсером 5а,b (табл. 1). В связи с этим можно предположить, что при использовании этих соединений в терапии БА нежелательные лекарственные взаимодействия, связанные с ингибированием КЭ, гидролизующей многочисленные медикаментозные средства со сложноэфирными группами, будут минимальными.
Помимо классической функции гидролиза ацетилхолина АХЭ играет важную роль в процессинге бета-амилоида: ПАС АХЭ взаимодействует с растворимыми пептидами бета-амилоида, способствуя их агрегации [25]. Результаты по вытеснению пропидия из ПАС АХЭ, полученные для синтезированных конъюгатов, приведены в таблице 2. Видно, что соединения с пентиламинопропеновым спейсером 4a,b в концентрации 20 мкМ снижают интенсивность флуоресценции связанного с АХЭ пропидия на 21 - 23%, тогда как соединения с пентиламинопропановым спейсером 5 a,b - на 29 - 31%. При этом все конъюгаты более эффективно вытесняют пропидий из ПАС АХЭ, чем референсное соединение донепезил. Полученные результаты свидетельствуют о том, что синтезированные конъюгаты связываются с ПАС АХЭ и, следовательно, способны блокировать АХЭ-индуцируемую агрегацию бета-амилоида. Также мы исследовали антирадикальную активность конъюгатов в АБТС тесте. Как видно из таблицы 2, в отличие от базового фармакофора такрина все синтезированные конъюгаты обладают способностью связывать свободные радикалы. При этом соединения с пентиламинопропеновым спейсером (4a,b) проявляют высокую АБТС-связывающую активность, превышающую активность стандартного антиоксиданта Тролокса (TEAC = 1.28 - 1.44), тогда как антирадикальная активность соединений с пентиламинопропановым спейсером (5a,b) примерно в 3 раза ниже. Мы полагаем, что высокая радикал-связывающая активность соединений с аминопропеновым спейсером определяется наличием системы сопряжения электронов между 2-аминопропенильным и тиадиазольным фрагментами молекулы, показанной ранее [26,27]. Таким образом, в результате проведенного исследования синтезированы новые гибридные структуры - конъюгаты такрина и его гомолога с 5-членным циклом в алифатическом фрагменте с 5-(4-трифторметил-фениламино)-1,2,4-тиадиазолом и установлена их структура. Для всех изученных соединений показана высокая антихолинэстеразная активность с выраженной селективностью в отношении БХЭ, способность связываться с ПАС АХЭ и вытеснять из него пропидий и, следовательно, блокировать АХЭ-индуцируемую агрегацию бета-амилоида, а также способность связывать свободные радикалы. Анализ полученных результатов показал, что структура спейсера, а именно наличие в нем пропенаминового или пропанаминового фрагмента, существенно меняет спектр биологической активности конъюгатов. При этом конъюгаты c пентиламинопропановым спейсером обладают наилучшим эстеразным профилем с точки зрения безопасности, тогда как конъюгаты c пентиламинопропеновым спейсером проявляют более высокую способность связывать свободные радикалы. Вариация размера алифатического цикла такринового фрагмента в меньшей степени отражается на спектре биологической активности соединений. Соединения с 6-членным алифатическим циклом – производные такрина – представляются более предпочтительными. Полученные результаты показывают перспективность дальнейшей разработки синтезированных конъюгатов и оптимизации их структуры как с точки зрения мультифункциональной фармакологической активности, так и в плане повышения безопасности. БЛАГОДАРНОСТИ Синтез, установление структуры, а также исследование эстеразного профиля полученных соединений и молекулярное моделирование выполнены за счет средств гранта РФФИ 17-03-00984-а; часть работы, связанная с оценкой способности соединений вытеснять пропидий из ПАС EeАХЭ и изучением их антиоксидантной активности выполнена в рамках Государственного задания 2018 года (тема № 0090-2017-0019). В работе использовалось оборудование ЦКП ИФАВ РАН. Работа по молекулярному моделированию выполнена с использованием оборудования Центра коллективного пользования сверхвысокопроизводительными вычислительными ресурсами МГУ имени М.В. Ломоносова. ЛИТЕРАТУРА
|