|
СОДЕРЖАНИЕ 1. МЕТАЛЛООРГАНИЧЕСКИЕ КАРКАСЫ 2. БИОМАРКЕРЫ, БИОРЕАГЕНТЫ И ДЕТЕКТИРУЮЩИЕ МЕТКИ ДЛЯ ИХ ОБНАРУЖЕНИЯ 3. НАНОПЛАТФОРМЫ МОК, COF И ИХ КОМПОЗИТЫ 4. МЕТОДЫ СИНТЕЗА ГИБРИДНЫХ НАНОКОМПОЗИТОВ НА ОСНОВЕ КАРКАСНЫХ СТРУКТУР 5. СТРАТЕГИЯ СИНТЕЗА ГИБРИДНЫХ СТРУКТУР COF-МОК 6. МЕТОДЫ СИНТЕЗА ГИБРИДНЫХ НАНОСТРУКТУР КВАНТОВЫХ ТОЧЕК И МОК 7. БИОРЕАГЕНТЫ МОК НА ОСНОВЕ АНТИТЕЛ И ИХ АНАЛОГОВ 8. ТЕРАНОСТИЧЕСКАЯ НАНОПЛАТФОРМА НА ОСНОВЕ МОК 9. СУПРАМОЛЕКУЛЯРНЫЕ ГИБРИДНЫЕ НАНОСТРУКТУРЫ НА ОСНОВЕ МОК 10. ЭКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГИБРИДНЫХ СТРУКТУР МОК СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ |
МЕТАЛЛОРГАНИЧЕСКИЕ КАРКАСНЫЕ СТРУКТУРЫ В СОВРЕМЕННЫХ ИССЛЕДОВАНИЯХ: МЕДИЦИНА, ДИАГНОСТИКА, ЭКОЛОГИЯ
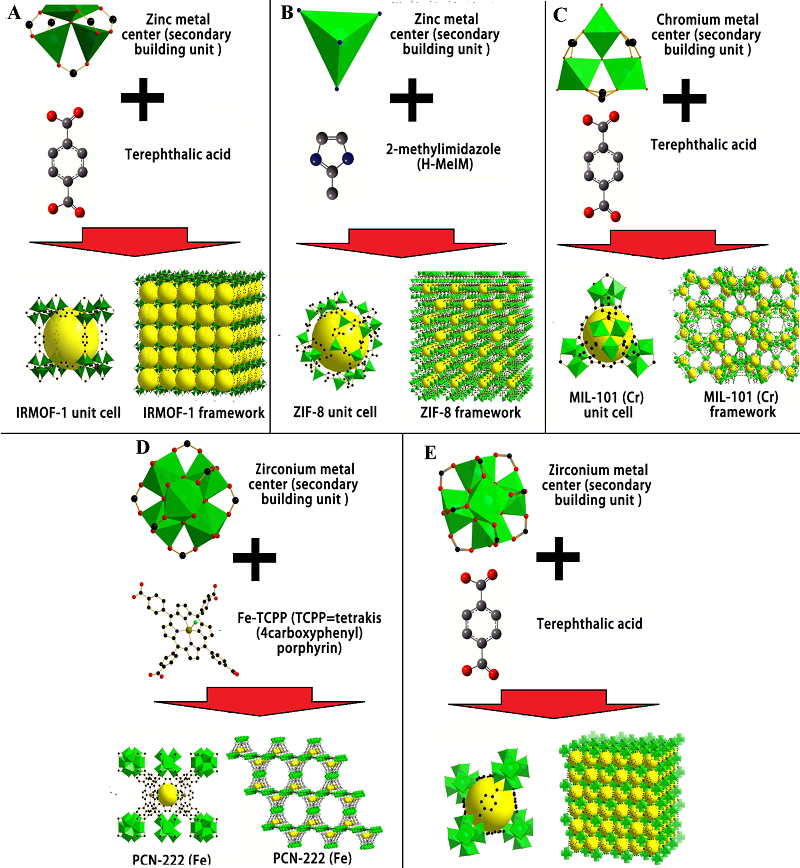
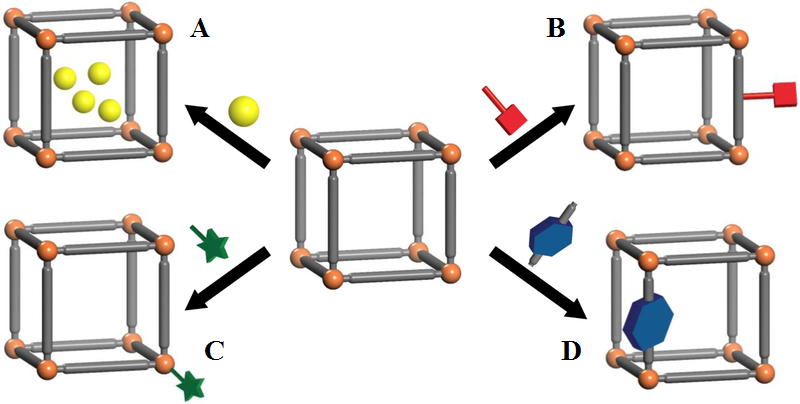
1Государственный научный центр вирусологии и биотехнологии Вектор, 630559, Новосибирская область, Кольцово; е.mail: tumanov@vector.nsc.ru Ключевые слова: биосенсоры; синтез MOК; гибридные структуры МОК/СОF; металлоорганические каркасы; нуклеиновые кислоты; биовизуализация; детекция флуоресценции; гаситель флуоресценции DOI: 10.18097/BMCRM00270 ВВЕДЕНИЕ Развитие медицинских исследований связано с разработкой новых методов мониторинга активности белков, нуклеиновых кислот, характеризующих конкретные заболевания, и определяются эффективностью обнаружения сверхмалых количеств биомаркеров заболеваний и инфекций на фоне большего числа других белков и различных биологических компонентов. Успехи использования инструментальных методов анализа, как правило, включают высокую стоимость оборудования и наличие высококвалифицированного персонала. Наиболее простым и очень продуктивным аналитическим подходом, обеспечивающим исключительно высокую селективность определения биомаркеров заболеваний, является использование выработанных живой природой в ходе эволюции принципов комплементарных аффинных взаимодействий биополимеров. При этом требуемая чувствительность анализа может достигаться путем введения в аффинные биореагенты меток, обладающих необходимыми физическими свойствами или молекулярных наноструктур нового поколения. Аналитический обзор посвящен развитию исследований и медицинской диагностике с использованием КТ в качестве детектирующих меток аффинных биореагентов и каркасных структур [1-4]. При этом авторы ограничились использованием новых методологических подходов в исследованиях in vitro и диагностике, где проблема токсичности не стоит так остро и не столь сильно ограничивает типы используемых КТ, МОК, COF и соответствующих полимерных матриц. Эти свойства делают их перспективными для применения в различных областях, включая создание электрохимических биосенсоров, средств визуализации, терапевтических носителей, биокатализаторов [5-8]. Более того, большее количество COF может оказаться биосовместимым по сравнению с MOК из-за отсутствия металлов в структуре [6, 7]. В области медицинских нанотехнологий на сегодняшний день многие заключения базируются на исследованиях in vitro, результаты которых недостаточно корректно переносятся на чрезвычайно сложные системы in vivo [9]. Создание современных методов диагностики является комплексной задачей на стыке различных наук. Выявления молекулярных профилей заболеваний основаны, прежде всего, на взаимодействиях к исследуемым белкам. При этом в качестве биореагентов могут выступать природные белки или различные аптамерные конструкции полипептидной, полинуклеотидной или иной природы. Признано, что КТ имеют большие преимущества в качестве меток биореагентов для выявления биомаркеров. КТ представляют собой полупроводниковые нанокристаллы, которые обладают уникальными оптическими свойствами, в том числе узкими пиками флуоресценции с настраиваемой длиной волны. Это придает КТ большую ценность в различных биомедицинских приложениях и обеспечивает возможность одновременного обнаружения нескольких белковых биомаркеров, характеризующих заболевание, используя мультиплексные варианты анализа. Для использования этих возможностей КТ необходима разработка различных методов функционализации их поверхности для адаптации к конкретным задачам диагностики. В этом обзоре рассмотрeны принципы классификации, проектирования и синтеза новых наноматериалов на основе МОК, COF и водородно-связанных органических каркасов (HOF), представляющих последнее поколение ретикулярных материалов. 2D-материалы образуют однослойные или многослойные структуры, состоящие из одного или нескольких элементов толщиной в несколько нанометров. В последнее время был предложен ряд гибридных и/или иерархических пористых углеродных структур, которым в этой статье уделяется определенное внимание [10-13]. В отличие от MOК и COF образование пористых каркасов с водородными связями, основаны на нековалентных взаимодействиях. Эти структуры характеризуются отсутствием металлических узлов, обратимости образования водородных связей, хорошей термической стабильностью, развитой площади поверхности. COF отличаются стабильностью, большим количеством свободных активных сайтов для связывания активных молекул и наличием π-электронов. Сочетание COF и MOК (COF/MOК, МОК/СОF) по типу «ядро-оболочка» (core-shell) может продемонстрировать беспрецедентные синергетические характеристики и успешно использовать их во многих приложениях. Например, фоточувствительные датчики МОК и ковалентные органические каркасы позволили создать высокочувствительные биосенсоры для детекции вирусных ДНК/РНК с низким пределом обнаружения патогенных вирусов [10-13]. Углеродные наноматериалы с различными размерами наночастиц широко используются для приготовления гибридных нанокомпозитов на основе металлоорганических каркасов, в том числе одномерных углеродных нанотрубок (УНТ), двумерных структур графена, оксида графена (GO) и его восстановленной структуры (rGO). Изучение и развитие двумерных 2D-наноматериалов продемонстрировали огромный потенциал в различных областях применения и открыли новые возможности для создания инновационных решений в области биомедицины, что подчеркивает важность дальнейших исследований в этом направлении. COF-датчики обладают большой площадью поверхности, что обеспечивает множество модифицируемых сенсорных участков, повышающих чувствительность, скорость отклика и диапазон обнаружения аналитов с применением FET-датчиков на полевых транзисторах. Более того, сигнал, возникающий в результате распознавания целевого аналита элементом биораспознавания, может быть усилен с помощью физических, химических или биологических методов, что значительно повышает чувствительность обнаружения целевых молекул. Гибридные наноструктуры МОК/COF являются перспективными носителями для адресной доставки лекарств. В отличие от традиционных методов доставки лекарств новые пористые материалы обладают преимуществом в инкапсуляции лекарств в своих порах и способностью высвобождать эти лекарства в течение длительного времени [3, 15, 16]. 1. МЕТАЛЛООРГАНИЧЕСКИЕ КАРКАСЫ Как уже было отмечено выше, металлоорганические каркасы (MOК) представляют собой пористый органо-неорганический гибридный материал, состоящий из ионов или кластеров металлов в качестве узлов и органической части в качестве линкеров посредством ковалентных и координационных связей [17]. Они обладают уникальными свойствами, такими как простота синтеза, разнообразие в структуре (более 100000 структур согласно Кембриджской базе данных кристаллов и миллионы возможных структур MOК прогнозируются in silico) [18, 19], характеризуя высокую Sуд.площадь поверхности, настраиваемую пористость, настраиваемые размеры и уникальные оптические и электронные свойства. Поверхность MOК можно легко модифицировать с высокой клеточной биосовместимостью. Они широко используются в биомедицине рака и других заболеваний, включая тераностику и диагностику, а также для многофункциональных приложений, вызывающих синергетический эффект [17]. В настоящее время новые применения МОК в качестве ключевых компонентов в области новых медицинских материалов привлекают особое внимание. Металлоорганические каркасы (МОК) синтезированы путем самосборки металлических узлов и органических лигандов посредством координационных взаимодействий. Среди множества методов классификации MOК (рис. 1) [20, 21], представлены изоретикулярные металлоорганические каркасы (IRMOF) [9, 10], цеолитно-имидазолатные каркасные материалы (ZIF) [22] и пористые координационные сети (PCN) [9]. Другая классификация MOК включает название университета или института. Например MOК Института Лавуазье (MILs) [8, 23] и Университета Осло (UiOs) [5, 9], HKUST-n представляют Hong Kong University of Science and Technology (Гонконгский университет науки и технологий) [9], NOTT-n - University of Nottingham (Ноттингемский университет), NU-n - Northwestern University (Северо-Западный университет) и т. д. IRMOF представляют собой самособирающиеся материалы группы [Zn4O]6+, содержащие ряд ароматических карбоновых кислот, в качестве лигандов с октаэдрической структурой [10].
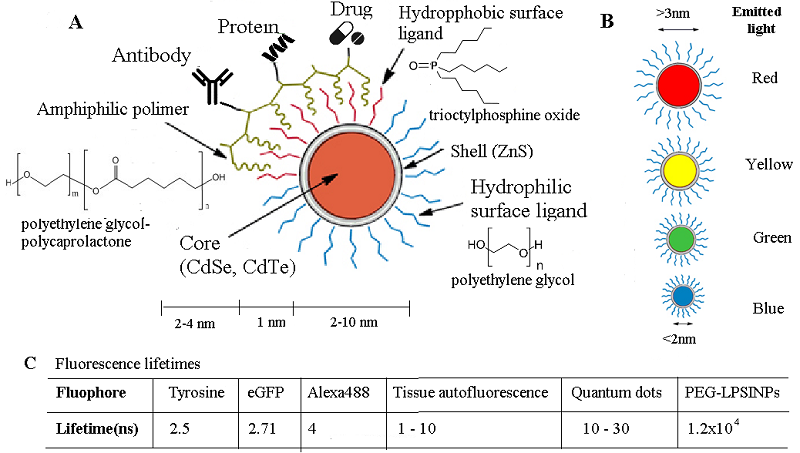
ZIF представляют собой цеолитоподобные конструкционные материалы, синтезированные реакцией Zn2+ или Co2+ и имидазольных лигандов [9, 20]. Материалы MIL формируются с использованием элементов переходных металлов и лигандов двухосновных карбоновых кислот. РСN обладают множественными кубическими октаэдрическими нанокаркасами, которые могут образовывать пространственную структуру с топологией порового канала [23, 24]. UiO образуются в результате реакции Zr-содержащего правильного октаэдра [Zr6O4(OH)4] и лиганда фталевой кислоты [25]. Методы синтеза материалов МОК включают традиционный метод реакции в растворе, гидротермальный (сольвотермальный) методы, включая нагрев с помощью микроволнового излучения, метод диффузии и механическое измельчение, метод микрожидкостного синтеза [9, 26]. Последние достижения в области нанотехнологий привели к разработке ряда диагностических устройств, содержащих наночастицы, которые обеспечивают несколько преимуществ по сравнению с обычными диагностическими платформами. Металлоорганические каркасы (MOK), построенные с помощью органических линкеров и металлических узлов, представляют собой новый класс кристаллических пористых материалов со значительными потенциальными возможностями применения. MOK, получили обширные исследования в качестве универсальной платформы для функциональных приложений во многих областях исследований [27, 28]. Металлоорганические каркасы (MOК) оказались очень эффективными носителями для доставки лекарств в различных биологических приложениях. При этом одной из важнейших прикладных областей в генной инженерии и терапии является создание систем для доставки генетического материала в клетку [29, 30]. Так, широко используемый для иммобилизации биокомпонентов цеолитоподобный имидазолатный МОК ZIF-8 на основе цинка показал высокую эффективность для доставки белков [31, 32], углеводов [33-36], вирусов [37] и клеток [38, 39], а также плазмидной ДНК, микроРНК [40, 41], нуклеопротеинов и компонентов систем редактирования генома [42-45]. В последние годы разработка гибридных наноструктур МОК на основе КТ, достигла значительного прогресса, что позволило создавать инновационные нанокомпозиты с высокопористой структурой и низкой токсичностью, которые можно использовать для изготовления гибридных наноструктур типа ядро-оболочка, путем объединения дополнительных материалов. Существенным преимуществом МОК [29] является взаимодействие с клетками млекопитающих, которые способны подвергать эти полимерные композиты эндоцитозу, что обеспечивает эффективность введения инкапсулированных комплексов или композитов, содержащих целевые молекулы, в клетки-мишени, и в значительной степени облегчает процесс использования этих материалов без применения дополнительной модификации, обеспечивая высокую биосовместимость. Была разработана система доставки лекарств с использованием МОК, COF, которые реагируют на определенные стимулы окружающей среды, такие как pH, температура с целью повышения эффективности лекарств и снижения побочных эффектов. Другим важным фактором, облегчающим адресную доставку, является способность МОК защищать лекарственные препараты или генетический материал от деградации в биологической жидкости и обеспечивать его контролируемое высвобождение [30]. Сейчас мы находимся на пороге ренессанса в этой важной для медицины области знаний, и назрела необходимость обобщения полученных в последнее время результатов и дать прогноз дальнейшего развития. В целом следует констатировать, что интерес к использованию КТ в медико-биологических исследованиях и диагностике постоянно растет и развивается. 2. БИОМАРКЕРЫ, БИОРЕАГЕНТЫ И ДЕТЕКТИРУЮЩИЕ МЕТКИ ДЛЯ ИХ ОБНАРУЖЕНИЯ 2.1. Биомаркеры заболеваний и инфекций Содержание различных белков зависит от состояния организма, и ряд из них может использоваться в качестве биомаркеров заболеваний и выявления патологий. В инфекционных заболеваниях в качестве антигенов выступают вирусы, бактерии или молекулы, на которые организм вырабатывает антитела в ходе иммунного ответа при появлении их в организме. Большинство клинически значимых биомаркеров содержатся в крови на уровне пять-семь порядков ниже концентраций самых распространенных белков плазмы [46]. Следует учитывать, что для достоверной диагностики заболевания в сложной биологической среде необходимо одновременно определять несколько биомаркеров, т.е. осуществлять мультиплексный анализ. В настоящее время эта проблема может решаться с использованием cовременных молекулярно-биологических методов и иммунологических подходов [17, 47]. 2.2. Биореагенты на основе антител и их аналогов Основными источниками биореагентов для иммунохимического анализа являются поликлональные антитела, получаемые технологией гипериммунизации, моноклональные антитела, в основе получения которых лежит гибридомная технология, рекомбинатные белки и пептиды, миниантитела, получаемые в основном по технологии фагового дисплея [48-50]. В последнее время в качестве биореагентов начинают использоваться нуклеотидные и пептидные аптамеры получаемые в результате направленной селекции широкого набора исходных биополимеров [51-53]. Использование высокоэффективных технологий фаговых дисплеев и мишень-специфичных аптамеров позволяет получать комбинаторные библиотеки пептидов, белков и полинуклеотидов высокой специфичности без стадии иммунизации животных, что снижает затраты на разработку и производство необходимого широкого набора высокоспецифичных биореагентов тест-систем [48, 49, 54-56]. Новые технологии, позволяющие детектировать уникальные молекулярные биомаркеры из стандартных образцов биологического материала (например, крови, мочи и слюны), революционизируют диагностику заболеваний и прецизионную медицину. Общей тенденцией современных исследований в диагностике связано с поиском новых стратегий получения модифицированных материалов, реконструированных биологических систем и синтеза соединений, которые проявляют свойства рецепторов биоаналитов, катализаторов и соединений, обеспечивающих селективность детектирования и формирование детектирующих сигналов. Использование антител, антигенов, молекулярно-биологических маркеров заболеваний широко представлены в современных диагностических тестах, включая экспресс-варианты. Современный молекулярный дизайн и генная инженерия позволяют решить многие проблемы, связанные с созданием биоспецифических антител, придавая им необходимые свойства, такие как биосовместимость, специфичность, стабильность, растворимость и т.д. [57-59]. В последние годы активно развиваются новые экспериментальные методы гибридизационного анализа для выявления ДНК. Как эффективная платформа амплификации, ПЦР-анализ использовался для чувствительного обнаружения широкого спектра аналитов, включая нуклеиновые кислоты, белки, небольшие молекулы и клетки. Основу метода составляет универсальный флуоресцентный сенсор (датчик) на основе нанокластеров серебра и оксида графена (AgNCs/оксида графена (GO), который был разработан для обнаружения ДНК без меток посредством гибридизационной цепной реакции (HCR) [46, 60]. Биосенсоры на основе аптамера среди многочисленных применений имеют исключительные преимущества по сравнению с природными рецепторами, такими как антитела и ферменты. В качестве молекул-мишеней могут выступать небольшие органические молекулы (аминокислоты, нуклеотиды, различные метаболиты), пептиды, белки, нуклеиновые кислоты, полисахариды, вирусные частицы, целые клетки [57-59, 61]. Получение аптамеров является важным направлением при создании высокочувствительных методов экспресс-диагностики. Для дизайна эффективных конъюгатов биореагентов с детектирующими метками важны знания общих особенностей структуры этих биомолекул, связанные с распределением участков связывания антигенов или биомаркеров на поверхности биореагентов [61]. 2.3. Детектирующие (сигнальные) метки для биореагентов Большинство современных методов биомедицинских исследований и диагностики основано на использовании флуоресцентных меток, в качестве которых могут выступать молекулярные флуорофоры, КТ, наночастицы (НЧ) металлов и кремнезема [62, 63]. КТ представляют собой люминисцирующие полупроводниковые нанокристаллы, характерный размер которых лежит в диапазоне 1-20 нм. В качестве материала для создания КТ, флуоресцирующих в видимой и ближней ИК (БлИК) области, наиболее часто используют композиции элементов II – VI групп (CdSe, CdTe, CdS и ZnSe), III – V групп (InP и InAs), а также IV-VI, I-III-VI, I-II-IV-VI и I-IV-VII групп (CuInS2, Cu2ZnSnS4, CsPbBr3) Периодической таблицы химических элементов Д. И. Менделеева. Благодаря квантово-размерному эффекту, КТ обладают широким спектром поглощения, узким и симметричным пиком флуоресценции, высокими значениями квантового выхода (КВ) и непревзойденной фотостабильностью. В соответствии с элементным составом КТ подразделяются на 12 типов: IB - VIA (например Cu2S), IB - VIIA (например AgBr), IIB - VIA (ZnTe, ZnSe, ZnS, ZnO, CdS, CdSe, CdTe, HgTe, HgSe, HgS), IIIA - VA (AlSb, AlAs, AlP, GaSb, GaAs, InGaAs, InAs, InP, InN), IVA - VIA (PbS, PbSe, PbTe), IVA (C, Si, графен), VA (черный P), IB – IIIA - VIA (CuInS2, CuInSe2, AgInS2), Pdots (точки полупроводникового полимера), дихалькогениды переходных металлов TMDC (TiS2, TiSe2, TaS2, MoS2, MoSe2, WS2, WSe2, ReS2), точки MXene состава Mn+1XnTz (M = переходные металлы; X = C и/или N; n = 1–3; Tz = F–, O2– и OH–), перовскитные КТ (MPbX3, где M = Cs или CH3NH3; X = Cl, Br или I). Традиционные типы КТ ядро-оболочка состоят из двух частей, включая ядро из тяжелого металла и полупроводник с широкой запрещенной зоной [64, 65]. Ядро обычно состоит из полупроводников II–IV, IV–VI или III–V групп (например, CdTe, CdSe, PbSe, GaAs и GaN), которые покрыты оболочками, например, ZnS или SiO2, повышающими квантовый выход (КВ) [66, 67] (рис. 2). Классификация КТ может быть проведена по их полупроводниковым материалам. При этом можно выделить широкозонные оксидные полупроводники ZnO, TiO2 (ультрафиолетовый диапазон, 300-400 нм), среднезонные полупроводники А2В6 и А3В5 (видимый диапазон, 400-750 нм) и узкозонные полупроводники А2В4 (ближний ИК-диапазон – БлИК, от 650 до 900 нм) [68]. Относительно новыми видами КТ являются КТ на основе углеродных материалов: углерод [69, 70], графен [71] и наноалмазы [72, 73], кремния [74], золота [75, 76] и дисульфида молибдена [77]. Были разработаны водорастворимые Au-КТ – нанокластеры золота, инкапсулированные в поли(амидоамин)дендримеры, обладающие размерно регулируемой флуоресценцией в видимой и БлИК областях [36]. КТ/Au демонстрируют оптические и магнитные свойства, отличные от широко используемых НЧ коллоидного золота. Для целей биодиагностики важны видимый 400-750 нм и БлИК 800-900 нм (окно прозрачности крови и других биологических объектов) оптические диапазоны. За последнее десятилетие флуоресцентная визуализация в первом окне поглощения NIR (NIR-I, 700-900 нм) широко применялась при проведении фундаментальных исследований, доклинических и клинических исследованиях в медицине. NIR-I визуализация в области 700-900 нм характеризуется более глубоким проникновением в ткани при визуализации анатомических структур, метаболических процессов, а также при интраоперационном хирургическом удалении пораженных тканей. Основными преимуществами оптических меток является быстрое обнаружение, устойчивость к электрическим и магнитным помехам и высокая информативность [38]. По сравнению с органическими и другими люминофорами КТ обладают рядом преимуществ. Свойства КТ могут варьироваться в широких пределах, благодаря наличию большого набора полупроводниковых материалов, сочетании их с другими материалами и вариабельности возможных архитектур и размеров КТ [23, 78-81]. Все это обеспечивает эффективное использование КТ в качестве меток белков, полинуклиотидов и других биополимеров. КТ или их композиты, в отличие от полимерных композиций, позволяют преодолеть сложности проникновения через ГЭБ, вне- и внутриклеточных мембран и сохранения функциональной целостности инкапсулированных биоорганических соединений [78].
Оболочка КТ состоит из трех частей: гидрофобной, наночастиц, и дополнительной гидрофильной, обеспечивающей ее растворимость в воде и биодоступность для взаимодействия с биологичеки (физиологически) активными соединениями (рисунок 2). Для повышения степени растворимости КТ можно использовать, например, полипропиленгликоль или органические кислоты, содержащие тиольную группу [79]. Функционально активные группы могут быть связаны с оболочкой путем электростатического взаимодействия, ковалентного связывания, координационной связи или в результате адсорбции. Тип связи влияет на стабильность частиц и определяет их активность in vivo [80]. От степени деструкции в организме функциональной оболочки квантовых точек во многом зависит потенциальная токсичность синтезированных наночастиц [81]. Так несмотря на ряд преимуществ халькогенидные КТ характеризуются нежелательной токсичностью относительно живых клеток, тканей и организмов [82, 83]. Основная предполагаемая причина этой токсичности связана с выщелачиванием ионов кадмия из ядра. Поэтому для уменьшения токсичности было разработано новое поколение КТ, не содержащих кадмий, таких как кремниевые КТ (Si-КТ), КТ ближнего инфракрасного диапазона (КТ Ag2Se, КТ Ag2Sh, КТ InP), углеродные точки (C-точки), графеновые КТ (GQD). В эту же группу вошел кластер наночастиц Au/Ag/Cu, не содержащих кадмий [84]. По спектроскопическим свойствам КТ превосходят традиционные органические флуорофоры, отличаются фотохимической стабильностью, в 10–50 раз большими коэффициентами экстинкции, более длительным сроком службы, чем у люминесцентных красителей, сравнительно более узкими полосами излучения и в 10–20 раз более яркой люминесценцией [85-87]. Это позволяет проводить мультиплексную биовизуализацию с одним источником. Высокая фотостабильность полупроводниковых нанокристаллов в 100-4000 раз превышает фотостабильность лучших органических флуорофоров [88-90], что позволяет отслеживать отдельные вирусы в течение нескольких часов с высоким временным разрешением [85]. Mеханизм внутриклеточной доставки определяется комбинацией параметров, включая размер и поверхностный заряд наноносителя. Поскольку плазматическая мембрана заряжена отрицательно, считается, что положительно заряженные молекулы, иммобилизованные на поверхности КТ, облегчают их поглощение клетками в результате электростатического взаимодействия с мембраной. Bысокие коэффициенты экстинкции KT увеличивают яркость всей системы FRET и тем самым облегчают обнаружение аналитов с применением FRET при очень низких концентрациях и вплоть до уровня отдельных молекул [85]. Пептид RGD (аргинин-глицин-аспарагиновая кислота) специфически нацелен на интегрин αvβ3, который сверхэкспрессируется во многих типах опухолей во время ангиогенеза. Этот пептид конъюгировали с КТ, используемые в качестве NIR-зонда для визуализации опухолей in vivo [87]. Общая структура биовектора была создана путем прикрепления пептида RGD и противоопухолевого препарата доксорубицина (Dox) к поверхности КТ, излучающих в ближнем ИК-диапазоне, для одновременной визуализации и лечения [91]. С открытием квантовых точек появились впечатляющие перспективы развития генетики и молекулярной биологии, медицины и экологии. Наибольшее практическое применение получили наиболее легко синтезируемые «сферические» КТ. В биомедицинских исследованиях чаще всего используют КТ, состоящие из ядра и одного или нескольких слоев различных полупроводников, в которых реализуются гетеропереходы [88-90], а также нанокомпозиты КТ с другими активными материалами, такими как углеродные наноматериалы (углеродные точки, углеродные КТ, графен и его производные, металлоорганические каркасы) (рис. 3) [91].
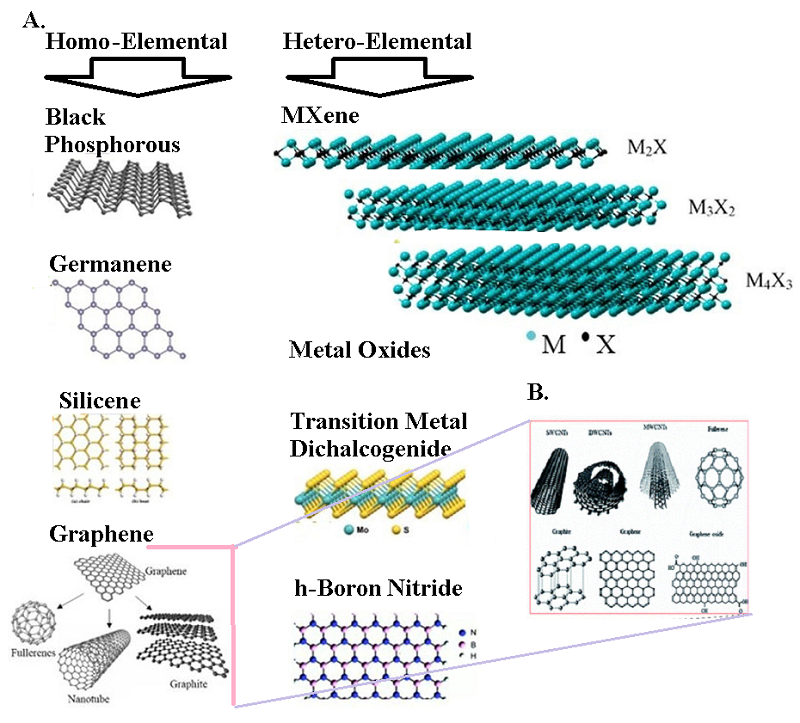
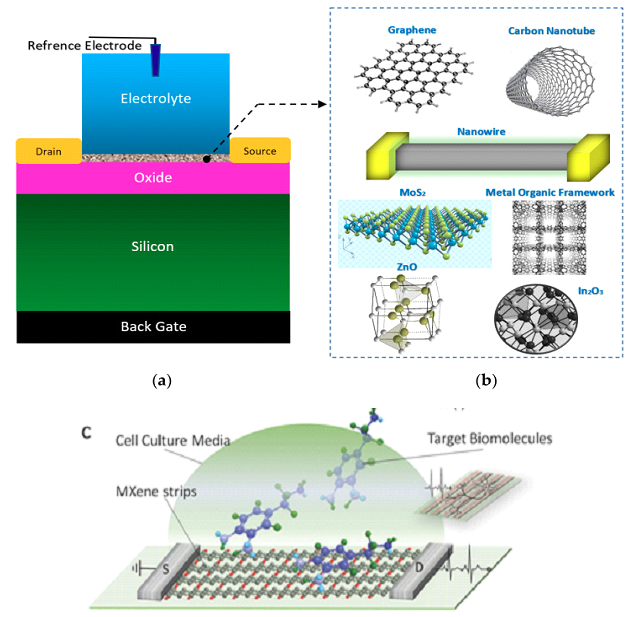
2D-материалы представляют собой однослойные или многослойные материалы, состоящие из одного или нескольких элементов толщиной в несколько нанометров. Их уникальные, настраиваемые физические и химические свойства, включая простоту химической функционализации, делают этот класс материалов полезным в различных технологических приложениях. Возможность использования 2D-материалов в значительной степени зависит от новых синтетических подходов, способствующих улучшению свойств, повышению производительности, долговечности и снижению затрат при производстве. Так при синтезе 2D-наноматериалов широко применяются гидротермальные процессы через путь синтеза прекурсора-продукта. Этот метод включает в себя системы периодического или непрерывного потока. Оба метода дают частицы с различной морфологией, размером и площадью поверхности из-за различных механизмов образования частиц. Периодический и непрерывный гидротермальный поточный синтез успешно применялся при получении ряда двумерных производных (графена, MXene и дисульфида молибдена), включая их химическую функционализацию, как выгодный подход к исследованию свойств этих материалов и перспективы дальнейших исследований [91]. 2.4. Технология полевых транзисторов на основе углеродных наноматериалов для обнаружения биомаркеров Интенсивное развитие технологии создания полевых транзисторов непосредственно связано с использованием уникальных свойств новых наноматериалов в качестве преобразователей FET. Материалы для датчиков являются одними из наиболее важных компонентов, которые необходимо учитывать при изготовлении биосенсоров на полевых транзисторах. Среди наиболее привлекательных наноматериалов, вызывающих особый интерес, являются наноматериалы на основе кремния (кремниевые нанопроволоки - SiNW), дихалькогенидов переходных металлов [92, 93] и углеродные (двумерные материалы, такие как графен, графеновые наноленты, окись графена, углеродные нанотрубки, включая многослойные углеродные нанотрубки (MWCNT) и однослойные углеродные нанотрубки (SWCNT), МОК, интеграция которых в структуру сенсорных каналов значительно улучшает характеристики биосенсорных устройств типа FET (рис. 4) [94-102]. Принцип действия биосенсоров на основе полевых транзисторов основан на изменении проводимости канала полевого транзистора, который формируется в полупроводниковой нанопроволоке (NW), путем изменения плотности свободных носителей заряда, вызванного модуляцией потенциала на поверхности сенсорного элемента при его взаимодействии с аналитом. Типичный датчик на основе полевого транзистора состоит из полупроводникового канала (SiNW p/n-типа) и трех электродов исток (S), сток (D) и электрод затвора (G). Oбласть между стоком и истоком функционирует как элемент биологического распознавания, который взаимодействует с целевым аналитом/биомолекулами и определяет их концентрацию и электрическую активность. SiNW-FET состоит из одного SiNW (или пучка SiNW), который подключен между электродом истока (S) и стока (D), уложенным на пластину Si. Электроды истока и стока взаимодействуют друг с другом через полупроводниковый канал, в то время как электрод затвора модулирует проводимость канала через приложенный электрический потенциал. Молекулы рецептора, иммобилизованные на SiNW (s), используются для распознавания конкретных мишеней с помощью биосенсора SiNW-FET (рис. 4).
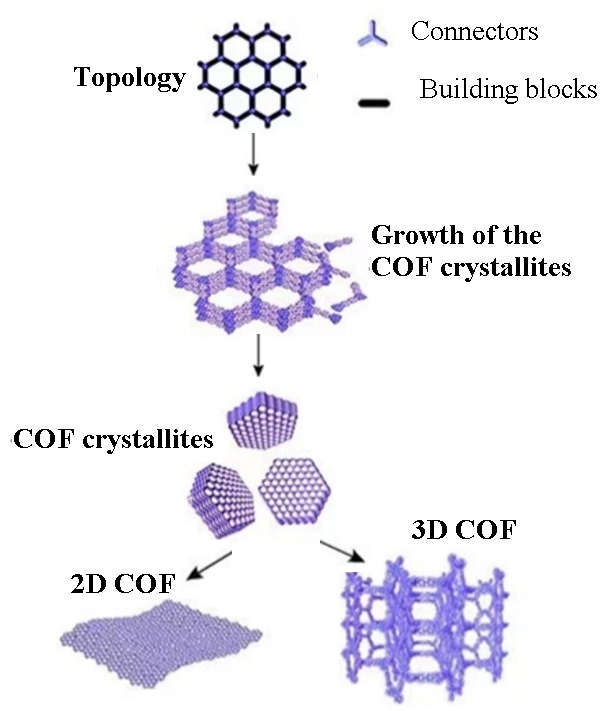
2.4.1. Дихалькогениды переходных металлов Атомно-слоистые дихалькогениды переходных металлов (TMDC) обладают значительным потенциалом для создания недорогих транзисторных биосенсоров следующего поколения, которые позволяют проводить количественную оценку биомолекул на уровне одной молекулы. MXene-графеновые датчики на полевых транзисторах были разработаны для обнаружения вируса гриппа и коронавируса со значительной химической чувствительностью за счет связывания антитела с антигеном для получения электрохимической передачи сигнала после осаждения вирусов на поверхность полупроводникового канала. Предел обнаружения составлял всего ~125 копий/мл для вируса гриппа и 1 фг/мл для рекомбинантного шиповидного S-белка 2019-nCoV [105, 106]. В ряде исследований показано, что включение MXenes и графеновых молекул в структуру датчиков позволяет получить пористые материалы с высокой способностью связывания ферментов и получить биосенсорные устройства с улучшенным сродством и стабильностью [107]. Эти соединения имеют большую ширину запрещенной зоны, чем графен, и превосходные характеристики, такие как большая площадь поверхности и высокая скорость переноса электронов [108, 109]. На основе Ti3C2-MXene-FET были разработаны высокочувствительные датчики (устройства) для обнаружения нейромедиаторов и зондирования потенциалов действия в первичных нейронах гиппокампа [104]. Биосовместимые полевые транзисторы (FET) были использованы для быстрого, прямого и безметочного обнаружения биологических маркеров различных заболеваний, представленных в таблице 1 [110, 111]. Взаимодействие между молекулой-мишенью и МXenes изменяет проводимость канала. Это изменение проводимости коррелирует с концентрацией целевой биомолекулы, и, таким образом, позволяет проводить количественное обнаружение биомолекул (табл. 1). Исследования показывают, что 2D-MXene на основе Ti3C2 (карбида титана), в частности, обладает большим потенциалом в качестве средства доставки лекарств. Его уникальная биологическая активность, ультратонкая двумерная структура и способность легко проникать в кровеносные сосуды делают его ценным инструментом в химиотерапии онкологических заболеваний [112]. Обнаружение опухолевого маркера углеводного антигена 125 (CA125) может быть улучшено c использованием биметаллических органических каркасов MOК (MIL-101(Fe)-NH2 и UiO-66-краситель) в структуре иммуносенсора. Был разработан универсальный подход синтеза однородных композитов MXene и MIL-101(Fe)-NH2, использующий преимущества обоих материалов [113]. MXene обладает превосходной электропроводностью и большой площадью поверхности, тогда как, мезопористый MIL-101(Fe)-NH2 увеличивает емкость при иммобилизации первичных антител к CA125 антигену и обеспечивает каталитическую активность благодаря металлическим центрам железа (Fe). Кроме того, UiO-66, модифицированный метиленовым синим (MB), использовали в качестве электрохимического иммуносенсора для обнаружения CA125. Этот иммуносенсор показал высокую чувствительность и низкий предел обнаружения (LOD) – 0.006 МЕ/мл. Эти характеристики делают его высоко перспективным для ранней диагностики онкомаркера CA125, повышающим эффективность терапевтических стратегий и улучшения клинических прогнозов. Дисульфид молибдена, представленный в виде монослойной или многослойной двумерной гексагональной кристаллической структурой, относится к биосовместимым материалам, обладает превосходными электрическими свойствами и широко используется при изготовлении полевых транзисторов и сенсорных устройств [114]. 3. НАНОПЛАТФОРМЫ МОК, COF И ИХ КОМПОЗИТЫ Различные наноматериалы, такие как, органические полимеры и неорганические пористые матрицы, были успешно разработаны для лечения рака и других биоприложений в медицине [115, 116]. Основным недостатком применения этих наноструктур является более низкая емкость, неконтролируемое высвобождение, что ограничивают их применимость. Для преодоления этих недостатков, были предложены и широко исследованы новые подходы, включающие использование пористых металло-органических соединений рамочной структуры (MOК), топология которых определяется геометрией лиганда, которые включали связывание органических молекул и ионов металлов (МОК) и ковалентных органических каркасов (COF), которые связывали органические молекулы. Отметим также большую привлекательность нового типа гибридныx наноматериалов на основе металлоорганических каркасов (МОК), характеризующихся высокой подвижностью заряда и проводимостью, высокой пористостью, однородными порами и каналами нанометрового размера, обладающие высокоразвитой структурой и возможностью проведения модификации поверхности [117-119]. 3.1. Пористые кристаллические органические полимерные материалы (COF) COF представляют новый класс пористых кристаллических органических полимерных материалов, которые синтезируются путем полимеризации органических мономеров, используемых в качестве строительных элементов (блоков), соединенных прочными ковалентными связями, и содержащих легкие элементы, такие как углерод (C), азот (N), кислород (O), водород (H) и бор (B). Разработка методов синтеза COFs основана на принципах ретикулярной химии. Формирование структуры COFs зависит от природы мономеров, что является отличительной особенностью каркасных структур COFs. Синтез COF можно настраивать и контролировать на атомном уровне. COF можно адаптировать для различных применений, изменяя размер и длину линкеров. COF обладают способностью реплицировать множество идентичных сайтов связывания в своей структуре, что позволяет эффективно преобразовывать и усиливать сигнал для достижения высокой чувствительности в биосенсорных устройствах. Сообщалось о получении флуоресцентных сенсоров на основе 2D COFs, связанных с усилением или тушением флуоресценции [120]. В настоящее время COF широко используются в качестве перспективной платформы в области биомедицины [121, 122], включая доставку лекарств [123, 124], биовизуализацию [125, 126], тераностику [127, 128] и экологию [129, 130]. Экологический мониторинг с применением COFs, помогает отслеживать и выявлять загрязняющие вещества в воздухе, воде и почве [129, 130]. Большая площадь поверхности COF обеспечивает эффективное взаимодействие с молекулами анализируемого вещества, облегчая их обнаружение при низких концентрациях. Объемные 2D COF синтезируются из их прекурсоров-мономеров различными методами, такими как сольвотермальный, микроволновый, ионотермический, сонохимический, механохимический и синтез с использованием паровой фазы. Ковалентные органические нанолисты (CON) готовятся из объемных 2D COF (синтезированных, как указано выше) путем отшелушивания с помощью растворителя, механического расслаивания или химического отшелушивания [131, 132]. Пористость 2D COF можно модулировать, настраивая геометрию пор, размер пор, схему укладки слоев и ориентацию пор, которые определяются выбором молекулярных строительных блоков и размерами линкерных молекул [131, 133]. Pасположение пор также определяют пористость 2D COF. Топология COF определяется размером и симметрией строительных блоков, а также связностью линкеров [134, 135]. В зависимости от топологического расположения строительных блоков COF делятся на двумерные (2D) и трехмерные (3D) (рис. 5) [136, 137].
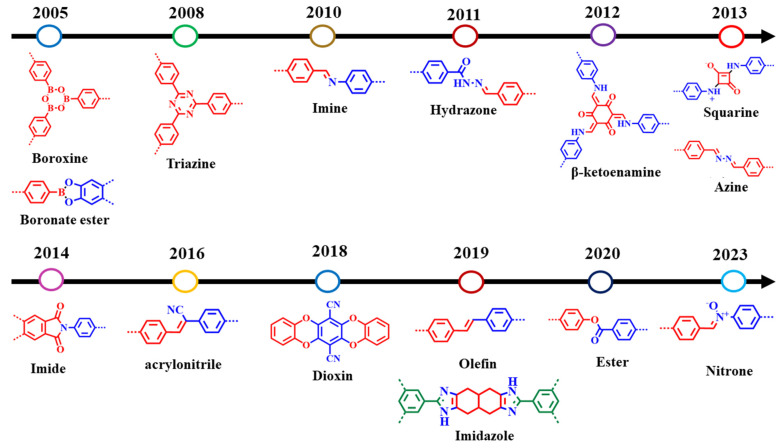
Наночастицы ковалентного органического каркаса с иминной связью (nCOF) были использованы для пероральной доставки инсулина в организм животного. Гастрорезистентный nCOF был приготовлен из слоистых нанолистов с инсулином, загруженным между слоями нанолистов. Нагруженный инсулином nCOF продемонстрировал защиту инсулина в пищеварительных жидкостях in vitro, а также высвобождение в ответ на глюкозу [138]. В перспективе, пероральные системы доставки инсулина на основе nCOF способны заменить традиционные подкожные инъекции, облегчая проведение инсулинотерапии. Разработанные методы синтеза соединений COF позволяют получать как 2D, так и 3D COF структуры [131, 133, 137]. Основу и разнообразие структур COF составляют большое количество химических соединений и образование стабильных связей, в том числе иминовых, образующиеся при конденсации альдегидов и аминов [134]. Иминные связи (основания Шиффа) являются наиболее распространенной стратегией синтеза, используемой для создания COF. Гидразиды обратимо конденсируются с альдегидами с образованием гидразонов, что позволяет использовать это соединение для синтеза COF [139]. Благодаря азиновой связи можно получить различные геометрии пор. Кето-енаминовые COF отличаются высокой химической стабильностью в кислых и щелочных средах [140]. Ковалентные триазин-каркасные структуры с настраиваемой пористостью и изменяемой структурой делает их перспективными для решения экологических проблем [141, 142].
Cуществует множество других способов образования COF, помимо перечисленных выше, эфирных, олефиновых и оксазольных, которые позволяют создавать значительное количество двумерных COF (рис. 6) [134]. COF на основе иминов можно разделить на две основные категории: с гидразоновой связью и с основанием Шиффа. Они различаются в зависимости от наличия связей -С=N. Изучение и развитие двумерных наноматериалов продемонстрировали огромный потенциал в различных областях применения, открывает новые возможности для создания инновационных решений в области биомедицины, что подчеркивает важность дальнейших исследований в этой области. Однако сложность их синтеза препятствует коммерциализации этих платформ и массовому производству [144, 145].
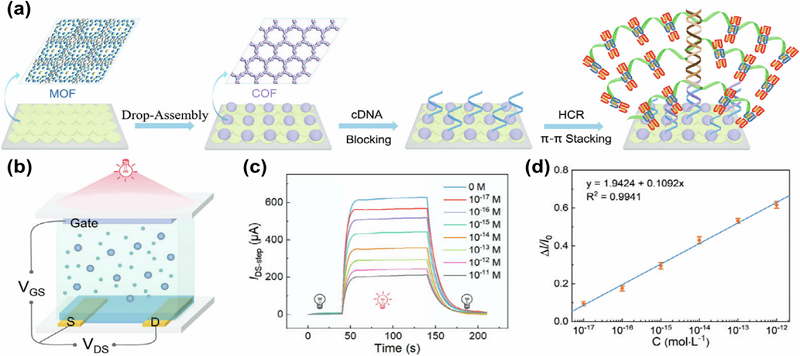
3.2. Полевой транзисторный датчик на основе COF/МОК Принцип функционирования FET-датчиков основан на селективном захвате целевых анализируемых веществ на модифицированной поверхности полупроводникового (сенсорного) канала. COF-FET датчики, благодаря своей развитой площади поверхности, предоставляют множество модифицируемых сайтов связывания (сенсорных участков), что значительно повышает чувствительность, скорость отклика и диапазон обнаружения аналитов FET-датчиков (табл. 2). При контакте целевого вещества с материалом COF происходит химическое взаимодействие, приводящее к изменениям в проводимости и переносе электронов. Эти изменения могут быть зарегистрированы по изменениям выходного тока или напряжения полевого транзистора, что позволяет осуществлять детектирование целевого вещества. Jin Q., и его коллеги усовершенствовали графеновый полевой транзистор (GFET), используя однородную мезопористую пленку COF с тиоэфирными связями. Это было достигнуто с помощью межфазной сольвотермической реакции (рис. 4a) [103-105]. Графен обладает высокой подвижностью и малой толщиной, что позволяет значительно повысить коэффициент усиления сигнала FET и обеспечивает уникальные преимущества при обнаружении сверхнизких концентраций анализируемых веществ. Тиоэфирные связи в структуре COF демонстрируют сильное взаимодействие с ионами ртути (Hg2+), в то время как другие ионы металлов (Na+, Zn2+, Mg2+, Fe3+, Pb2+, Ca2+, Cu2+ и т. д.) слабее связываются с тиоэфирами. Это позволяет добиться селективной адсорбции Hg2+. Обнаружение Hg2+ было успешно проведено в растворе, содержащем поли(3,4-этилендиокситиофен):полистиролсульфонат в концентрации примерно 30 частей на миллион. Предел обнаружения составил 10−10 М, а время отклика менее 50 мс, что сопоставимо с измерениями в незагрязненной среде. Результаты указывают на потенциальное применение COF в высокопроизводительных датчиках FET, устойчивых к загрязнению. В другой работе [146] Wang и соавт. использовали метод сверхкритического растворения в расплаве для выращивания фотоактивного слоя COF (COFTP-py) с функционализированными пиреновыми группами на графен-полевом транзисторе (GFET). Данный подход позволяет эффективно детектировать различные малые молекулы (рисунок 4b) [137, 146]. Пиреновые группы в составе COFTP-py способны поглощать энергию падающего света, генерируя значительное количество электронно-дырочных пар. Под воздействием встроенного электрического поля фотогенерированные электроны накапливаются на энергетическом барьере интерфейса в COFTP-py, в то время как фотогенерированные дырки диффундируют в графен. Накопленные электроны функционируют как локальные затворы, увеличивая ток в графеновом канале через механизм емкостной связи. Кроме того, авторы повысили чувствительность определения малых молекул за счет фотохимического эффекта. При освещении COFTP-py/графеновый хемотранзистор продемонстрировал возможность обнаружения низкомолекулярных аналитов (метилглиоксаля) при концентрации 10-19 М, что на пять порядков ниже по сравнению с существующими технологиями. Ниже приведена таблица использования гибридных структур для выявления нуклеиновых кислот, характеризующих различные заболевания. МикроРНК (миРНК) представляют собой перспективные биомаркеры для ранней диагностики онкологических заболеваний благодаря их высокой специфичности и различиям в уровнях их экспрессии при разных типах рака (например, рак легких, молочной железы и рака простаты) и на разных стадиях онкогенеза. Они действуют как супрессоры и промоторы опухолей во многих аспектах автономного поведения раковых клеток, а также играют важную роль не только как биомаркеры опухолевых заболеваний, но и рассматриваются в качестве эволюционных биомаркеров микроокружения опухоли Уровень экспрессии миРНК может использоваться в качестве прогностического маркера для ранней диагностики и терапии [137, 156, 157, 160]. Однако количественная оценка микроРНК затруднена из-за их низкой концентрации и высокой гомологичности в биологической жидкости (моча, кровь, слюна и др.). МиРНК составляют лишь несколько процентов от общего количества РНК в плазме, что требует разработки чувствительных биосенсоров для их обнаружения. Недавно были разработаны высоко чувствительные биосенсоры, основанные на методах электрохимического усиления сигнала, которые позволяют сократить время анализа до 80 мин и обеспечивают мультиплексное обнаружение микроРНК-21 и микроРНК-141. Hou и соавт. использовали гетеропереход MOK/COF/CdS KT в качестве фотовольтаического затвора для создания OPECT-устройства, предназначенного для детекции нейрон-специфической енолазы (NSE) — важного биомаркера онкологических заболеваний. Разработанный сенсор обеспечивал линейный диапазон детекции от 0.1 пг/мл до 100 нг/мл с пределом обнаружения 0.033 пг/мл [152]. Аналогичным образом, Ding и соавт. разработали фотоэлектрохимический датчик OECT-PEC. Основу датчика составили нанокомпозиты PEDOT/Fe-MOF, используемые в качестве фотоактивного запирающего материала. Этот биосенсор был применен для детекции фосфорорганического пестицида малатиона с использованием аптамера, как молекулярного распознающего элемента. Предел обнаружения составил 0.03 нг/л, что свидетельствует о высокой чувствительности системы [153]. В последние годы OECT/OPECT-биосенсоры на базе MOК/COF демонстрируют устойчивый рост внимания в области выявления макромолекул. Например, Cai и соавторы [154] разработали наноструктурированные массивы диоксида титана (TiO2 NRs), покрытые MOК с высокой концентрацией гидроксильных групп (U6H@TiO2 NRs). На их основе был сконструирован светочувствительный электрод, обладающий высокой селективностью и чувствительностью.
PEDOT – проводящий полимер поли(3,4-этилендиокситиофен) (PEDOT) и его комплекс с поли(стиролсульфоновой кислоты) (PEDOT:PSS) представляют собой гибкие органические проводники, растворимые в воде, и обладающие высокой проводимостью. Эти соединения обычно используются в качестве активного слоя (ионно-селективных датчиков) в биосенсорных устройствах типа OECT (органические электрохимические транзисторы). Этот электрод был интегрирован в систему OPECT для детектирования билирубина (I-Bil). Прочное связывание между U6H@TiO2 NRs и I-Bil обеспечивалось посредством координационных взаимодействий, водородных связей и π-π-стекинга, что позволило достичь точного контроля интенсивности сигнала (I-D). Устройство продемонстрировало линейную зависимость в диапазоне от 1×10-16 - 1×10-9 М с пределом обнаружения 0.022 фМ [154]. Разработка чувствительного метода обнаружения SARS-CoV-2 имеет большое значение для сдерживания пандемии. В этой работе был сконструирован биосенсор на основе графенового полевого транзистора (g-FET), который прлодемонстрировал сверхчувствительное обнаружение антител к SARS-CoV-2 с пределом обнаружения (LoD) до 10–18 М (что эквивалентно 10–16 г/мл). g-FET-транзисторы модифицированы белками шипа S1, и биологическое распознавание антител к SARS-CoV-2 происходит вблизи поверхности графена, что позволяет обнаружить ∼150 антител в 100 мкл цельной сыворотки, что является самым низким значением LОD при обнаружении антител. Время диагностики сокращается до 2 мин при проведении анализа клинических образцов сыворотки. Таким образом, g-FET-транзисторы обеспечивают быстрый и точный скрининг SARS-CoV-2, а также открывают большие перспективы для предотвращения и контроля других эпидемических вспышек в будущем [155]. Xu и соавт. разработали новый гибрид MOК@COF с превосходной электрохимической активностью и высокой фотоактивностью [28]. Иммобилизовав комплементарную последовательность зонда ДНК ВИЧ-1, можно использовать гибрид MOК@COF для обнаружения ДНК ВИЧ-1, поскольку комплементарная гибридизация повышает импеданс гибрида и снижает как фотоэлектрохимические (PEC), так и электрохимические токи (EC) биосенсора. Таким образом, можно добиться двухрежимного обнаружения ДНК ВИЧ-1 в сыворотке крови человека. Было обнаружено, что оба тока линейно уменьшались с увеличением ДНК ВИЧ-1 в диапазоне от 1 фМ до 1 нМ, а предел обнаружения составил 0.07 и 0.18 фМ для методов PEC и DPV соответственно, что указывает на сверхчувствительное определение целевых молекул ДНК ВИЧ-1 [156]. Другие исследователи использовали никель-металлоорганический каркас (Ni-MOК), золотые наночастицы, углеродные нанотрубки и поливиниловый спирт для создания гибкого бумажного электрода, способного обнаруживать ДНК ВИЧ. Плeнки CNT/PVA были нанесены на целлюлозные мембраны с помощью вакуумного фильтра, а затем на них были нанесены композитные материалы Ni–Au методом капельного литья. Это позволило создать гибкую композитную мембрану. Плeнка CNT/PVA, расположенная рядом с целлюлозной мембраной, обеспечивает хорошую проводимость и биосовместимость. В то же время композит Ni-MOF/Au (наночастицы Au) с сопряженной системой π-электронов и большой площадью поверхности позволяет загружать больше зондовой ДНК, что повышает чувствительность сенсора. Датчик продемонстрировал широкий линейный диапазон обнаружения (10 нМ–1 мкМ) и низкий предел обнаружения 0.13 нМ с высокой специфичностью для полностью комплементарной целевой ДНК ВИЧ. Он также показал хорошую воспроизводимость и долгосрочную стабильность в использовании [161]. С-реактивный белок (СРБ) – это сферический пентамерный белок, синтезируемый в основном в печени, является ключевым регулятором воспаления. Повышенные уровни СРБ в крови являются четким индикатором воспаления после повреждения тканей, что делает его неспецифическим диагностическим биомаркером ревматоидного артрита и других воспалительных состояний. Shui и соавт. [162] разработали высоко производительный аптасенсор для обнаружения СРБ на основе композитов AuNPs@C-ZIF67. Ромбический додекаэдрический карбонизированный композит C-ZIF67, загруженный золотыми наночастицами, служил в качестве сенсорной платформы, обеспечивая большую площадь поверхности и превосходную производительность переноса электронов. Меченные пероксидазой хрена антитела к СРБ (HRP-AbCRP) были введены в качестве зондов обнаружения для обеспечения специфичности сенсора. Механизм усиления сигнала, катализируемый ферментом, дополнительно повысил чувствительность и интенсивность сигнала электрохимического биосенсора. После оптимизации сенсор продемонстрировал линейный диапазон обнаружения от 10 пг/мл до 10 мкг/мл с пределом обнаружения 0.44 пг/мл (S/N = 3). Кроме того, он позволил быстро обнаруживать СРБ в образцах человеческой плазмы в течение 5 мин. Дофамин является ключевым нейротрансмиттером и нейромодулятором, играющим двойную роль в патогенезе нейродегенеративных заболеваний. Мониторинг уровня дофамина в системе in vivo имеет критическое значение для диагностики и профилактики нейродегенеративных заболеваний. Функционально устройство на основе MXene может обнаруживать дофамин в концентрации порядка 100×10−9 М, что значительно ниже, чем во многих ранее опубликованных результатах с использованием биосенсоров на основе графена. Биосенсор MXene-FET успешно прошел испытания при длительном культивировании нейронов и для изучения биологических процессов в клеточной модели. Созданный биосенсор на основе MXene позволяет отслеживать активность нейронов в культуральной жидкости в режиме реального времени [163]. Ряд опубликованных работ связан с созданием сенсоров на основе наноматериалов (квантовых точек, углерода и металлов) для обнаружения различных аналитов. Включение КТ в наноструктуру обеспечивает количественное флуоресцентное считывание аналитического сигнала, отражающего опосредованно взаимодействие аналита с сигнальными зондами ДНК в виду проявления FRET. Диагностика ВИЧ-инфекции и ее усовершенствование постоянно привлекает исследователей. Zhou и соавт. [127] разработали инновационный биосенсор, который позволяет обнаруживать ВИЧ в низкой концентрации в биологической жидкости. Этот сенсор использует два режима работы: электрохемилюминесцентный (ЭХЛ) и фотоэлектрохимический (РЕС, ФЭХ). В качестве фоточувствительных материалов в сенсоре используются 3D квантовые точки CdSe (КТ). Они соединяются с функционализированной ДНК-наносетью наноцветком SnO2, который служит подложкой для PEC. КТ SnO2 и CdSe образуют каскадную полосу, которая способствует эффективному переносу фотогенерированных носителей. Для повышения чувствительности сенсора была использована стратегия каскадной амплификации двуногого ДНК-ходока. Это позволило генерировать большое количество цепей ДНК и прикреплять многочисленные сигнальные зонды и квантовые точки к электроду. Датчик достиг линейного диапазона обнаружения от 0.5 мкМ до 5 фМ и предела обнаружения 1.38 фМ. При этом он обладает превосходной специфичностью, стабильностью и потенциалом для практического применения [167]. В другой работе нанокомпозит Zr-тримезиновой кислоты MOF (MOF-808) с углеродной нанотрубкой (CNT) был синтезирован посредством in situ формирования MOК-808 на активированной CNT. Большая площадь поверхности и электрокаталитическая способность MOК-808 была использована для создания иммуносенсора для сверхнизкоуровневого обнаружения биомаркера рака яичников углеводного антигена 125 (CA 125). В качестве платформы для изготовления безметочного электрохимического иммуносенсора использовали стеклоуглеродный электрод, модифицированный MOК-808/CNT. Сайты связывания антител MOК-808/CNT были модифицированы стрептавидином. Иммуносенсор имел два линейных диапазона определения 0.001–0.1 нг/мл и 0.1–30 нг/мл, расчетный предел обнаружения составил 0.5 пг/мл (S/N 3). Иммуносенсор показал превосходную воспроизводимость и селективность [168]. Гибридный нанокомпозит на основе терефталонитрила (TPN-COF)/CNT в Ce-MOК, представляет собой синергетическую комбинацию компонентов, оптимизированную для детектирования раково-эмбрионального антигена 125 (CA125) без использования меток. Водородные связи и специфическое взаимодействие между лигандом тримезиновой кислоты и триазиновым кольцом на углеродном пастообразном электроде (CPE), модифицированном комплексом Ce-MOК/TPN-COF/CNT, способствуют (стимулируют) образованию иммунокомплексов, усиливая токовую реакцию и повышая чувствительность сенсорной системы. Таким образом удалось достичь низкого предела обнаружения ракового биомаркера СА125 порядка 0.000088 МЕ/мл с широким линейным диапазоном от 0.0001 МЕ/мл до 100 МЕ/мл [170]. Электрохимические аптасенсоры на основе MXene показали большие перспективы в выявлении биомаркеров рака и вирусных инфекций с пределом обнаружения на уровне фМ концентрации. [113, 168-171]. Платформа для высокочувствительного детектирования РНК вируса Зика на основе технологии ECL-РНК (переключаемой электрохемилюминесценцией) разработана в работе Zhang и соавт. [172]. Система включает металлоорганический гель на основе Zr-MOG, с AuNPs, графитоподобный нитрид углерода gC3N4 (AuNPs&g-C3N4@Zr-MOG) и металлоорганического каркаса (Fe-MIL-88 MOК) в качестве электродной матрицы и нанометки соответственно. Платформа была биофункционализирована с помощью сенсорной ДНК, помеченной Fe-MIL-88 MOК для усиления сигнала. Большая площадь поверхности каркасного геля (MOG) позволяет иммобилизовать значительное количество молекул ДНК-зондов, повышая чувствительность биосенсора. В присутствии целевой РНК специфическое расщепление комплекса осуществляли с помощью эндонуклеазы IV (Endo. IV), что приводило к высвобождению нанометки и включению сигнала ECL. Линейный диапазон составил 0.3 нМ–3 мкМ, предел обнаружения 100 пМ [172]. В другом исследовании для детекции ZIKV, был разработан иммуносенсор, содержащий квантовые точки CdS, модифицированные 3-меркаптопропионовой кислотой (MPA@CdS QDs), которые выступают в роли меток для ECL, и микросферы из диоксида кремния, выполняющие функцию носителя. Одним из ключевых преимуществ данного подхода является высокая надежность генерируемых ECL-сигналов, что позволяет их визуализировать с использованием смартфонов. Новая платформа, основанная на иммуноанализе типа «сэндвич» варианта, позволяет количественно определять ZIKV в диапазоне 1.0 фг/мл–1.0 нг/мл с пределом обнаружения 0,3 фг/мл [173]. Yang и соавт. [174] использовали MOК-наночастицы циркония, функционализированные нуклеиновыми кислотами (Zr-MOК), для разработки одноразовой бумажной электрохимической сенсорной платформы для одновременного обнаружения экзосомных микроРНК-155 и микроРНК-21 без использования меток и ферментов. Специфическое распознавание различных микроРНК было достигнуто путем модификации структуры Zr-MOК с помощью красителей и шпилечной ДНК. Пределы обнаружения экзосомальных микроРНК-155 и микроРНК-21 составили 33,4 аМ и 23,1 аМ соответственно [174]. Полученные результаты подчеркивают значительный потенциал комбинирования MOК/COF с технологией OECT/OPECT для разработки высокопроизводительных биосенсорных систем. Данное направление исследований открывает новые перспективы в области аналитической химии и биомедицины, способствуя созданию инновационных инструментов для диагностики и мониторинга различных заболеваний. Один из способов прямого синтеза COF [137] связан с модификацией и введением производных серы, используя реакцию клик-химии. Полученные соединения продемонстрировали впечатляющую адсорбционную емкость (1350 мг/г) и коэффициент распределения (KD = 2.3×109 мл/г) для высокотоксичных ионов Hg2+. В другой работе структура COF (TPB-DMTP-COF-SH) синтезирована путем введения тиольных групп в COF с реакционно этинильными группами также через реакцию клик-химии. Высокая адсорбционная емкость для ртути составила 4395 мг/г, а чрезвычайно быстрая кинетика адсорбции реагентов в этой реакции составила порядка 2 мин. В таблице 2 представлены электрокаталитические характеристики различных электрохимических биосенсоров на основе функциональных молекул, содержащие МОК, COF для обнаружения раковых биомаркеров и других аналитов, открывая новые возможности для чувствительного обнаружения биомолекул при диагностике заболеваний и биоанализе.
3.3. Органические каркасы с водородными связями Впервые водородно-связанные органические каркасы (HOF) были предложены в качестве потенциальных пористых материалов более двух десятилетий назад. В 2019 году Liang и соавт. [189] синтезировали и охарактеризовали новый первый класс биокомпозитов на основе водородно-связанных органических каркасов. Водородно-связанные органические каркасы (HOF) представляют собой последнее поколение ретикулярных материалов (рис. 7). Полученные путем сборки органических молекул (единиц), каркасы HOF включают как чистые органические, так и металлосодержащие органические фрагменты, посредством прочных водородных связей. Hаноматериалы HOF обладают хорошей биосовместимостью и минимальной токсичностью, что непосредственно связано с их неметаллическими характеристиками Отличительные характеристики водородных связей характеризуют различия между HOF, MOК и COF. Конструкция молекулярных строительных блоков играет решающую роль в определении пористости, топологии и стабильности HOF. Так набор HOF, а именно HOF-2 [190], HOF-3 [191], HOF-5 [192], HOF-6 [193], HOF-9 [194] и HOF-10 [195], продемонстрировал успешное построение и доступность пор, а также огромные перспективы использования в качестве универсальной платформы для исследования новых пористых материалов в широком спектре приложений, включая хранение и разделение газов, оптические приложения, гетерогенный катализ и биомедицину. Включение в структуру HOF порфиринового фотосенсибилизатора для формирования пор (в качестве пористой основы) и с коммерчески доступным биоцидом, в качестве противоионов внутри структуры, позволило создать анионный каркас (мембрану), получивший коммерческое наименование PFC-33. Электростатические взаимодействия между каркасом и противоионами позволяет производить ионно-чувствительное высвобождение биоцида в различных физиологических средах [196]. Композитные материалы на основе HOF характеризуются относительно крупными размерами пор, достигающими предельного диаметра около 6.4 Å. Это значительно превышает размеры пор материалов на основе цеолитов типа ZIF с топологией содалита, которые имеют диаметр около 3.4 Å [196, 197]. Было установлено, что покрытие HOF обеспечивает защиту инкапсулированных ферментов, таких как флуоресцеин-меченная каталаза (FCAT) и флуоресцеин-меченная алкогольоксидаза (AOX), от воздействия протеолитических ферментов (например, трипсина), хаотропных агентов (например, мочевины) и высоких температур без потери активности ферментов. Благодаря своей превосходной биосовместимости и способности к разложению HOF продемонстрировали уникальные преимущества в области доставки лекарств и фототермической терапии.
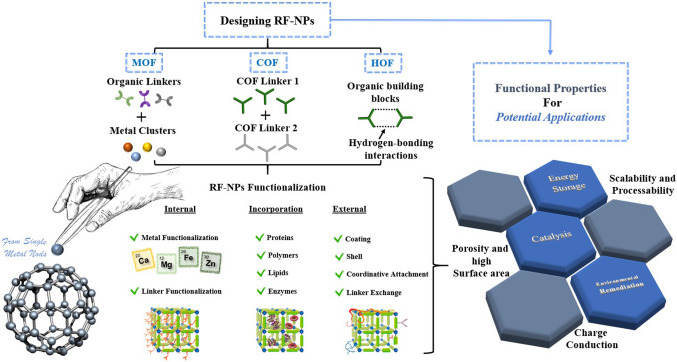
Органические каркасы с водородными связями (HOF) продемонстрировали огромные перспективы в качестве универсальной платформы для исследования новых пористых материалов в широком спектре приложений, включая хранение и разделение газов, протонопроводящие и оптические приложения, гетерогенный катализ и биомедицину [198-202]. Как показано на рисунке 7, множественные H-связи и сильные π–π-взаимодействия между двумя молекулами пирена повышают химическую и наноструктурную стабильность HOF (PFC-1). PFC-1 также демонстрирует превосходное поведение в качестве носителя лекарственного средства с высокой эффективностью загрузки DOX, равной 26.5 мас.%. Между тем, периодическая интеграция пирена делает PFC-1 интересным фотосенсибилизатором (ФС) для фотодинамической терапии (ФДТ). Эксперименты in vitro показали, что PFC-1, нагруженный DOX, демонстрирует синергетический эффект CT и ФДТ со значительной биосовместимостью и высокой терапевтической эффективностью [198]. Одним из основных применений ретикулярных пористых наноструктур (RF-NP) в биоприложениях является использование их порового объема для встройки (интеркаляции) активной молекулы и ее транспортировки с учетом таких факторов, как взаимодействие по типу «хозяин-гость», диффузии и деградация (рис. 8) [203].
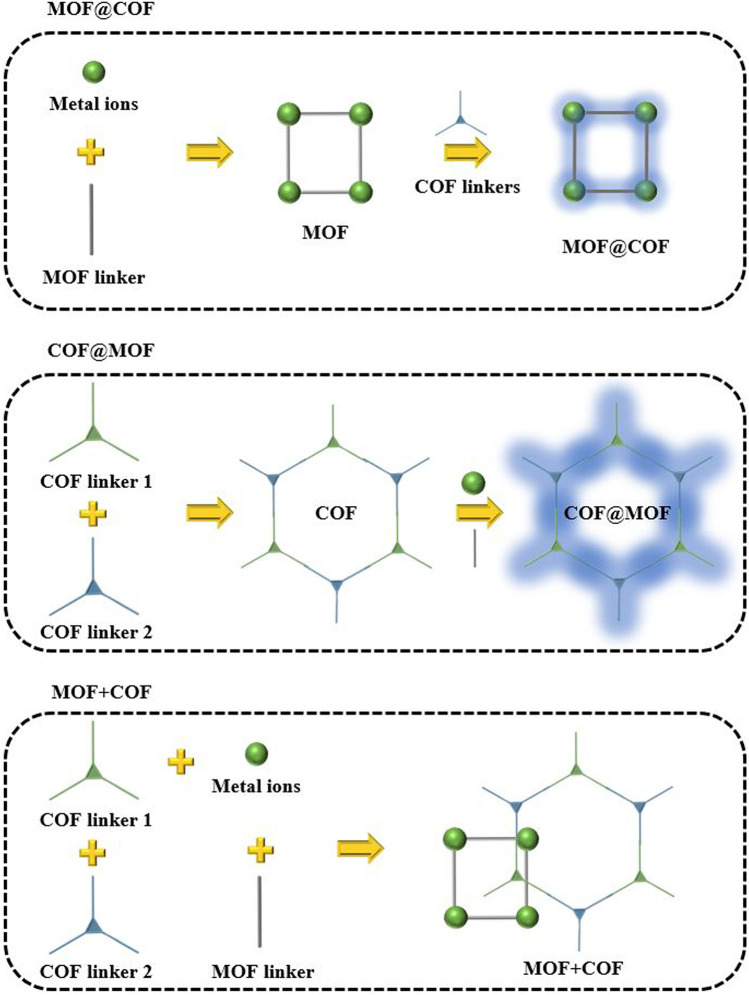
Проведенные исследования также показали, что небольшие изменения в молекулярной архитектуре MOК могут существенно повлиять на механические свойства МОК в составе комплекса. 4. МЕТОДЫ СИНТЕЗА ГИБРИДНЫХ НАНОКОМПОЗИТОВ НА ОСНОВЕ КАРКАСНЫХ СТРУКТУР Объединение химических свойств металлических МОК и ковалентных органических каркасов привело к созданию новых материалов с уникальными характеристиками и открыло новые возможности для дальнейших исследований и инноваций в этой области. В предлагаемой методологии синтеза гибридных наноструктур используются три основных композитных образования — это MOК@COF, COF@MOК и MOК + COF, как показано на рисунке 9 [203]. В гибридных MOК@COF-структурах типа «ядро-оболочка» COF ковалентно связывается с поверхностными функциональными группами MOК, обеспечивая интеграцию на молекулярном уровне. Тогда как, в COF@MOК-структурах типа «ядро-оболочка» образование оболочки MOК происходит на поверхности COF, создавая уникальную архитектуру с четко разграниченными слоями.
Композиты на основе MOK и COF, обозначаемые как MOK + COF, синтезируют методом постсинтетической модификации. Этот подход включает диспергирование наночастиц MOК на поверхности листов COF и позволяет формировать композитные структуры с улучшенными характеристиками по сравнению с исходными компонентами. Предварительная спроектированная структура COF позволяет проводить постсинтетические модификации для придания новых свойств и функций синтезированных материалов. В гетероструктурах, таких как COF-в-MOК, MOК используется в качестве шаблона для роста COF внутри его пор, что позволяет создавать материалы с контролируемыми свойствами и высокой степенью упорядоченности [203, 335]. Гибридные гетероструктуры MOК–COF с ковалентными связями оказались эффективными фотокатализаторами. Для создания гибридных материалов MOК–COF с ковалентными связями обычно использовали реакцию образования оснований Шиффа, в которой MOК содержали NH2–группы в структуре лиганда. Новая стратегия создания гибридных материалов MOК–COF с ковалентными связями включала проведение постсинтетической модификации металлических узлов MOК, лигандами, не содержащие NH2-группы. Затем Zr-MOК без NH2-лигандов (MOК-808), был модифицирован п-аминобензойной кислотой на кластерах Zr6 с целью введения NH2-групп. После чего был синтезирован гибридный комплекс MOК-808@TpPa-1-COF с ковалентной связью между двумя компонентами [204]. В этом контексте Peng и соавт.. [205] представили инновационную методологию синтеза нового типа материала — гибридного материала MOК@COF типа ядро–оболочка, как новый вид пористых материалов, обладающих уникальными свойствами (большая площадь поверхности, регулируемые структуры и большим разнообразием функциональных возможностей), которые привлекли большое внимание и развитие в области адсорбции газов, катализа, энергетики, экологии и биомедицины за последние десятилетия [206]. Путем интеграции металлорганических каркасов (MOК) и ковалентных органических каркасов (COF) синтезирован новый тип гибридного материала MOК@COF ядро-оболочка, содержащий NH2-аминогруппы в структуре МОК MIL-68@TPA(трис(4-формилфенил)амин)-COF, с высокой кристалличностью и иерархической структурой пор. Полученный гибридный материал NH2-MIL-68@TPA-COF использовался в качестве эффективного фотокатализатора, управляемого видимым светом, для деградации красителя родамина B. Важно отметить, что гипотетические наборы данных MOК и COF [207], состоящие из материалов, разработанных с помощью вычислений in silico, но не синтезированных экспериментально, также существуют и могут быть дополнительно исследованы для разработки гипотетических гибридов MOК/COF [206, 207]. Mультиферментные микрокапсулы (enzymes@COF), содержащие глюкозооксидазу (GOD), пероксидазу хрена (HRP) и ацетилхолинэстеразу (AChE), с полостью размером 600 нм и оболочкой из COF были использованы в электрохимических биосенсорах. Полость размером 600 нм обеспечивает свободное конформационное расширение инкапсулированных ферментов, а оболочка COF с хорошей химической стабильностью защищает инкапсулированные ферменты от внешних агрессивных сред. Мультиферментные микрокапсулы получали с использованием ZIF-8 в качестве «жертвенной» матрицы, покрывая их биосовместимой оболочкой COF. Сначала GOD, HRP и AChE были инкапсулированы в порах МОК ZIF-8 в виде стабильного комплекса ферменты@ZIF-8. После чего была сформирована оболочка COF с образованием новой структуры (ферменты«ядро-оболочка»@ZIF-8/COF). В кислой среде происходит специфическая деградация МОК, где ZIF-8 и Zn2+ и 2-метилимидазол диффундируют в раствор, сохраняя исходный размер полости диаметром около 600 нм. Инкапсулированные ферменты также высвобождаются и могут свободно менять свою конформацию, сохраняя активность. Пределы обнаружения глюкозы, H2O2 и малатиона (высокоэффективный инсектицид широкого спектра действия, широко используемый в сельском хозяйстве) с использованием мультиферментной микрокапсулы (ферментами@COF) составили 0.85 мкМ, 2.81 нМ, 3.0×10-13 г/л, а диапазон обнаружения составил 2.83 мкМ-8.0 мМ, 9.53 нМ-7.0 мкМ, 10-12 г/л-10-8 г/л соответственно [208]. Pазработанная новая концепция, использования МОК в составе мультиферментных биосенсоров, представляет интерес, однако не гарантирует сохранения биологической активности биомолекул [208]. 4.1. Биомолекулярные сенсоры на основе органических электрохимических транзисторов Основной принцип функционирования датчиков FET заключается в специфическом захвате целевых аналитов в модифицированном интерфейсе сенсорного канала с последующим усилением и мониторингом изменений в проводимости канала, вызванных аналитами. COF-датчики обладают большой площадью поверхности, что обеспечивает множество модифицируемых сенсорных участков, повышающих чувствительность, скорость отклика и диапазон обнаружения FET-датчиков. Для определения ДНК/РНК зонд ДНК/РНК обычно закрепляется на затворе электрода. Когда целевая ДНК/РНК связывается с зондом ДНК/РНК, потенциал затвора изменяется из-за перераспределения заряда в локальной области интерфейса затворного электрода/раствора, что, в свою очередь, влияет на изменение сигнала ID. Смешанные MOК (металлоорганические каркасные структуры) и COF-LZU1 (COF) были синтезированы соответственно гидротермическим и сольвотермическим методами [209, 210].
Т-лимфотропный вирус человека II типа тесно связан с лимфоцитарными злокачественными новообразованиями, приобретенным иммунодефицитом, воспалительными реакциями и неврологическими расстройствами. На созданном устройстве был проведен процесс биоинтерфейса путем выращивания целевой суперструктуры G-квадруплексных проводов (GWS), инициированной целевой ДНК, что позволило с высокой чувствительностью детектировать целевую ДНК HTLV-II 9 (рисунок 14a-d) [211, 212]. Исследование выявило наличие новой гетероструктуры COF-на-MOК и продемонстрировало уникальную светомодуляцию IOn/IOff органических транзисторов, аналогичную Ag/AgCl. Фарадеевский ток, генерируемый COF-на-MOК, очень похож на ток, генерируемый Ag/AgCl, что указывает на аналогичный эффект модуляции, как и в случае с Ag/AgCl. Воздействие света на COF-на-MOК может эффективно изменять физические свойства устройства, делая его IOn/IOff схожими с Ag/AgCl [145, 212]. В последние годы растeт интерес к разработке пористых органических сетчатых материалов нанометрового масштаба, особенно металлоорганических каркасов (МОК) и ковалентных органических каркасов (COF) [209]. Смешанные MOК и COF-LZU1 (COF) были синтезированы соответственно гидротермическим и сольвотермическим методами. Затем COF-на-MOК был сконструирован с помощью метода модульной сборки, который позволяет добиться синергетического фотоиндуцированного эффекта, усиливающего поглощение света и миграцию носителей, а также обеспечивает биосовместимый интерфейс с многочисленными функциональными участками, подходящими для иммобилизации биомолекул [210]. На рисунке 10(a-d) Wang и соавт.. представили органический фотоэлектрохимический транзистор (OPECT), управляемый фоточувствительным COF-LZU1 на смешанном лигандном MOК (COF-на-MOК) при соответствующем освещении [212]. Устройство продемонстрировало значительное улучшение сигнальных возможностей и способствовало последующей функционализации механизма управления за счeт роста целевой суперструктуры G-квадруплексных проводов, активируемой мишенью. Этот целенаправленный процесс позволил создать высокочувствительный биосенсор для обнаружения ДНК Т-лимфотропного вируса человека II типа (HTLV-II) с низким пределом обнаружения 0.003 фмоль/мл [213]. Deng и соавт. предложили графеновый транзистор, в котором углеродные квантовые точки (CQD) прикреплены к поверхности затвора [214]. Зонды с одноцепочечной ДНК были иммобилизованы на квантовых точках. Такая конфигурация позволила обнаруживать целевые молекулы ДНК в концентрациях до 1 аМ, что способствовало быстрому и высокочувствительному обнаружению сверхнизких концентраций молекул ДНК. Эти достижения демонстрируют значительный прогресс в области разработки высокочувствительных и селективных биосенсоров, и открывает новые перспективы для диагностики инфекционных заболеваний и молекулярной биологии. В другом исследовании Deng и соавт. зонды одноцепочечной ДНК были прикреплены к затворам Au для создания сенсоров РНК при обнаружении раннего биомаркера рака простаты, miRNA-21 [150]. Этот сенсор оказался весьма удачным из-за низкого предела обнаружения (10−20 M) и быстрого времени отклика, что сделало его эффективным для быстрого и чувствительного обнаружения молекул miRNA-21. Недавно Xu и соавт. [215] разработали новый MOК@COF типа ядро-оболочка, обладающий превосходной фотоактивностью, который послужил бифункциональной платформой для двухрежимного фотоэлектрохимического (ФЭХ) и электрохимического (ЭХ) биосенсорoв для определения ДНК ВИЧ-1. Оба материала взаимодействуют друг с другом посредством π–π-взаимодействий в комплементарной гибридизации между зондом ДНК ВИЧ-1 и целевыми цепочками ДНК, обеспечивая высокую селективность и чувствительность анализа ДНК ВИЧ-1. Полученный биосенсор на основе Cu-MOF@CuPc-TA-COF продемонстрировал широкий линейный диапазон обнаружения от 1 фМ до 1 нМ и чрезвычайно низкий предел обнаружения (LOD) 0.07 фМ и 0.18 фМ соответственно. Интеграция COF/MOК с OECT/OPECT позволяет добиться более точного и чувствительного обнаружения ДНК/РНК. Биологическая модуляция поверхностной емкости в биосенсорах на основе OPECT [216], например, в фотоаноде из нанотрубок и КТ CdS/TiO2, интегрированном с HCR-усилением для обнаружения биомаркера микроРНК-17, позволяет обнаруживать микроРНК в линейном диапазоне от 1 пМ до 1 мкМ с пределом обнаружения 1 пМ. В иммунохимическом исследовании онкологических заболеваний был получен EC-иммуносенсор с использованием MOК MIL-156, декорированного COF, для выявления клеток рака молочной железы c высокой чувствительностью. Линейный диапазон обнаружения от 30 нЕд/мл до 100 нЕд/мл и предел обнаружения (LOD) 2.6 нЕд/мл позволяют проводить раннее и чувствительное обнаружение биомаркеров рака молочной железы. Кроме того, изготовленное устройство было использовано для различения нормальных клеток и клеток рака молочной железы по содержанию белка маркера [217]. CA15-3 представляет белок муцин-1, который активно вырабатывается при раке молочной железы и является наиболее широко используемым циркулирующим биомаркером при метастатическом заболевании РМЖ [5]. Разработка COFs основана на принципах ретикулярной химии. По сравнению с MOК COF обладает низкой плотностью и более высокой адсрбционной способностью, наличием в структуре активных каталитических сайтов. Структура поры (например, размер и форма пор) COFS легко адаптирована к различным способам модификации, что позволяет провести селективный анализ разнообразных по структуре токсичных соединений или загрязнителей окружающей среды. При этом, как уже было отмечено, меркапто-группа проявляет очень сильные комплексообразующие свойства относительно поверхности металлических частиц [62, 63]. 5. СТРАТЕГИЯ СИНТЕЗА ГИБРИДНЫХ СТРУКТУР COF-МОК В гибридных структурах MOК-COF типа ядро-оболочка получение МОК в качестве ядра продемонстрировало низкую стабильностью МОК. Избранная другая стратегия синтеза, в которой COF действуют как ядро, является альтернативной методу синтеза гибридов COF–MOК (рис. 11). Первый пример гибрида COF–MOК был разработан в 2016 году [218]. Было продемонстрировано, что MOК можно выращивать непосредственно на поверхности мембраны COF для получения гибридных мембран COF–MOК. Гибридная мембрана [COF-300]-[ZIF-8] была изготовлена с помощью послойной стратегии путем введения диска SiO2, покрытого COF-300, в раствор прекурсоров ZIF-8. Чжоу и др. [219] использовали последовательную стратегию роста MOК-на-COF для приготовления нового гибрида COF–MOК в качестве биосенсора для обнаружения окситетрациклина в водных растворах. Частицы COF (обозначенные как MCA) были синтезированы посредством реакции циануровой кислоты и меламина, а затем включены в растворы прекурсоров Ce-MOК, что привело к образованию гетероструктурированного гибрида MCA@Ce-MOК. Между MCA COF и Ce-MOК образуется сильное π–π-стекинговое взаимодействие, связанное в основном с наличием ароматических групп в структуре Ce-MOК и упорядоченных π-колончатых MCA COF. Количество растущих исследований и публикаций об использовании ковалентных кластерных каркасов и композитов MOК–COF свидетельствует (подтверждает) интерес к этой области науки [120, 218, 219]. Основу пористых каркасных структур составляют большое количество химически стабильных связей, в том числе иминовых [16], гидразиновых [17], имидных [18], триазиновых [19], эфирных [20], олефиновых [21] и оксазольных [22], которые позволяют создавать значительное количество прочных двумерных COF.
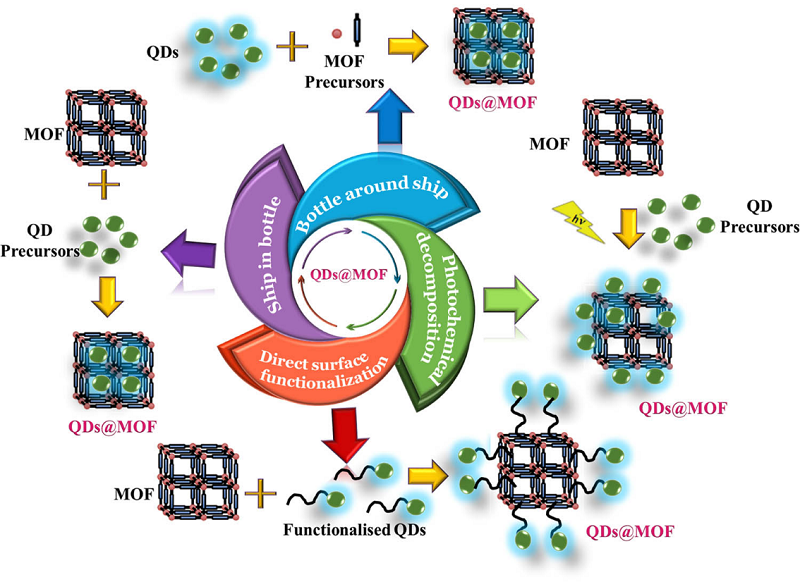
Структуру COF можно подготовить с атомарной точностью, производя кристаллические пористые полимеры с 2D- или 3D-геометрией с настраиваемым размером пор и поверхностной химией [17]. Таким образом, разработка гибридных структур на основе MOК и COF представляет собой значительный шаг вперед в области материаловедения, открывая новые возможности для создания инновационных материалов с уникальными свойствами и широким спектром применения. 6. МЕТОДЫ СИНТЕЗА ГИБРИДНЫХ НАНОСТРУКТУР КВАНТОВЫХ ТОЧЕК И МОК Методы синтеза материалов МОК включают традиционный метод реакции в растворе, гидротермальный (сольвотермальный) метод. Реакция инициируется небольшим электрическим нагревом или нагреванием с помощью микроволнового излучения, метод диффузии и механическое измельчение, а также метод микрожидкостного синтеза. Прямая функционализация поверхности МОК связана с использованием поверхностных лигандов КТ. Отметим, что лиганды, представляющие низкомолекулярные органические соединения, придают КТ уникальные свойства, такие как коллоидная растворимость, стабильность, морфология частиц и распределение частиц по размерам. Наиболее часто используемые лиганды включают карбоновые кислоты (-COOH), спирты (-OH), первичные амины (-NH2), длинноцепочечные органофосфаты и тиолы (-SH) [221]. Ключевым преимуществом этого пути синтеза является простота регулирования формы и размера КТ, а также возможность варьирования морфологии MOК. Кроме того, для получения более сложных нанокомпозитов КТ/MOК были разработаны другие методы, такие как интеркаляция [222], физическое сплавление, позволяющее получить белые светоизлучающие люминофорные материалы на основе углеродных точек (CD) и Zr(IV)-MOК [223, 224], капельное литье [225] в виде нанесенного покрытия на различные металлические подложки и электрохимическое осаждение, включающее диспергирование КТ в электролите и их осаждение на границе раздела MOК с помощью электрического тока [226, 227]. Подводя краткий итог методов получения нанокомпозитов типа КТ@MOК отметим, что методы внедрения КТ в матрицы MOК оказались более эффективными, чем затравка кристаллов MOК в КТ [228]. 6.1. Стратегия функционализации поверхностей МОК Практическое применение MOК затруднено из-за их ограниченной электропроводности, размера микропор и плохой стабильности. Однако интеграция нульмерных квантовых точек (КТ) в структуру MOК позволяет повысить стабильность комплекса, а также объединить и использовать синергические свойства КТ и МОК в новой структуре КТ@MOК (рис. 12) [229].
Разработка новых способов оптимизации пространственной локализации металлических наночастиц в структуре MOК повышает каталитические характеристики носителя. Структура «ядро-оболочка» обеспечивает короткое расстояние диффузии реагентов от поверхности MOК и облегчает диффузии молекул к сильно экспонированным активным центрам наночастиц и, таким образом, одновременно способствует протеканию быстрой кинетике реакции, обеспечивая высокую селективность процесса. Инкапсулирование КТ в матрицу MOК приводит к созданию нанокомпозитов КТ @ MOК, в которых электронные и оптические свойства квантовых точек, зависящие от размера, могут быть стабилизированы. Структура МОК типа «ядро-оболочка» CdTe@ZIF-8 характеризуется упорядоченным распределением квантовых точек CdTe в структуре ZIF-8 [50]. Инкапсуляция графеновых квантовых точек (GQD) в поры каркаса ZIF-8 демонстрирует прочную связь между ионами Zn2+ в ZIF-8 и карбоксильными группами −COOH в GQD и, таким образом снижают вероятность агрегации GQD в ZIF [51]. MOК выполняет несколько функций: стабилизирует и диспергирует квантовые точки, регулирует скорость электронно-дырочной рекомбинации за счет эффективного разделения зарядов, увеличивает число активных центров и избирательно накапливает реакционные частицы на поверхности полупроводника. С другой стороны, квантовые точки, интегрированные в MOК, придают каркасам желаемые оптоэлектронные свойства. Они улучшают светособирание и флуоресцентное считывание, что делает такие материалы перспективными для применения в биосенсорике, оптоэлектронике и других областях. Основная стратегия функционализации поверхности МОК связана с включением активных групп в скелет или загрузку активных агентов в каналы и поры нано MOК. Другим направлением является модификация поверхности только что синтезированного нано MOК покрытиями из диоксида кремния или органическими полимерами посредством самосборки для улучшения их коллоидной стабильности. Функционализация поверхности влияет на химические свойства, морфологию и размер MOК, повышают коллоидную/физиологическую стабильность и каталитическую реактивность МОК, увеличивая время циркуляции комплекса. Стабильность MOК в большинстве биомедицинских приложений является одним из важнейших факторов, которые необходимо учитывать при их использовании [230]. Коллоидные полупроводниковые КТ (КТ Zn-Ag-In-S (ZAIS), покрытые глутатионом (GSH), были успешно инкапсулированы в металлоорганические каркасы (ZIF-8) с помощью простого метода самосборки. Результаты показали, что нанокомпозит MOК и КТ ZAIS (КТ@ZIF-8) демонстрирует превосходные антибактериальные свойства против E. coli и S. aureus при облучении видимым светом. Было обнаружено, что антибактериальный механизм КТ@ZIF-8 реализуется путем разрушения мембраны бактериальных клеток, деградации внутриклеточных биомолекул, таких как ДНК и белок, и окисления GSH. Полученные в работе комплексы КТ/МОК характеризуется низким энергопотреблением в синтезе каркасных структур, продемонстрировали высокую антимикробную эффективность МОК, отсутствием проявления лекарственной устойчивости и канцерогенных свойств побочных продуктов [231]. Таким образом, авторы разработали новую стратегию рационального проектирования фотокаталитических дезинфицирующих материалов на основе MOК и полупроводниковых квантовых точек [231]. На стабильность МОК MIL-типа влияют наличие металлов группы лантанидов (Y, Tb, Eu) или компонентов трехвалентного металла (Fe, Al, Cr), которые образуют прочные связи с линкерами, содержащие концевые анионы атома кислорода, проявляя при этом высокую химическую стабильность [232, 233]. В других исследованиях продемонстрирована высокая стабильность МОК Fe-MIL-101 и Fe-MIL-100 в биологических жидкостях. Использование этих соединений позволяет сохранить функциональную активность и эффективность при доставке лекарств в течение длительного времени [233, 234]. К гидротермально стабильным MOК относятся UiO-66, MIL-14 и гидрофобные ZIF на основе циркония [233, 235]. В настоящее время проводятся обширные исследования MOК для различных применений, адаптированных для конкретных целей [234-237]. Значительные усилия были направлены на разработку исключительно прочных и пористых MOК, включая MOК-5, MOК-74 и т. д. Кроме того, значительное внимание было уделено MIL MOК, включая MIL-53, MIL-96, MIL-100 и т. д., PCN MOК, такие как PCN-12, PCN-222 и PCN-515, цеолитные имидазолятные каркасы (ZIF) (ZIF-7, ZIF-8 и ZIF-67) [25, 26], а также UiO MOК, представленные в виде структур UiO-66 и UiO-67 [238, 239]. Вышеупомянутые типы MOК демонстрируют исключительные свойства, приписываемые их инновационным металлическим, а также органическим предшественникам, что делает их весьма подходящими для широкого спектра промышленных применений [238], включая биомедицинские [28] и экологические [29]. Относительно новыми видами комбинации КТ и МОК являются комплексы на основе углеродных материалов, таких как, графен [239] или углеродные нанотрубки [240] (табл. 1). Квантовые точки перовскита CH3NH3PbI3 (MAPbI3), инкапсулированные в поры железо-порфириновых металлоорганических каркасов (MOК) PCN-221 (Fex), позволили получить эффективную фотокаталитическую систему для восстановления CO2 до CO и CH4, что в 38 раз выше, чем у соответствующего PCN-221, и таким образом уменьшить выбросы CO2, превращая в химическое сырье или топливо [241].
6.2. Методы включения биомолекул в структуру МОК/КТ Успех включения малых молекул или предшественников КТ в различных по размеру пор MOК непосредственно связан с получением желаемой структуры МОК. При этом способе используются различные методы для введения предшественников КТ в MOК, такие как осаждение из паровой фазы, инфильтрация раствора и измельчение в твердом состоянии. Однако отметим, что точно контролировать местоположение, состав, структуру и морфологию включенных молекул, часто вызывает определенные сложности. Одним из основных методов синтеза МОК/КТ является подход, получивший название «корабль–бутылка», который включает иммобилизацию малых молекул или прекурсоров КТ в порах MOК с последующей дальнейшей обработкой для достижения желаемой структуры. Для введения прекурсоров КТ в MOК были использованы различные методологии, такие как, осаждение из паровой фазы, инфильтрация раствора и твердотельное измельчение. Несмотря на некоторые недостатки значительным преимуществом технологии «корабль-бутылка» является возможность создания конформационных слоев MOК вокруг КТ, что придает КТ стабильность и устойчивость, препятствует кластеризации КТ, а также позволяет снизить токсичность КТ, интеркалированных в МОК. Zhang и соавт. [242] использовали термическую инъекцию для объединения прекурсоров КТ UiO-67 и перовскита CsPbX3 для получения CsPbX3@UiO-67 при высоких температурах. Чтобы избежать агрегации КТ на внешней поверхности MOК была успешно разработана технология двойного растворителя. Используя этот подход с двойным раствором, при котором небольшое количество глюкозы и раствора-предшественника CdS КТ были совместно пропитаны в полость MIL-101, Meng и соавт. [243] получили комплекс глюкоза/CdS@MIL-101, далее подвергнутого прокаливанию при 200°C, что позволило синтезировать конечный продукт, содержащий углеродные наноточки CD/CdS@MIL-101. Перовскитные квантовые точки (PeQD) CsPbX3 (X=Cl, Br и I) обладают уникальными оптическими свойствами. Однако плохая стабильность препятствует применению CsPbX3 (PeQD). Hовая стратегии повышения стабильности PeQD была достигнута путем встраивания CsPbX3 PeQD в мезоструктурные кристаллы металлоорганического каркаса на основе цинка (MOК-5). С этой целью была увеличена структура пор кристаллов MOК-5 с использованием шаблонных агентов цетилтриметиламмоний бромида и 1,3,5-триметилбензола. Нанокомпозиты CsPbX3/MOК-5 получали путем физического смешивания CsPbX3 PeQD с мезопористыми структурированными кристаллами MOК-5 в растворе, которые выполняли функцию дисперсионной среды, для придания CsPbX3 PeQD улучшенной стабильности (термостойкость, фотостойкость и длительная (долговременная) стабильность) [244]. Используя метод поэтапной прививки лигандов, получивший название стратегия синтеза «бутылка–корабль», в которой формирование КТ@MOК включает распределение КТ в стабилизирующем растворе, чтобы избежать агломерации. После этого прекурсоры MOК добавляются к растворителю, который инициирует формирование MOК вокруг КТ. Во время этого процесса органические связи образуют двухвалентные связи с покрывающими фрагментами на поверхности КТ. Аналогичным образом, Мо и соавт. [245] синтезировали Fe(3)-MIL-88B-NH2@ZnSeКТ для обнаружения антигенов. При этом раствор прекурсора MOК и КТ ZnSe нагревали при 100°C (в течение 20 ч) в реакторе с тефлоновым покрытием. Конечный продукт выделяли путем охлаждения с последующим центрифугированием. Wang и соавт.. [246] использовали химический реагент поливинилпирролидон, который не только поддерживал твердость и распределение частиц, но и стимулировал образование ZIF-8 на поверхности. Разработанный метод синтеза МОК/КТ позволяет снизить количество КТ на внешней части поверхности MOК, проникающих в среду MOК. Кроме того, поскольку наночастицы могут быть агломерированы до сборки каркасов, форма и размер КТ могут быть адаптированы для конкретных приложений. В отличие от методов «корабль-бутылка» и «бутылка-корабль», в которых КТ встраивались в структуру MOК, метод «фотохимического осаждения» предполагает нанесение КТ на внешнюю часть поверхности MOК. Используя этот подход, группа Wang H., [247] синтезировала гибридные нанокомпозиты MIL-125(Ti), содержащие КТ CdS, CuS и Ag2S. Аналогичным образом Lin и соавт. [248] получили трехкомпонентный гибридный материал UiO-66/CdS/rGO (восстановленный оксид графена) для фотокаталитических приложений. Интеллектуальная интеграция нульмерных квантовых точек (КТ) в шаблон MOК, где структура-хозяин предлагает специфические взаимодействия для повышения стабильности и синергетических свойств МОК открывает новые возможности получения функционально-активных наноматериалов, позволяет развивать новые подходы к стратегиям синтеза и применение новых структур МОК в оптоэлектронных устройствах, зондировании, биомедицине, катализе и хранении энергии с улучшенными функциональными возможностями [249]. Однореакторный и простой метод с помощью высокой гравитации был применен для синтеза неорганических двумерных наноструктур MXene, встроенных в MOК-5. Инновационная неорганическая наноструктура MXene/MOК-5 была применена для совместной доставки лекарства и гена, а для повышения ее биодоступности и взаимодействия с pCRISPR наноматериал был покрыт природными биополимерами альгинатом и хитозаном. Наносистемы с полимерным покрытием были полностью охарактеризованы, и были проведены исследования устойчивой доставки доксорубицина (DOX) в клетки и цитотоксичности на клеточных линиях HEK-293, PC12, HepG2 и HeLa, продемонстрировав приемлемую и превосходную жизнеспособность клеток как при очень низких (0.1 мкг/мл), так и при высоких (10 мкг/мл) концентрациях [250].
Несмотря на свои многочисленные преимущества, формат КТ оказывает цитотоксическое действие на живые клетки и ткани. Чтобы устранить недостатки традиционных КТ, было разработано новое поколение КТ, таких как Si КТ, Ag2Se КТ, углеродные точки (CD), графеновые КТ (GQD) и перовскит КТ. MOК с высокой пористостью и удельной площадью поверхности предоставляют уникальную платформу, создавая идеальную среду для загрузки КТ и предотвращения их агрегации. В то же время, КТ улучшают физико-химические свойства MOК (таблицa 3) [251]. В этом контексте, полученные комплексы MOК/КТ открыли новые возможности для различных приложений. Предел обнаружения аналитов в формате MOK/КТ колеблется от пМ до нМ, что является недостаточным при обнаружении низкого уровня вирусов в клинических образцах, и, следовательно, может влиять на чувствительность анализа. Углеродные материалы с различными размерами частиц широко используются для приготовления гибридных нанокомпозитов на основе металлоорганических каркасов, в том числе одномерные углеродные нанотрубки (УНТ), двумерный графен, оксид графена (GO) и его восстановленная структура (rGO), мезопористый углерод [77-79]. УНТ считаются одним из наиболее перспективных углеродных материалов для повышения эффективности металлоорганических каркасов благодаря их уникальной электропроводности, большой площади поверхности и высокой термической/механической стабильности [80]. Композиты углеродных наноматериалов с МОК использовались для электрохимического обнаружения широкого спектра соединений, представленных в таблице 3 [251]. Интегрированные в MOК многофункциональные проводящие материалы, увеличивают производительность датчиков за счет синергетических эффектов. 7. БИОРЕАГЕНТЫ МОК НА ОСНОВЕ АНТИТЕЛ И ИХ АНАЛОГОВ 7.1. Иммунотерапия Основные реагенты для проведения иммунотерапии включают ингибиторы иммунных контрольных точек, терапевтические антитела и иммуномодуляторы в качестве биомаркеров. Ингибиторы иммунных контрольных точек характеризуются длительным действием и низкой токсичностью, что позволило широко применять их в иммунотерапии опухолей [252]. Среди различных представителей МОК каркас цеолита имидазола ZIF–8 наиболее широко используется в иммунотерапии [253-256] в качестве носителя ингибиторов иммунных контрольных точек, иммунных адъювантов или противораковых вакцин [3]. ZIF-8 состоит из ионов цинка и 2-метилимидазола, характеризуется большой удельной площадью поверхности (Sуд.) и термической стабильностью [4]. ZIF-8 представляет собой координационное соединение в виде клетки с правильными ромбическими додекаэдрическими кристаллами. Разложение в кислых растворах биологической жидкости облегчает специфическое высвобождение лекарств с использованием ZIF-8. ZIF-8 способен генерировать активные формы кислорода (ROS) в реакции типа Фентона. Химическая модификация поверхности ZIF–8 полиэтиленгликолем (ПЭГ), гиалуроновой (ГК) или фолиевой кислотой (FA) [15] улучшают физические характеристики ZIF-8 [12, 13] и целевую активность к опухолевым клеткам [253, 255, 256]. Одним из перспективных направлений в диагностике и терапии онкологических заболеваний в настоящее время является использование целевых (таргетных) молекул, специфически узнающих рецепторы онкомаркеров на поверхности опухолевых клеток. При этом используются так называемые молекулярные вектора: антитела, аптамеры, пептиды, гиалуроновая или фолиевая кислоты и др. Наиболее перспективным оказалось семейство линейных и циклических RGD-пептидов, содержащих в себе фрагменты L-аргинина, глицина и L-аспарагиновой кислоты (L-Arg-Gly-L-Asp) [10, 257]. RGD пептиды Arg-Gly-Asp, меченные КТ, были выбраны для получения излучения в ближнем инфракрасном диапазоне из-за улучшенных оптических свойств ткани в этом диапазоне. Квантовые точки были использованы в качестве зонда визуализации, поскольку их можно визуализировать in vivo с высоким уровнем яркости и фотостабильностью. RGD пептиды использовались в качестве целевой молекулы из-за его небольшого размера, специфичности и очень важной роли, которую выполняет RGD-пептид при связывании с интегрином αvβ3, в ангиогенезе опухоли, пролиферации и метастазах [258] с учетом, так называемого, эффекта EPR, характеризующие повышенную проницаемость и удержание частиц в опухоли из-за измененной патофизиологии. Эти характеристики не проявляются (отсутствуют) в здоровых тканях. Наночастицы в виде цеолитного имидазолятного каркаса-8 (nZIF-8), загруженные химиотерапевтическим агентом (гемцитабином, GEM), содержащие в своей структуре пептидный лиганд Arg-Gly-Asp (RGD), получены методом сольвотермальной реакции. Функционализация поверхности, загруженного nZIF-8 GEM (GEM⊂nZIF-8) с RGD, была доказана с помощью спектроскопических и электронных микроскопических методов. Эта поверхностно-функционализированная наночастица (GEM⊂RGD@nZIF-8) продемонстрировала повышенное поглощение в клетках рака легких человека (A549) по сравнению с нефункционализированным GEM⊂nZIF-8 с индексом селективности (SI) 3.98 и использовалась для эффективной доставки химиотерапевтического препарата [259]. Улучшение целенаправленной и контролируемой доставки различных веществ в репродуктивные ткани, гаметы и эмбрионы с помощью наночастиц представляет особую ценность с точки зрения репродуктивной биологии в экспериментальных исследованиях, диагностики и терапевтических приложений [260, 261]. Наноматериалы получили широкое признание за свою способность усиливать поглощение внешних веществ клетками [253, 262]. Различные наноматериалы использовались для разработки и изготовления электрохимических биосенсоров для обнаружения опухолевых маркеров HER2. Некоторые из них были исследованы в сравнительных методах с МОК, в котором Au-электрод, модифицированный металлоорганическим каркасом Zr-Hf (MOК), в структуру которого встроены многочисленные углеродные точки (CD) [263]. Амино-функционализированный. CD@ZrHf-MOК был использован в качестве каркаса для иммобилизации структуры аптамера при определении биомаркеров РМЖ, а именно, человеческого рецептора эпидермального фактора роста-2 (HER2) и живых клеток MCF-7 с повышенной экспрессией HER2. CD интеркалированы во внутренние полости ZrHf-MOК без изменения наноструктуры. Полученный комплекс CD@ZrHf-MOК характеризуется хорошей биосовместимостью, сильной флуоресценцией и высокой электрохимической активностью. Высокая чувствительность по отношению к клеткам HER-2 и MCF-7, продемонстрировала чрезвычайно низкий предел обнаружения 19 фг/мл (диапазон концентраций HER2: 0.001–10 нг/мл) и 23 клетки/мл (диапазон концентрации клеток: 102~105 клеток/мл) соответственно, проявив хорошую селективность, стабильность и воспроизводимость сенсора. Иммуносенсор для выявления простатспецифического антигена (ПСА, PSA), как биомаркера рака простаты, был разработан с использованием квантовых точки (КТ) и магнитных металлоорганических каркасов (МОК). При этом стеклоуглеродный электрод модифицируется магнитными наночастицами на основе железа (Fe3O4) с ядром оболочки МОК, образуя магнитный каркас Fe3O4@TMU-10, с последующей иммобилизацией первичных антител (Ab1) на модифицированном электроде. КТ, содержащие металлические катионы никеля и кадмия (CdTe:Ni), конъюгируются с вторичными антителами (Ab2), образуя электроактивный неферментативный зонд. Полученный иммуносенсор продемонстрировал высокую чувствительность определения ПСА (линейный диапазон 1пг/мл - 100 нг/мл и предел обнаружения 0.45 пг/мл) с высокой селективностью, воспроизводимостью и стабильностью [264]. В других работах синтезировали магнит-МОК электрохимический геносенсор сэндвичевого типа для обнаружения гена BRCA1 (t-DNA). Ген BRCA1 является наиболее важным геном-супрессором опухолей, связанным с возникновением и развитием рака молочной железы, особенно трижды негативным типом (TNBC) РМЖ [3]. Мутации гена BRCA1, выявляются, примерно у трети пациентов с TNBC [265]. Поверхность геносенсора была модифицирована многослойными углеродными нанотрубками и антителами. MWCNT и Fe3O4@TMU-21, с улучшенной площадью поверхности, осуществлял перенос электронов между электроактивными компонентами МОК и электродом [266]. Интеграция этих стратегий продемонстрировали усиление сигнала и низкий предел обнаружения 0.57×10−15 для t-ДНК с применением нанокомпозитного комлекса c-DNA/MWCNTs/Fe3O4@TMU-21/GCE. Функциональная активность MOK в составе комплекса способствует улучшению активности и получению высокоактивных электрокатализаторов для использования в электрохимии. Fe3O4, интегрированный в MOК, проявляет электрохимическое окислительно-восстановительные свойства, а также каталитическую активность в реакции окисления/восстановления различных целевых молекул. В применяемой системе Fe(CN)4−6 играет роль электрокатализатора для окисления Fc-r-DNA, обеспечивая эффективный перенос электронов. В других работах МОК представлены также биядерным каркасом порфирина кобальта, содержащим золото (Au), квантовыми точками графена с антителами на поверхности GCE для выявления раковых биомаркеров [266]. Ковалентное связывание и электростатические взаимодействия на основе сил Ван-дер-Ваальса, π-π-взаимодействие и водородная связь являются основными параметрами, характеризующие поверхностную адсорбцию и инкапсуляции в пористую структуру МОК биологических молекул. EIS, DPV и CV являются наиболее важными методами инструментального анализа, используемыми при разработке биосенсоров на основе МОК и оценке их характеристики и производительности. 7.2. Биоконъюгация квантовых точек с биореагентами Биомакромолекулы, такие как пептиды и нуклеиновые кислоты, связываются с поверхностью MOК через координационные связи, что дает им широкую возможность для аналитического обнаружения и идентификации мишеней, доставку лекарств и биовизуализацию [267-269]. В настоящее время сенсорная технология на основе MOК используется для обнаружения различных вирусов социально-значимых и особо опасных инфекций, в том числе биомаркеров одноцепочечной ДНК ВИЧ [270], вируса Эбола [271], вируса Судана [272], вируса Зика [273, 274], вируса Денге [273], вируса гепатита А (HAV) [275] и т. д. Другие MOК или пористые углеродные материалы, полученные из MOК, применялись для обнаружения вирусов [274-278]. Металлоорганические каркасы (MOK) с настраиваемыми структурами, высокой пористостью и активных участков разрабатывались как перспективные системы доставки лекарств. Так IRMOR-16 применяли в качестве потенциального носителя, чувствительного к pH, МОК для доставки лекарств, например, куркумина и показали зависимое от pH поведение в процессе доставки [279]. Проявление высокой противоопухолевой цитотоксичности МОК, по мнению авторов, возможно связано с механизмом увеличения внутриклеточных активных форм кислорода (ROS), снижения внутриклеточного митохондриального мембранного потенциала (MMP) и индукции апоптоза [272]. В обширном исследовании работы [280] было изучено использование MOК-5 в качестве носителя с замедленным высвобождением для противоопухолевого препарата оридонин (ORI). Исследование показало, что MOК-5 успешно инкапсулировал ORI, сохраняя его внутреннюю структуру и свойства. UiO-66, покрытый пленкой с мезопористым SiO2, и фолат-конъюгированным плюроником F127 с ядром и оболочкой применяли в качестве носителя доставки лекарств MOК@SiO2/F127-FA и для направленного поглощения клетками при лечении рака. Использование кремниевой оболочки позволило иммобилизовать целевые молекулы на поверхности модифицированного МОК и улучшить стабильность МОК, тогда как дальнейшая модификация с помощью плюроновой и фолиевой кислоты улучшила биосовместимость и специфичность препарата на раковые клетки. Наночастицы UiO-66@SiO2/F127-FA, загруженные DOX, были оценены на предмет свойств и противоопухолевой активности, и продемонстрировали потенциал комплекса МОК при доставке небольших молекул [281]. Safinejad и соавт. [282] синтезировали нетоксичный MOK на основе La с 3,4-дигидроксикоричной кислотой в качестве линкера, который продемонстрировал хорошую биосовместимость с линиями клеток рака молочной железы человека. Комплексная система для лечения остеоартрита на основе МОК, содержащего стронций и кетопрофен (2-(3-бензоилфенил)-пропионовая кислота), представитель группы нестероидных противовоспалительных препаратов, продемонстрировали эффективное лечение остеоартрита, заболевания, приводящее к инвалидности и функциональной нетрудоспособности взрослого населения во всем мире [256, 268, 283]. Sr/PTA-MOF-Кетопрофен является перспективным средством для снятия воспаления, обезболивания и поддержания баланса костной ткани [283]. Вариант экспресс-анализа, с использованием высокочувствительного микрофлюидного метода имеет большой потенциал для диагностики нескольких инфекционных заболеваний одновременно, особенно необходимый в местах оказания помощи (POC), а также в условиях ограниченных ресурсов [269, 284]. На сегодняшний день функционализация ДНК ограничена несколькими типами MOК. Хотя большие успехи были достигнуты в эффективной модификации MOК олигонуклеотидами или аптамерами, разработка универсальной стратегии для улучшения их биосовместимости и стабильности все еще представляет собой нерешенную проблему. Нестабильность в биологической среде ограничивает использование МОК в биомедицинских приложениях [257, 269, 284-286]. Использование биоМОК в биологических приложениях было предложено за последние несколько лет, а функциональная активность этого класса биоМОК проявляется в основном для доставки активных ингредиентов в контролируемых средах [286]. Кроме того, важно отметить, что при непосредственном использовании терапевтической молекулы в качестве линкера нет необходимости создавать большие поры в структуре МОК. 7.3. Металлоорганические каркасы для биомедицинских приложений 7.3.1. Структурные особенности и свойства MOК@КТ За последние двадцать лет наблюдался значительный рост количества исследовательских публикаций, посвященных различным аспектам MOК, включая их синтез, свойства и применение [287]. Нарушение регуляции внутриклеточного pH может указывать на устойчивость к лекарствам и онкогенез, поэтому для определения внутриклеточного pH в режиме реального времени с целью выявления различных заболеваний были созданы nMOК реагирующие на стимулы (рН, температуру и т.д.) Уникальные свойства нового класса биоМОК и их композитов вызывают растущий интерес во многих областях биомедицины и привлекают большое внимание исследователей. Последние технологические достижения включают инкапсуляцию лекарств в пористую структуру MOК, используя взаимодействие между внешними частицами и активными центрами в структуре MOК, обеспечили эффективную защиту и доставку препаратов в живой организм, а также возможность проводить биомедицинскую визуализацию, и использование лекарственных средств в качестве терапевтических агентов [287]. При этом терапевтические средства могут быть использованы в качестве линкеров, осуществлять нековалентную инкапсуляцию, а при образовании конъюгатов с линкерами иметь возможность присоединения к SBU в качестве строительных блоков МОК (рис. 13) [288]. Структурные особенности МОК-5 позволили решить проблему растворимости препаратов и, в частности, улучшить растворимость гидрофобных лекарств, таких как, куркумина, сулиндака и триамтерена, путем инкапсулирования их в MOК-5, деструкция которого наблюдается в водных средах [289].
Структурные особенности МОК позволяют использовать их для распознавания биомолекул. Инкапсуляция ферментов in situ в металлоорганические каркасы (MOK) представляет собой перспективный метод создания устойчивых биокатализаторов. Cтратегия фазового перехода, применяемая в синтезе активных и прочных MOК-биокатализаторов, способствует развитию биокатализа в различных областях. Размер пор МОК определяется длиной углеродной цепи органического линкера, в то время как введение функциональных групп в структуру МОК влияет на химические свойства и вызывает проявление дополнительных функций, повышая, таким образом, функциональность МОК [47]. Так, включение полимеров с металлоорганическими каркасами повышает химическую стабильность, а также механическую гибкость. Диапазон применения МОК отличается разнообразием и распространяется в различных областях, таких как биомедицина [290-292], биотехнология [293-295], органическая и аналитическая химия [296, 297], экологические исследования [297]. MOК могут использоваться для загрузки нуклеиновых кислот посредством различных механизмов, используя, например, координационное взаимодействие металл-фосфат [297, 298], или многовалентную координацию между нуклеотидным фосфатом структурной цепи ДНК и ненасыщенными участками циркония, присутствующими в MOК [143], или инкапсуляцию [299]. Столбчатые слоистые и сетчатые 3D-металлоорганические каркасы MOК создаются посредством образования прочной химической связи между органическими лигандами и ионами металлов. MOК, используемые в биомедицинских целях, обычно содержат металлы, необходимые организму, такие как железо, цинк, марганец или магний. Наличие металла в структуре MOК характеризует МОК как мощный антибактериальный препарат из-за способности высвобождать ионы металлов с антимикробными свойствами [299]. Высоколюминесцентные столбчатые микропористые структуры МОК, содержащие лантаниды Eu3+ в каркасе МОК, обеспечивают устойчивость МОК и являются перспективным люминесцентным сенсором для выявления низкомолекулярных органических молекул и ионов металлов в биологической жидкости или в образцах (почва, вода) окружающей среды [300]. ZIF-8 использовался для доставки различных противораковых препаратов, включая куркумин (CCM) [20, 301] и доксорубицин (DOX) [20, 302, 303], камптотецин (CPT) [20, 304] и олигодезоксинуклеотиды CpG (дезокси-цитидилфосфогуанозин) [305]. Недавно разработанная многофункциональная система доставки лекарств, содержащая кверцетин (QT) FA-BSA/CuS@ZIF-8-QT, может стать перспективной наноплатформой для лечения рака в системах in vivo и in vitro [306]. Нуклеазы и некодирующие РНК, включая ДНКзим, рибонуклеазу А (РНКазу А), микроРНК (миРНК) и малые интерферирующие РНК (siRNA), регулируют экспрессию генов и достигают терапевтических целей путем подавления определенных генов. Однако восприимчивость к деградации в биологических средах и низкое клеточное поглощение ограничивают их применение. Как показали исследования с ZIF–8, устранение недостатков, перечисленных маркеров, связаны с проявлением уникальных свойств МОК-композитов, способных доставлять молекулярные маркеры нуклеиновых кислот к раковым клеткам. При этом, высвобождаемые ионы цинка, выполняющие функцию кофактора в реакции ферментативного расщепления, способны улучшить эффективность регуляции экспрессии генов [285]. Молекулы белка, встроенные в поверхностную область MOK, демонстрируют высокую биологическую активность. Так, цитохром с (Cyt c), встроенный в ZIF-8, показал 10-кратное увеличение активности пероксидазы по сравнению со свободным Cyt c в растворе и, таким образом, обеспечил быстрое и высокочувствительное обнаружение следовых количеств взрывоопасных органических пероксидов в растворе [307]. Успех химиотерапии глиомы зависит от концентрации и накопления вводимого препарата в опухоль, и часто сопровождается тяжелой токсичностью в нормальных органах. Проявление многофункциональных свойств нанокомпозитов на основе ZIF-8, используемого в качестве тераностического агента для диагностики и терапии in vivo одновременно, привлекает многих исследователей [308]. С этой целью был синтезирован низкотоксичный биметаллический цеолитный имидазолатный каркас (Mn-ZIF-8) с хорошей диспергируемостью и высокой удельной площадью поверхности, способный увеличить емкость носителя для лекарственных препаратов при терапии глиомы. Направленная доставка, как показали результаты применения, значительно повышает терапевтическую эффективность Mn-ZIF-8/5-Fu, загруженный 5-фтор-урацилом (5-Fu), проявляющим хорошую биосовместимостью in vivo, чувствительность к pH у мышей с опухолью U87-MG, что привело к 80% выживаемости животных в течение 40 дней лечения [309]. Другим перспективным направлением является использование MOК для разработки контрастных агентов, которые могут предоставить более точные морфологические и патофизиологические данные для диагностики и лечения глиобластомы (ГБМ) [310]. Целый ряд фактов указывает на роль ионов металлов в регуляции этих процессов. Обсуждался потенциал наноплатформ с включением оксида железа, марганца (Mn), гадолиния (Gd), 19F и меди (Cu) для визуализации ГБМ, а также двухмодальных или трехмодальных нанозондов в качестве средств преодоления ограничений каждого метода визуализации [310]. Устойчивость к противомикробным препаратам (УПП) представляет собой значительную угрозу для общественного здравоохранения, так как она снижает эффективность антибиотиков и способствует росту распространенности инфекционных заболеваний как в развитых, так и в развивающихся странах. Согласно последним прогнозам, к 2050 году УПП может стать основной причиной смерти около 10 миллионов человек в мире [311]. В настоящем исследовании [312] предложен комбинированный подход к созданию металлоорганических каркасов (MOК) с загруженными противомикробными агентами для обеспечения длительного высвобождения встроенных препаратов. В частности, MOК-5 на основе цинка был модифицирован путем инкапсуляции двух высокоэффективных антибактериальных препаратов: метронидазола (Met) для получения met@MOК-5 и цефалоспорина цефалексина (Ceph) для получения ceph@MOК-5. Затем эти модифицированные MOК были интегрированы в биоразлагаемые полимеры полилактид-когликолид (PLGA) и поликапролактон (PCL), что позволило создать композитные материалы PLGA-met@MOК-5, PLGA-ceph@MOК-5, PCL-met@MOК-5 и PCL-ceph@MOК-5 соответственно. Антибактериальная активность полученных нанокомпозитов была тщательно оценена in vitro против широкого спектра патогенных микроорганизмов, включая грамотрицательные бактерии, такие как Escherichia coli и Acinetobacter baumannii, а также грамположительные бактерии, такие как Staphylococcus aureus и Staphylococcus epidermidis [313] Результаты показали, что модифицированные нанокомпозиты демонстрируют значительно повышенную эффективность по сравнению с исходными препаратами, что открывает новые перспективы для разработки инновационных антимикробных материалов для медицины [312]. В другом исследовании продемонстрировано, что покрытие поверхности нанолистов MXenes полимерами обеспечивает создание материалов с более надежной биоцидной активностью. Так рост in situ цеолитимидазольного каркаса-8 (ZIF-8) на поверхности МХеnеs Ti3C2Tx и последующее электроформование с раствором полимолочной кислоты (PLA) приводит к получению мембран с регулируемой в ближнем инфракрасном диапазоне (NIR) фототермической/фотодинамической терапии, устойчивых к лекарствам бактериальных инфекций. Гипертермия и образование АФК при БИК-облучении приводят к степени бактерицидности более 99.8% как для E. coli, так и для MRSA для мембраны MXene/ZIF-8/PLA, что открывает новые возможности для заживления ран, инфицированных бактериями с множественной лекарственной устойчивостью. Покрытие MXene, имеющего отрицательный поверхностный заряд, ZIF-8 меняет заряд мембраны на положительный [314, 315]. 7.4. Инновационные биосенсорные платформы КТ и МОК на основе системы CRISPR/Cas В последние годы успешно разрабатываются и широко внедряются в клиническую медицину новые биосенсоры для обнаружения инфекционных вирусов и патогенных бактерий. Интегрированные в передовые технологии новые методы диагностики патогенных микроорганизмов, вирусов и биомаркеров рака способствуют улучшению выявления их на ранних стадиях инфекции с высокой чувствительностью и специфичностью. В частности, в литературе широко представлены достижения в области нано/биосенсоров на основе систем CRISPR/Cas и их применение для обнаружения инфекционных вирусов и патогенных бактерий [316, 317]. Технология CRISPR продемонстрировала хорошие возможности и перспективы при обнаружении различных патогенов инфекционных и онкологических заболеваний с высокой чувствительностью и селективностью. В работе [317] был разработан электрохимический биосенсор ctDNA EGFR L858R на основе системы CRISPR/Cas12a и нанокомпозитов MB/Fe3O4@COF/PdAu. Система CRISPR/Cas12a способна распознавать целевую опухолевую ctDNA и расщеплять одноцепочечную ДНК. Кроме того, нанокомпозит MB/Fe3O4@COF/PdAu обладает хорошей каталитической активностью и эффективностью усиления сигнала. Предлагаемый электрохимический биосенсор показал высокую специфичность, чувствительность, стабильность и селективность. В частности, предел обнаружения ctDNA с использованием предлагаемого биосенсора составил 3,3 аМ [317]. 7.5. Инновационная платформа использования флуоресцентного биосенсора на основе системы CRISPR/Cas Чрезвычайно интересным направлением является поиск новых подходов к диагностике с использованием кластерных регулярно расположенных коротких палиндромных повторов (CRISPR) на основе нуклеиновых кислот. Новые методы представляют собой быстрые и экономичные диагностические платформы, которые обеспечивают высокую чувствительность и специфичность без необходимости использования сложных инструментов. Традиционные флуоресцентные репортерные зонды на основе FRET обычно готовятся с использованием флуорофора и гасителя. В настоящее время обнаружено, что различные современные наноматериалы, такие как наночастицы Au, оксида графена (GO), металлоорганических каркасов (MOК) и углеродных нанотрубок (SWNT), обладают сверхвысокой способностью гасить флуоресценцию и используются в качестве эффективных гасителей в диагностических биосенсорных FRET-системах [318, 319]. Используя MOК UiO66 в качестве гасителя флуоресценции, группа Cao успешно разработала новую стратегию флуоресцентного зондирования, основанную на системе CRISPR/Cas9, которая запускает двухэтапную изотермическую амплификацию для обнаружения пищевых патогенных бактерий. В этой стратегии UiO66 выполняет две функции, которые включают адсорбцию, меченной флуорофором, одноцепочечной ДНК и гашение флуоресценции флуорофора. В присутствии целевой ДНК система CRISPR/Cas9 выполняет распознавание и расщепление в направлении одноцепочечного разрыва целевой ДНК. Наработка оцДНК (ssDNA) производится после первого цикла амплификации с использованием ферментов. Адсорбция, меченной флуорофором оцДНК на поверхности МОК UiO66Б, привела к тушению флуоресценции флуорофора. Способность оцДНК гибридизоваться с флуоресцентными зондами, вызывая десорбцию флуоресцентных зондов из UiO66, приводит к восстановлению флуоресценции. На этом принципе было проведено флуоресцентное зондирование и количественная оценка целевой ДНК [320]. Новая инновационная платформа использования флуоресцентного биосенсора на основе системы CRISPR/Cas12a, включает несколько стадий: распознавание целевой последовательности CRISPR, расщепление зонда нуклеиновой кислоты с применением ферментов Cas и использование высокофлуоресцентных свойство КТ для определения вирусной ДНК. Чувствительное и точное обнаружение охратоксина А (ОТА) имеет решающее значение для общественного здравоохранения из-за его высокой токсичности. Используя гетероструктуры КТ и МОК CdS/UiO-66-NH2, присоединенные к наночастицам Au (NP), в качестве фотоактивных материалов, был создан фотоэлектрохимический (PEC) аптасенсор для сверхчувствительного анализа ОТА. В этой стратегии обнаружения оцДНК, меченная метиленовым синим (MB-ssDNA), была иммобилизована на электроде Au NPs/CdS/UiO-66-NH2. В присутствии OTA он специфически связывался с аптамером (Apt) и приводил к высвобождению цепи активации, запуская характеристики трансрасщепления CRISPR/Cas12a. Аптасенсор PEC, полученный с помощью CRISPR/Cas12a, продемонстрировал превосходную чувствительность и специфичность с линейным диапазоном от 100 до 50 нг/мл и пределом обнаружения 38 фг/мл. Таким образом, предлагаемый аптасенсор позволяет обеспечить быстрый, точный и чувствительный метод определения ОТА в реальных образцах [320]. Многофункциональный фотоэлектрохимический (РЕС) биосенсор на основе квантовых точек (КТ) ZnIn2S4 (ZIS)/ZnS@Au-Ag-обратный фототок Cu-металл-органического каркаса (MOК) в сочетании с CRISPR/Cas-12a-shiaring был инновационно разработан для анализа двойных целей. Созданный биосенсор продемонстрировал превосходные свойства PEC и были объединены с уникальной системой CRISPR-Cas12a для достижения чувствительного обнаружения двойных целей. Метод позволяет использовать новую платформу PEC с обратной полярностью для быстрого и точного анализа нескольких целей и эффективно избегать ложноположительных результатов в клинических испытаниях [321-323]. 8. ТЕРАНОСТИЧЕСКАЯ НАНОПЛАТФОРМА НА ОСНОВЕ МОК MOК как новый агент визуализации из-за разнообразия их структур, размеров и узлов металлических соединений, может вызывать эффект усиления сигналов в целевых участках и увеличения их контраста. Проявление эффекта повышенной проницаемости и удерживания (EPR) увеличивает вероятность того, что эти наночастицы будут накапливаться в опухолевых участках в сочетании с молекулами, нацеленными на опухоли. Таким образом MOК оказались чрезвычайно чувствительными и гибкими материалами для визуализации [324], дополняя существующие инструментальные методы визуализации опухоли. Так, композитный материал с магнитными свойствами MIL-100 (Fe) продемонстрировал отличную противоопухолевую активность и биосовместимость после загрузки доксорубицином (Dox), что позволило использовать его в качестве контрастного вещества для МРТ [4, 89, 324, 325]. В работе и соавт. MOК продемонстрировали способность интернализации систем, нагруженных Dox, более эффективно, чем системы, содержащие свободный Dox, на мышиных моделях [326]. Полученный конъюгат Dox/Cel/MOК@Gel применяли для терапии рака ротовой полости. Результаты проточной цитометрии и флуоресценции показали, что поверхность MOК с мембранными оболочками DPSC улучшает интернализацию клеток в клетки CAL27 и способствует специфическому селективному связыванию для лечения рака ротовой полости (OSCC). 9. СУПРАМОЛЕКУЛЯРНЫЕ ГИБРИДНЫЕ НАНОСТРУКТУРЫ НА ОСНОВЕ МОК Пилларарены, как новый тип макроциклических молекул, из-за их уникальных структурных и химических свойств привлекают большое внимание при создании супрамолекулярных систем доставки лекарств. Стратегия с применением супрамолекулярных гибридных наноструктур МОК ZIF-8@DOX@WP6@G путем образования комплекса «хозяин-гость», открывает новые возможности для создания многофункциональных супрамолекулярных гибридных материалов для терапевтического применения при лечении рака [327-330]. Так синтезированный комплекс ZIF-8@DOX@WP6@G, содержащий карбоксилированный pillar [6] arene (WP6) с производным галактозы (G) и МОК ZIF-8, с иммобилизованным доксорубицином (DOX), продемонстрировал превосходную диспергируемость в воде и избирательную токсичность для клеток рака гепатомы [327]. В другой стратегии НЧ Ag были включены в COF путем диспергирования обоих компонентов в воде для получения композитных НЧ TpPa-1@Ag [137]. НЧ Ag несут водорастворимые столбчатые [6] ареновые макроциклы (WP6), позволяющие иммобилизовать НЧ Ag на поверхности TpPa-1 за счет Н-связывания и π–π-взаимодействий. Кроме того, WP6 обеспечил селективное распознавание целевого аналита, например, параквата, показав превосходную аналитическую эффективность при определении этого гербицида в озерной и водопроводной воде с пределом обнаружения 0,014 мкМ [332]. Полученные супрамолекулярные системы на основе пиллар[n]аренов или каликс[n]аренов, рассматриваются как перспективная платформа для дизайна новых лекарственных препаратов, обладающих способностью реагировать на внешние стимулы и создание контролируемых систем доставки лекарств [327-332]. 10. ЭКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГИБРИДНЫХ СТРУКТУР МОК В настоящее время множество загрязняющих веществ окружающей среды, как естественного, так и антропогенного происхождения, проникают в атмосферу, в почву и в водоемы, представляя значительный риск для здоровья человека. Многие из них содержатся в природных источниках в сверхнизких концентрациях. К наиболее опасным для человека и живым организмам газообразным соединениям относятся аммиак (NH3), диоксид азота (NO2), оксид азота (NO), сероводород (H2S), диоксид серы (SO2), диоксид углерода (CO2), оксид углерода (CO) и другие. Содержание этих газов в природных источниках могут вызывать угрозу для человека, вызывая поражение кожи, дыхательной системы, возрастание риска отека легких и нарушение общего состояния здоровья человека [98]. Так избыток NO в воздухе может привести к астме и раку [100]. Необходимость мониторинга этих газов с помощью разработанных высокочувствительных газовых датчиков c примененнем новых материалов представляет собой важное направление охраны окружающей среды. MOК и COF представляют два класса адсорбентов для эффективного удаления и селективной изоляции различных загрязнителей (таблица 4). MOК могут быть синтезированы с ионами большинства металлов, представленными в Периодической таблице элементов Д. И. Менделеева. Кроме того, пористые MOК, как правило, физиологически стабильны, обладают переменной структурой и регулируемым диаметром пор, большой площадью поверхности, хорошей термической стабильностью, высокой загрузкой лекарственного средства, замедленным высвобождением, функциональностью и отличной биосовместимостью, что делает их подходящими для функционализации целевых биомолекул [59-61]. Композиты на основе MOК способны в интеграции точно настроенных взаимодействий хозяин-гость в их пористых каркасах, что делает их весьма перспективными кандидатами для приложений газового зондирования. При этом различные металлы, включенные в структуру MOК, приводят к образованию различных по структурам пор и свойствам поверхности, влияя на их селективность по отношению к газам. ZIF-8, содержащий делокализованные электроны π-связи может выступать в качестве донора электронов и обеспечивать множественные каналы переноса электронов, которые ускоряют перенос фотогенерированных электронов, что способствуют увеличению фотокаталитической производительности датчика [333, 334]. Экологические преобразования с использованием МОК могут проложить путь к утилизации парниковых газов CO2 и CH4, поскольку эти два парниковых газа могут быть преобразованы посредством обратной реакции конверсии водяного газа (CO2 + H2 → CO + H2O) и стратегии риформинга (сухой риформинг с помощью CO2, паровой риформинг с помощью H2O и окислительный риформинг с помощью O2), соответственно, в чистое топливо или ценные химические продукты [57, 58]. В последнее время COFs и MOK с высокоупорядоченными кристаллическими структурами продемонстрировали большие перспективы для применения в очистке сточных вод [335]. Фармацевтика и лекарства также представляют собой все возрастающую проблему для сохранения водных ресурсов и окружающей среды (таблица 4) [335-337].
ЗАКЛЮЧЕНИЕ Металлоорганические каркасы (MOК, COF и их композиты) с биосенсорными платформами привлекли значительное внимание благодаря своим превосходным характеристикам, такими как увеличенная площадь поверхности, адаптируемая пористость и превосходная химическая и термическая стабильность. Новые сведения использования биосенсоров на основе MOК, COF и их композитов в медицинских приложениях и количественной оценки биомаркеров, токсинов, тяжелых металлов, патогенов и других аналитов, представляющих интерес, вносят значительный вклад в современную диагностику, решая при этом экологические проблемы. Применение биосенсоров на основе MOК, COF открывает новые пути и потенциальные возможности в разработке аналитических инструментов следующего поколения для медицины с улучшенными характеристиками и широким использованием. В последнее время структурированные материалы MOК, нанокомпозиты КТ@MOК используются в качестве фотокатализаторов в таких областях, как удаление органических загрязнителей, выявление пестицидов и антибиотиков, а также обнаружение тяжелых металлов, переработка отходов фармацевтической промышленности, такие как антибиотики и гормоны, которые считаются новыми загрязнителями окружающей среды и продуктов питания, восстановление окружающей среды, связанных с производством H2, фотокаталитическое восстановлением CO2 для получения топлива (например, метана), разложение органических красителей, восстановление ионов металла, окисление ядовитых газов (NO) и т. д. Регулируя размер пор, геометрию пор и функциональность поверхности MOК и COF при синтезе рамочных структур можно добиться высокой селективности МОК и COF по отношению к конкретным молекулам, открывая путь к материалам нового поколения с оптимизированными характеристиками и расширенными функциональными возможностями. В этом направлении искусственный интеллект (ИИ) и машинное обучение (МО) способны предложить революционные решения получения уникальных соединений, на основе анализа химической базы данных и алгоритмов МО [336]. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов исследования. ФИНАНСИРОВАНИЕ Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации по теме "Mедико-биологическое исследование борсодержащих наночастиц и бионаноконструкций для диагностики и бор-нейтронозахватной терапии поверхностных злокачественных опухолей" проект (№ 1024011000011-7-1.4.2;3.5.2.) КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|