К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ |
Исследование эстеразного статуса организма как комплексного биомаркера воздействия фосфорорганических соединений
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
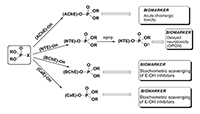
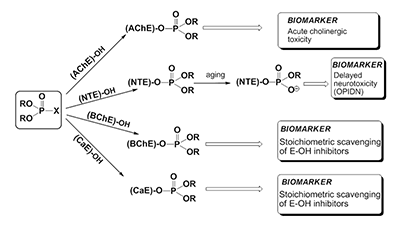
*e-mail: gmakh@ipac.ac.ru Ключевые слова: ацетилхолинэстераза (АХЭ); бутирилхолинэстераза (БХЭ); нейротоксичная эстераза (НТЭ); карбоксилэстераза (КЭ); кровь; биомаркер; фосфорорганические соединения (ФОС) DOI: 10.18097/BMCRM00028 ВВЕДЕНИЕ Фосфорорганические соединения (ФОС), обладающие антихолинэстеразными свойствами, широко используются в качестве инсектицидов, в меньшей степени в качестве терапевтических средств: для лечения шистосомоза, глаукомы и болезни Альцгеймера (БА). Высокотоксичные ФОС производились и использовались рядом стран в качестве химического оружия, и используются террористами в настоящее время. Возросшая активность международного терроризма создает угрозу новых сценариев катастроф, в том числе с применением известных фосфорорганических агентов. Помимо этого, широкое применение пестицидов в сельском хозяйстве и в быту делает эти соединения доступными для различных слоев населения и, следовательно, расширяет возможность их использования в террористических целях. ФОС как известной, так и неизвестной структур могут также образовываться в результате инцидентов на химических предприятиях и складах. Безопасность использования ФОС и защита от возможных воздействий этих соединений в экстремальных ситуациях требуют быстрой, чувствительной и специфичной детекции как самих соединений, так и их биологических эффектов. Таким образом, разработка системы биомаркеров воздействия ФОС на человека является важным компонентом предсказания и ранней диагностики заболеваний, вызываемых этим соединениями. Рассмотрим более подробно некоторые основные понятия, используемые в данной статье. Термин «биомаркер» используется для обозначения биологических, биохимических и молекулярных показателей, которые можно измерить с помощью химических, биохимических или молекулярных методов [1]. Биомаркеры характеризуют взаимодействие организма с потенциально опасными агентами различной природы (физической, химической, биологической и т.д.). Желательно, чтобы биомаркеры присутствовали в легко и этически доступных для анализа тканях организма человека, одной из которых является кровь. Биомаркеры обычно делятся на три категории: биомаркеры воздействия, эффекта и чувствительности [2]. ФОС, ковалентно связанные с белками (например, с ферментами или сывороточным альбумином), более устойчивы в организме, чем интактные (свободные) соединения, которые быстро элиминируются защитными системами. В связи с этим актуальной является разработка новых методов идентификации и количественной оценки степени модификации белков-биомаркеров. Собственная эффективность взаимодействия антихолинэстеразных соединений с эстеразами-мишенями in vitro характеризуется«эстеразным профилем» соединения – набором кинетических констант, описывающих ингибиторную активность соединения в отношении эстераз различной функциональной значимости: ацетилхолинэстеразы (АХЭ, КФ 3.1.1.7), нейротоксичной эстеразы (НТЭ, КФ 3.1.1.5), бутирилхолинэстеразы (БХЭ, КФ 3.1.1.8), карбоксилэстеразы (КЭ, КФ 3.1.1.1). Анализ эстеразного профиля позволяет получить более полную картину биологической активности соединения и дать предварительную оценку характеру токсического действия соединения [3]. ОНТФОС («отставленная нейротоксичность, вызываемая фосфорорганическими соединениями») - дистальные нейропатии, проявляющиеся после 2-3 недельного латентного периода в результате воздействия нейропатичного соединения и характеризующиеся дегенерацией длинных аксонов периферической и центральной нервной системы. Такие соединения инактивируют НТЭ предпочтительнее, чем АХЭ [4-6]. Нейропатичный потенциал (relative inhibitor potency, RIP) оценивается как относительная ингибиторная способность соединения в отношении двух ферментов-мишеней острой (АХЭ) и отставленной (НТЭ) нейротоксичности: RIP = IС50(AChE) / IС50(NTE) [7]. Для оценки нейропатичной опасности соединения предложено использовать отношение бимолекулярных констант ингибирования НТЭ в сравнении с АХЭ: RIP = ki (NTE) / ki(AChE) [8,9]. Показано, что относительная способность ФОС или его активного метаболита ингибировать НТЭ по сравнению с АХЭ коррелирует с отношением между величиной LD50 и минимальной нейропатичной дозой (доза, вызывающая атаксию). При этом RIP > 1 указывает на то, что соединение может вызывать ОНТФОС в дозе, меньшей LD50, тогда как величины RIP < 1 свидетельствуют о том, что доза, необходимая для инициирования ОНТФОС, будет выше LD50 [7,10]. Характерной особенностью ФОС ˗ производных пятивалентного фосфора является их ковалентное взаимодействие с серином активного центра сериновых эстераз. При попадании в организм ФОС конкурентно взаимодействуют с различными сериновыми эстеразами (рис. 1). Эти ферменты включают первичные биомишени - АХЭ нервной ткани (мишень острой холинергической токсичности) [11] и НТЭ (мишень отставленных нейропатий, индуцированных ФОС, ОНТФОС) [8], а также вторичные мишени (нецелевые мишени, взаимодействие с которыми не приводит к физиологическому эффекту) такие как бутирилхолинэстераза (БХЭ) и карбоксилэстераза (КЭ), которые действуют как стехиометрические скэвенджеры ФОС, т.е. являются сайтами альтернативного фосфорилирования, снижая тем самым концентрацию активного ФОС, доступного для взаимодействия с АХЭ или другими биомишенями [12-14]. В качестве эстераз-мишеней в последнее время рассматривают и другие белки, ковалентно связывающие ФОС, такие как ацилпептидгидролаза, гидролаза амидов жирных кислот (fatty acid amide hydrolase), арилформамидаза, сывороточный альбумин [15-17].
Структурное и фармакодинамическое сходство между АХЭ нервной ткани и АХЭ эритроцитов позволяет использовать АХЭ крови в качестве удобной модели для оценки степени ингибирования АХЭ мозга ФОС [11]. Активность АХЭ эритроцитов отражает ситуацию в тканях-мишенях (особенно в периферических отделах, например, в нервно-мышечных соединениях) и может рассматриваться как подходящий параметр для биологического мониторинга воздействия антихолинэстеразных агентов [18], а также как ценный инструмент для мониторинга и оптимизации в лечебной диагностике. Нейропатичные соединения в результате селективного ингибирования НТЭ нервной ткани (по сравнению с АХЭ) могут вызывать незначительные или вовсе не вызывать никаких настораживающих признаков острой холинергической интоксикации. При этом жертвы нейропатичных ФОС могут и не подозревать о том, что они подверглись воздействию до тех пор, пока спустя 1-3 недели не разовьется клиническая картина ОНТФОС [8]. В связи с этим, частью эффективной стратегии химической защиты является разработка методов обнаружения отставленных нейропатических агентов с помощью чувствительных и селективных биомаркеров [9]. Обнаружение НТЭ в циркулирующих лимфоцитах и тромбоцитах [19-22] позволило использовать данный фермент в качестве биомаркера воздействия нейропатичных ФОС на животных и человека [22-27]. Разработанный нашей группой электрохимический метод определения активности НТЭ с использованием биосенсоров на основе тирозиназы позволил проводить измерения активность НТЭ в цельной крови [28-31], что невозможно сделать с использованием стандартного колориметрического анализа. Созданный биосенсор был использован для установления корреляций между ингибированием НТЭ в головном мозге, лимфоцитах и крови кур через 24 ч после введения нейропатичного соединения O,O-дипропил-O-дихлорвинилфосфата (diPr-DClVP) [29]. Эти исследования убедительно продемонстрировали, что НТЭ цельной крови является надежным биомаркером воздействия нейропатичных ФОС в течение 96 ч с момента воздействия до момента измерения [31]. Поскольку многие ФОС реагируют с нецелевыми эстеразами плазмы крови in vitro более эффективно, чем с АХЭ, и учитывая, что эти белки-скэвенджеры будут первыми сайтами связывания ФОС после их поступления в кровь, именно вторичные мишени, как правило, и являются более чувствительными биомаркерами по сравнению с АХЭ эритроцитов, что позволяет обнаруживать воздействие более низких доз ФОС. Измерение активности БХЭ как в плазме (или сыворотке), так и в цельной крови обычно используется как чувствительный маркер воздействия ФОС [11,32-34]. В целом, АХЭ и БХЭ, имеющие полупериод жизни 5-16 дней, представляют собой превосходные биомаркеры воздействия ФОС [18]. Набор активностей 4-х сериновых эстераз (АХЭ, НТЭ, БХЭ и КЭ), а также активности параоксоназы (PON1), которая может гидролизовать и детоксицировать ФОС и действовать как каталитический скэвенджер [35], нами было предложено объединить в понятие «эстеразный статус» организма [36-38]. Этот термин в настоящее время является общепринятым [39]. Эстеразный статус включает аспекты воздействия и чувствительности, он в значительной степени определяет видовую и индивидуальную чувствительность к антихолинэстеразным соединениям и может быть использован в качестве комплексного биомаркера воздействия этих соединений [37]. Мы предположили, что эстеразный статус организма как комплексный биомаркер будет более эффективным и информативным по сравнению со стандартным определением БХЭ плазмы, АХЭ эритроцитов и НТЭ лимфоцитов [37,40]. Определение эстеразного статуса позволит: 1) оценить сам факт воздействие ФОС на человека или подтвердить его отсутствие; 2) определить, обусловлено ли воздействие агентами, вызывающими острую и/или отставленную нейротоксичность; 3) провести дозиметрию воздействия, которая даст ценную информацию для лечения. Одновременное определение активностей 4-х эстераз и PON1, гидролизующей ФОС и в значительной степени определяющей чувствительность к этим соединениям, позволит улучшить возможности диагностики и прогноза развития интоксикаций. Для подтверждения нашей гипотезы мы провели детальное исследование изменения активности АХЭ, НТЭ, БХЭ и КЭ крови мышей через 1 ч после внутрибрюшинного (в/бр) введения возрастающих доз трех ФОС с различными эстеразным профилем и различной острой холинергической и отставленной нейротоксичностью: известного нейропатичного соединения О,О-дипропил-O-дихлорвинилфосфата (C3H7O)2 P(O)OCH=CCl2 (diPr-DClVP) в качестве контрольного соединения и двух модельных соединений, представителей фосфорилированных гексафторизопропанолов - этильного (C2H5O)2P(O)OCH(CF3)2 (diEt-PFP) и бутильного (C 4H9O)2P(O)OCH(CF3)2 (diBu-PFP) производных. diPr-DClVP – высокотоксичное соединение (LD50 = 10 мг/кг, куры [41], 15 мг/кг, мыши [42]), которое обладает и высоким нейропатичным потенциалом (RIP = 2.6, куры [7]); diEt-PFP обладает средней острой токсичностью (LD50 = 200 мг/кг) и низким нейропатичным потенциалом (RIP = 0.07) [43]; более гидрофобный diBu-PFP наоборот имеет низкую острую токсичность (LD50 > 2000 мг/кг) и высокий нейропатичный потенциал (RIP = 6.6) [44]. Перед проведением исследования были разработаны спектрофотометрические методы анализа АХЭ, БХЭ и КЭ в цельной крови [38] и определены базовые активности АХЭ, БХЭ, КЭ и НТЭ в крови мышей [38,45,46]. Ранее в детальном исследовании нами было показано, что НТЭ крови мышей доз-зависимым образом отражает действие нейропатичных ФОС и является надежным биохимическим маркером воздействия нейропатичных соединений [47,48]. МАТЕРИАЛЫ И МЕТОДЫ Материалы В работе использованы следующие реактивы: S-ацетилтиохолин иодид (АТХ); S-бутирилтиохолин иодид (БТХ); 5,5'-дитиобис-2-нитробензойная кислота (ДТНБ), трис(гидроксиметил)аминометан гидрохлорид (Трис), феррицианид калия (K3[Fe(CN)6]), этилендиаминтетрауксусная кислота (ЭДТА), протеин стандарт - бычий сывороточный альбумин (BSA), хлорид кальция (CaCl2); диметилсульфоксид (DMSO), этопропазин (ЭПр), 1-нафтилацетат (1-NA), 4-нитрофенилацетат (4-NPA), фенилацетат (PhA), эзерин, диэтил-4-нитрофениловый эфир фосфорной кислоты (параоксон, РО), тетра(моноизопропил)пирофосфотетрамид (iso-OMPA), бис-пара -нитро-фенилфосфат (BNPP) фирмы «Sigma-Aldrich» (США); 4-аминоантипирин (4-ААП) («Acros organics», Бельгия); фенилвалерат (PhV) и мипафокс (МХ) («Oryza Laboratory Inc.», США), цитрат натрия («Merck», Германия). О-фосфорилированные гексафторизопропанолы (PFP): O,O-диэтил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат (diEt-PFP) и O,O-дибутил-O-(1-трифторметил-2,2,2-трифторэтил)фосфат (diBu-PFP); O,O-ди-1-пропил-О-2,2-дихлорвинилфосфат (diPr-DClVP) синтезированы и охарактеризованы в лаборатории синтеза физиологически активных веществ ИФАВ РАН. Синтез diEt-PFP и diBu-PFP проводился по методу, описанному в работах [43,49]. Все остальные реактивы были марки не ниже х.ч. и использовались без предварительной очистки. Все водные растворы готовились в бидистиллированной воде. Исследование эстеразного профиля соединений В качестве стандартных источников ферментов использовались коммерческие препараты ферментов фирмы «Sigma-Aldrich» - АХЭ эритроцитов человека, БХЭ сыворотки крови лошади, КЭ печени свиньи, и стабильный лиофилизованный препарат НТЭ мозга кур (ЛиоНТЭ), полученный по методике, разработанной в нашей лаборатории [50]. Активность АХЭ и БХЭ определяли колориметрическим методом Эллмана [51] с использованием ацетил- и бутирилтиохолина в качестве субстрата. 4-Нитрофенилацетат использовали для спектрофотометрического измерения активности КЭ. НТЭ определяли методом дифференциального ингибирования Johnson M.K. [52], субстрат-фенилвалерат, как детально описано в работе [29]. Измерения проводились на микропланшетном ридере Bio-Rad Benchmark Plus (France). Исследуемые ФОС растворяли в ДМСО. Для кинетических исследований ингибирования АХЭ, НТЭ, БХЭ и КЭ in vitro препарат соответствующего фермента инкубировали с ингибитором в рабочем буфере с конечной концентрацией ДМСО, не более 1% по объему в течение разных интервалов времени, затем определяли остаточную активность фермента. Измерения проводились в трех повторах для каждого эксперимента. Величины бимолекулярных констант ингибирования эстераз исследуемыми ФОС (ki, М-1мин-1) определяли в соответствии с [53]. Расчет и регрессионный анализ проводились с использованием программы Origin 6.1. Эксперименты на животных
Эксперименты in vivo проводили на самцах белых
аутбредных мышей линии CD1 весом 20-25 г в возрасте 1.5 - 2 месяцев
(Пущино, Россия). Содержание животных и все эксперименты осуществлялись в
соответствии с протоколами, одобренными Комитетом по этике Института
физиологически активных веществ РАН (Черноголовка, Россия).
Приготовление препаратов гемолизованной крови Замороженные образцы крови медленно оттаивали при +4°С и разбавляли 1:100 (объм:объем) охлажденным 0.1 М K-Na-фосфатным буфером pH 7.5. После тщательного перемешивания в течение 2 мин образцы гемолизованной крови аликвотировали в пластиковые пробирки Falcon, немедленно замораживали в жидком азоте для обеспечения полного гемолиза и хранили при -20°C до проведения измерений. Перед началом измерений образцы медленно оттаивали на водяной бане со льдом. Определение активности эстераз в препаратах крови мышей Активность АХЭ в гемолизованной крови мышей оценивали по скорости гидролиза 1 мМ ацетилтиохолина колориметрическим методом Эллмана [51] в 0.1 M K-Na-фосфатном буфере pH 7.5 при 25°C в присутствии специфического ингибитора БХЭ этопропазина (0.02 мМ) [54-56]. Для снижения интерферирующего влияния абсорбции гемоглобина стандартная длина волны для метода Эллмана (412 нм, e412 = 14150 M-1 × см-1) была изменена на 436 нм (e436 = 10600 M-1 х см-1) [56]. Активность БХЭ в крови измеряли в тех же условиях с использованием 1 мМ бутирилтиохолина в качестве субстрата. Спектрофотометрическое определение активности КЭ в гемолизованной крови проводили с использованием 1 мМ 1-нафтилацетата в качестве субстрата при λ = 322 нм (ε322 = 2200 M-1 х см-1) [57,58] в 0.1 M K-Na-фосфатном буфере (pH 8.0) при 25°С. Для элиминирования активности PON1 и холинэстераз, гидролизующих 1-нафтилацетат, перед его внесением реакционную смесь инкубировали в течение 10 мин со специфическими ингибиторами PON1/арилэстераз (2 мM ЭДТА) и холинэстераз (40 мкМ эзерин) [59]. Активность НТЭ в крови определяли методом дифференциального ингибирования [52] с электрохимической детекцией, как описано ранее [28,29] (субстрат – фенилвалерат). Для амперометрического измерения продукта реакции (фенола) использовали чувствительный, стабильный планарный тирозиназный биосенсор конструкции SPE/PDDA/Tyr. Данный биосенсор был разработан с помощью комбинации технологии трафаретной печати для подготовки графитовой подложки и LBL-технологии последовательного (слой-за-слоем) нанесения полиэлектролитов [46,60]. Образцы гемолизованной крови 1:100 (объем:объем) инкубировали при 37°С в течение 20 мин с 50 мкМ раствором параоксона (проба В) и, параллелельно, с 50 мкМ параоксоном плюс 250 мкМ мипафоксом (проба С). Затем в обе пробы вносили субстрат фенилвалерат (конечная концентрация 0.54 мМ) и инкубацию продолжали в течение следующих 40 мин при 37°С. Реакцию останавливали добавлением 100 мкл 1% (масса/объем) водного раствора SDS. Общий объем реакционной смеси составлял 600 мкл. Образовавшийся в результате реакции фенол детектировали амперометрически после 20-50-кратного разбавления образцов 50 мМ Na-фосфатным буфером, содержащим 100 мM NaCl (pH 7.0). Аналитический сигнал сенсора определяли как разность величин стационарного тока до и после добавления пробы. Активности НТЭ рассчитывали, используя калибровочные зависимости по фенолу, полученные в тех же условиях, и вводили поправку на спонтанный гидролиз субстрата, измеренный в отдельных экспериментах. Активность НТЭ рассчитывали как разность фенилвалерат-гидролизующей активности в пробах В и С. Определение острой токсичности соединений было выполнено на самцах белых аутбредных мышей весом 20-25 г при в/бр введении 5-7 доз каждого соединения, 6-8 животных для каждой дозы. Срок наблюдения – 24 ч. Величины LD50 вычисляли методом пробит-анализа с использованием программы BioStat 2006 Professional. Статистическая обработка результатов Статистическая обработка и анализ результатов проводились с использованием программы GraphPad Prism 3.02. Результаты представлены как means ± SEM, доверительный интервал p < 0.05. Графики зависимостей, регрессионный анализ, корреляции получены с помощью программы Origin 6.1. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Исследование ингибиторной активности diEt-PFP, diBu-PFP и diPr-DClVP in vitro (эстеразный профиль соединений) Прежде всего мы определили ингибиторную активность исследуемых ФОС in vitro в отношении всех эстераз с использованием стандартного набора коммерческих ферментных препаратов - АХЭ эритроцитов человека, БХЭ сыворотки крови лошади, КЭ печени свиньи и полученного в лаборатории стабильного лиофилизованного препарата НТЭ мозга кур (ЛиоНТЭ) [50] и оценили острую токсичность соединений для мышей, LD50 (мг/кг) при в/бр введении через 24 ч. Ингибиторная активность diEt-PFP, diBu-PFP и diPr-DClVP in vitro в отношении АХЭ, БХЭ, КЭ и НТЭ, характеризующая эстеразный профиль соединений, представлена в таблице 1.
Важной характеристикой эстеразного профиля соединений является их ингибиторная селективность, которая определяется как отношение соответствующих величин бимолекулярных констант ингибирования ki: Sx/y = ki(Ex)/ki(Ey), где Х,Y = АХЭ, НТЭ, БХЭ, КЭ. Величины ингибиторной селективности исследуемых ФОС в отношении АХЭ, БХЭ, КЭ и НТЭ и острая токсичность соединений (LD50, мг/кг) приведены в таблице 2. Полученные результаты хорошо согласуются с ранее опубликованными данными [43,49].
Как видно из таблиц 1 и 2, все соединения ингибируют вторичные мишени, БХЭ и КЭ, более эффективно по сравнению с первичными мишенями, АХЭ и НТЭ. При этом diEt-PFP, обладающий умеренной острой токсичностью (LD50 = 200 мг/кг), проявляет низкую ингибиторную активность в отношении обеих первичных мишеней, АХЭ и НТЭ, имеет очень низкий нейропатичный потенциал (RIP = 0.07) и проявляет высокую селективность в отношении эстераз-скэвенджеров БХЭ и КЭ по сравнению с НТЭ. Практически нетоксичный diBu-PFP (LD50 > 2000 мг/кг) обладает более высокой ингибиторной активностью в отношении первичных мишеней АХЭ и НТЭ по сравнению с этильным производным, с предпочтительным ингибированием НТЭ и, соответственно, имеет высокий нейропатичный потенциал (RIP = 6.6), при этом проявляет высокую селективность в отношении БХЭ и КЭ по сравнению с АХЭ. Высокотоксичный diPr-DClVP (LD50 = 15 мг/кг) является наиболее сильным ингибитором как АХЭ, так и НТЭ и имеет высокий нейропатичный потенциал (RIP = 3.5). Таким образом, выбранные для исследования соединения обладают широким спектром собственной ингибиторной активности в отношении рассматриваемых эстераз и широким интервалом острой и отставленной нейротоксичности.
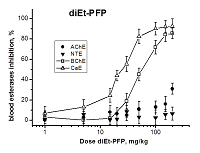
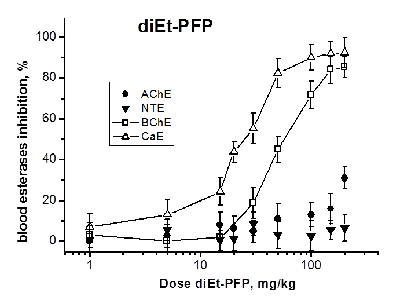
Исследование эффектов ФОС с различным эстеразным профилем на уровне целого организма (in vivo) Следующим этапом работы было исследование ингибирования АХЭ, НТЭ, БХЭ и КЭ крови мышей через 1 ч после в/бр введения возрастающих доз diEt-PFP, diBu-PFP и diPr-DClVP. Результаты экспериментов представлены на рисунках 2-4. Как видно из рисунка 2, diEt-PFP дозозависимым образом ингибирует БХЭ и КЭ крови мышей, причем ингибирование КЭ начинается при более низких дозах. В результате анализа кривых доза-эффект (рис. 2) были получены значения ED50 (медианные эффективные дозы) для ингибирования вторичных биомишеней БХЭ и КЭ в крови мышей данным соединением: ED50(БХЭ) = 46.8 ± 1.5 мг/кг; ED50(КЭ) = 25.0 ± 1.0 мг/кг (табл. 3). Что касается первичных мишеней, то при введении максимальной дозы diEt-PFP (200 мг/кг, равной LD50) отсутствует значимый ингибиторный эффект в отношении НТЭ крови, что подтверждает безопасность diEt-PFP с точки зрения развития отставленной нейропатии и соответствует низким величинам RIP = 0.07 (табл. 2). В отношении АХЭ наблюдается довольно слабое торможение активности – примерно на 30%, что хорошо согласуется с умеренной острой холинергической токсичностью соединения (LD50 = 200 мг/кг, табл. 2). Исходя из имеющихся данных (рис. 2), мы предположили, что значение ED50(АХЭ) должно быть более 300 мг/кг (табл. 3). Таким образом, при в/бр введении diEt-PFP БХЭ и КЭ крови являются более чувствительными биомаркерами воздействия, чем АХЭ крови. В данном случае БХЭ и КЭ могут рассматриваться как биомаркеры острой токсичности.
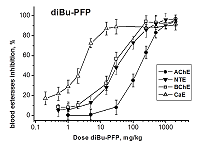
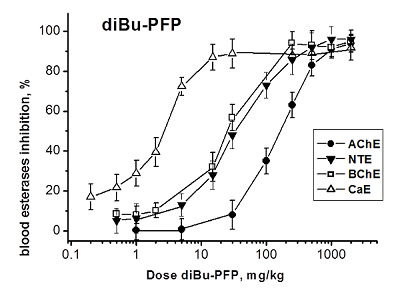
При в/бр введении diBu-PFP ингибирует все четыре эстеразы крови четко дозозависимым образом (рис. 3). В результате анализа кривых доза-эффект (рис. 3) были получены значения ED50 для ингибирования АХЭ, НТЭ, БХЭ и КЭ крови мышей данным соединением: ED50(АХЭ) = 154 ± 5 мг/кг; ED50(НТЭ) = 36.3 ± 3.6 мг/кг; ED50(БХЭ) = 25.1 ± 3.6 мг/кг; ED50(КЭ )= 3.1 ± 0.3 мг/кг (табл. 3). Как видно из рисунка 3, ингибиторная активность diBu-PFP в отношении НТЭ крови значительно выше, чем в отношении АХЭ: ED50 = 36 и 154 мг/кг, соответственно (табл. 3). Высокая ингибиторная селективность diBu-PFP в отношении НТЭ по сравнению с АХЭ крови, рассчитанная как отношение ED50 (АХЭ)/ED50 (НТЭ) = 4.24 (табл. 3), подтверждает высокую нейропатичную опасность этого низкотоксичного соединения (LD50 > 2000 мг/кг), предсказанную из анализа его эстеразного профиля, и соответствует величине RIP = 6.6 (табл. 2). Полученные данные указывают на то, что при воздействии diBu-PFP возможно развитие ОНТФОС без проявления признаков острой холинергической токсичности. Эстеразы-скэвенджеры - БХЭ и особенно КЭ - ингибируются данным соединением при более низких дозах, чем первичные мишени - АХЭ и НТЭ (табл. 3), т.е., являются более чувствительными биомаркерами воздействия diBu-PFP, чем первичные мишени. Таким образом, в случае нетоксичного в плане острой холинергической токсичности diBu-PFP, БХЭ и КЭ крови можно рассматривать как биомаркеры отставленной нейротоксичности.
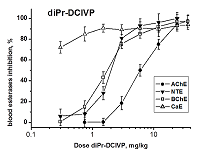
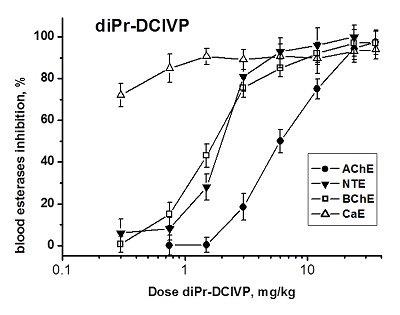
diPr-DClVP при в/бр введении также вызывает дозозависимое ингибирование всех исследуемых эстераз крови (рис. 4). В результате анализа кривых доза-эффект были получены значения ED50 для ингибирования АХЭ, НТЭ и БХЭ крови мышей данным соединением: ED50 (АХЭ) = 4.0 ± 0.2 мг/кг; ED50 (НТЭ) = 2.0 ± 0.1 мг/кг; ED50 (БХЭ) = 1.58 ± 0.11 мг/кг, что говорит о наибольшей ингибиторной эффективности diPr-DClVP в отношении всех эстераз по сравнению с diBu-PFP и diEt-PFP. Высокая степень ингибирования КЭ крови - 70% ингибирования при минимальной введенной дозе diPr-DClVP (0.3 мг/кг), не позволила рассчитать величины ED50. Исходя из имеющихся данных мы предположили, что значение ED50 (КЭ) должно быть менее 0.2 мг/кг (табл. 3). diPr-DClVP обладает высокой острой токсичностью (LD50 = 15 мг/кг, табл. 2), высокой ингибиторной активностью в отношении АХЭ и НТЭ (табл. 1) и высоким нейропатичным потенциалом (RIP = 3.5, табл. 2). Данное соединение ингибирует АХЭ крови при низких дозах: ED50 (AChE) = 4.0 ± 0.2 мг/кг, при этом в отношении НТЭ крови оно еще более активно: ED50 (NTE) = 2.0 ± 0.1 мг/кг. Отношение ED50(AChE)/ED50(NTE) = 2 согласуется с высоким значением RIP = 3.5 для diPr-DClVP (табл. 2) и указывает на высокую нейропатичную опасность этого токсичного соединения. При отравлении данным соединении ОНТФОС может развиться после успешного лечения острой холинергической токсичности. diPr-DClVP ингибирует БХЭ и особенно КЭ при более низких дозах, чем НТЭ и АХЭ (рис. 4). Таким образом, в случае воздействия diPr-DClVP БХЭ и КЭ крови являются более чувствительными биомаркерами, чем АХЭ и НТЭ. В данном случае БХЭ и КЭ являются биомаркерами как острой, так и отставленной нейротоксичности.
Величины ED50, рассчитанные из полученных дозозависимостей, характеризуют чувствительность эстераз крови как биомаркеров воздействия для каждого соединения (табл. 3).
Анализ результатов, представленных в таблице 3, показывает, что эстеразы-скэвенджеры БХЭ и КЭ, характеризующиеся более низкими величинами ED50, являются более чувствительными биомаркерами, чем АХЭ и НТЭ крови, и поэтому они могут детектировать воздействие более низких доз ФОС токсикантов. Этот вывод согласуется с литературными данными [1,2,40]. Оценка снижения активности БХЭ и КЭ позволяет выявить воздействие более низких доз ФОС токсикантов и получить информацию о самом факте воздействия [1]. При этом БХЭ и КЭ могут быть чувствительными к воздействию агентов, вызывающих как острую, так и отставленную нейротоксичность, поэтому степень их ингибирования может служить общим биомаркером воздействия ФОС. Одновременное определение активности АХЭ и НТЭ в крови позволяет дифференцировать воздействие острых и отставленных нейротоксикантов. Соотношение между ингибированием НТЭ и АХЭ, измеренное в крови, характеризует вероятность развития ОНТФОС по сравнению с острой холинергической токсичностью. Как показывают результаты исследования, ингибирование всех эстераз крови имеет дозозависимый характер, поэтому степень ингибирования эстераз крови позволяет оценить уровень воздействия, то есть провести дозиметрию воздействия, которая дает ценную информацию для терапии отравления. Таким образом, проведенное исследование с использованием ФОС, обладающих широким спектром собственной ингибиторной активности в отношении анализируемых эстераз и широким интервалом острой и отставленной нейротоксичности, показывает, что эстеразный статус, объединяющий как биомаркеры воздействия ФОС, так и биомаркеры чувствительности организма к этим соединениям, можно рассматривать в качестве комплексного биомаркера воздействия ФОС. Следует отметить, что оценка эстеразного статуса организма может быть полезным инструментом при реализации целого ряда задач, в частности при ликвидации последствий химических катастроф и химических террористических актов для уточнения диагноза отравления, прогноза развития интоксикации и оптимизации лечения; для биомониторинга лиц, связанных с производством и применением фосфорорганических и карбаматных пестицидов и оценки риска развития у них интоксикаций на основе данных по анализу активности набора эстераз и их генотипированию; для биомониторинга пациентов при лечении антихолинэстеразными препаратами, в частности, при терапии БА и миастении Гравис, а также для решения задач, не связанных с воздействием ингибиторов холинэстераз: в терапии заболеваний сердечно-сосудистой системы, в анестезиологии, в фундаментальных исследованиях молекулярного полиморфизма человека, в фундаментальных и прикладных исследованиях по созданию персонифицированной медицины. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Программы НАТО «Наука во имя мира и безопасности» (грант № SfP 984082) и Государственного задания 2018 года (тема № 0090-2017-0019). Авторы выражают благодарность сотрудникам лаборатории молекулярной токсикологии ИФАВ РАН О.Г. Серебряковой и Т.Г. Галенко за помощь в проведении токсикологических экспериментов и работу с животными. ЛИТЕРАТУРА
|