|
ПОДБОР СУБСТРАТА ДЛЯ ЩЕЛОЧНОЙ ФОСФАТАЗЫ НА ОСНОВЕ ФЕРМЕНТАТИВНОЙ КИНЕТИКИ И ЭЛЕКТРОХИМИЧЕСКИХ ХАРАКТЕРИСТИК ПЕЧАТНЫХ УГЛЕРОДНЫХ ЭЛЕКТРОДОВ ДЛЯ ПРИМЕНЕНИЯ В ИММУНОФЕРМЕНТНЫХ БИОСЕНСОРАХ 1Юниверс Диагностикс, 121205, Москва, Большой Бульвар, д. 42, стр. 1 2Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, 119121, Москва, ул. Погодинская, д. 10; *e-mail: agafonovaluba@mail.ru Ключевые слова: иммуносенсоры; электрохимический иммуноферментный анализ; субстраты щелочной фосфатазы; электрохимическая предобработка DOI: 10.18097/BMCRM00281 ВВЕДЕНИЕ Электрохимические иммуносенсоры представляют собой перспективный инструмент для детекции биомаркеров вследствие ряда преимуществ, таких как высокая чувствительность, быстрый анализ, относительная дешевизна и пригодность для миниатюризации датчиков и анализатора. Принцип электрохимических иммуносенсоров заключается в регистрации специфических комплексов, образующихся при взаимодействии антиген-антитело. Иммуноанализ маркеров заболеваний можно условно разделить на свободный от метки или опосредованный ферментативной или иной меткой анализ [1]. Алгоритмы проведения таких анализов [2] включают как прямую регистрацию антигена, связавшегося с антителом [3, 4], так и опосредованные методы анализа, основанные на регистрации сигнала, возникающего в результате действия метки, присоединённой к компонентам реакции [5], либо с использованием меченых антител [6]. Иммуноанализ является важнейшим компонентом современной диагностики сердечно-сосудистых заболеваний (ССЗ). В контексте ССЗ особую клиническую значимость имеет детекция в крови миоглобина, тропонина I и тропонина T, которые служат надёжными индикаторами повреждения миокарда и используются для постановки диагноза острого коронарного синдрома и инфаркта миокарда [7]. Научные исследования в данной области сосредоточены на улучшении ключевых характеристик сенсоров (чувствительности, селективности, стабильности и воспроизводимости) за счёт использования наноматериалов (наночастицы золота, углеродные нанотрубки, графен, допированный графен), новых биорецепторов (аптамеры, молекулярно-импринтированные полимеры как синтетические аналоги антител) и многофункциональных сенсорных платформ. Активно исследуются стратегии мультиплексного анализа для одновременного определения нескольких маркеров в одном образце, что особенно актуально для комплексной оценки состояния сердечно-сосудистой системы [8]. Ранее в наших работах был разработан электрохимический биосенсор для анализа кардиомаркеров миоглобина, тропонина I и тропонина Т в плазме крови больных острым инфарктом миокарда (ОИМ) [4, 9]. Для селективного определения кардиоизоформы миоглобина, высвобождающегося в кровь при повреждении сердечной мышцы, использовали антитела к кардиомиоглобину. Миоглобин является гемопротеином, его можно зарегистрировать прямым анализом при электрохимическом восстановлении при потенциале -0.27 В (отн. Ag/AgCl). Аналитическим сигналом служила величина регистрируемого тока переноса электрона с иона железа гема на поверхность графитового электрода, модифицированного наночастицами золота, стабилизированными мембраноподобным жидкокристаллическим поверхностно-активным веществом дидецилдиметиламмоний бромидом (ДДАБ) и антителами к миоглобину. Разработанный биосенсор обладал специфичностью, высокой стабильностью и низким пределом обнаружения миоглобина – 0.25 нМ (4.4 нг/мл), широким рабочим диапазоном определяемых концентраций, достигающим 0.1 мкМ (1750 нг/мл) и покрывающим клинический диапазон концентраций [4, 5, 9–15]. Электроанализ в таком формате не требует использования вторичных меченых антител. Сложностью при регистрации белков-маркеров тропонинов с помощью иммуносенсоров при их взаимодействии с антителами является электрохимическая активность и белков, и антител за счет электроактивности аминокислотных остатков, входящих в их состав [16–20]. Нами был разработан метод электрохимического определения белков-маркёров ОИМ в плазме крови здоровых доноров и больных острым инфарктом миокарда с помощью регистрации сигнала наночастиц металлов методом инверсионной и квадратно-волновой вольтамперометрии [12–14]. Аналитическим сигналом служила высота катодного (восстановительного) пика оксида золота, или анодного (окислительного) пика наночастиц серебра, которую рассчитывали по полученной вольтамперометрической кривой (∆I = Iсигнал – Iфон). В качестве метки для антител используются также ферменты, гидролизующие субстраты с образованием электроактивных или флуорогенных продуктов. Наиболее широко используемые ферменты - щелочная фосфатаза, пероксидаза, глюкозооксидаза, β-галактозидаза, а также глюкозо-6-фосфат дегидрогеназа, уреаза, лакказа, каталаза [6]. Использование антител с меткой позволяет проводить анализ в формате «антиген на электроде–антитело с меткой». Такой анализ обеспечивает высокую специфичность и воспроизводимость [1, 21]. Среди ферментных меток особое место занимает щелочная фосфатаза (ЩФ), применяемая в электрохимических иммуносенсорах с 1980-х годов [22]. Субстратами ЩФ служат различные по структуре моноэфиры ортофосфорной кислоты, образующие при гидролизе соответствующие спирты. Выбор субстрата представляет собой одну из основных задач при разработке электрохимических иммуносенсоров. Образующийся спирт может быть зарегистрирован электрохимическими методами. Однако часто образующийся продукт (спирт) адсорбируется на поверхности электрода, что приводит к его загрязнению и снижению чувствительности; спирт может быть нестабильным, что снижает операционную продолжительность работы сенсора. В связи с этим при разработке иммуносенсоров необходимы дополнительные исследования как фермента-метки, так и его субстратного спектра для получения оптимальных параметров иммуноанализа [21]. Прокальцитонин (ПКТ) является идентификатором тяжелых бактериальных инфекций, а также вируса COVID-19. Нормальный уровень ПКТ в крови составляет менее 0.01 нг/мл. На данный момент предложено большое количество академических исследований и разработок по определению ПКТ как в формате с использованием метки, так и в безметочной форме [23]. При определении ПКТ описано использование фермента пероксидазы хрена [23]. Субстратом в такой системе выступает пероксид водорода, который достаточно сложно определяется электрохимическими методами анализа с использованием печатных графитовых электродов из-за замедленной кинетики гетерогенного переноса электрона на поверхности ПГЭ. Поэтому часто предобработка ПГЭ является неотъемлемой стадией при разработке иммуносенсоров [24]. В связи с этим наиболее перспективно использование в качестве метки фермента щелочной фосфатазы, имеющей широкую субстратную специфичность [25]. Цель настоящего исследования - подбор субстрата для щелочной фосфатазы в рамках экспериментального исследования по разработке иммуносенсора на прокальцитонин. В связи с поставленной целью сформулированы следующие задачи: - провести электроанализ субстратов ЩФ (п-нитрофенилфосфат (pNPP), фосфат аскорбиновой кислоты (AA2P), п-аминофенилфосфат (pAPP) и 1-нафтилфосфат (1-NPP)); - исследовать ферментативную кинетику в отношении оптимального субстрата ЩФ; - охарактеризовать поверхность ПГЭ электрохимическими методами для обоснованного выбора способа предобработки электродной поверхности; - провести электрохимический иммуноферментный анализ с выбранным субстратом и обработкой поверхности ПГЭ в формате «сэндвич» анализа на прокальцитонин. МАТЕРИАЛЫ И МЕТОДЫ Материалы Электрохимические измерения проводили с использованием потенциостата EmStat4s («PalmSens B.V.», Нидерланды) с программным обеспечением PSTrace (версия 5.11). В работе использовали печатные графитовые электроды (ПГЭ) – трехэлектродные системы, изготовленные послойно методом трафаретной̆ печати. Рабочий и вспомогательный электроды формировали из углеродной пасты («Sun Chemical», США), электрод сравнения — из хлоридсеребряной пасты («Дельта-пасты», Россия). Диаметр рабочего электрода составлял 1.8 мм (геометрическая площадь поверхности 2.54 мм2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (отн. Ag/AgCl). Для исследования ферментативной кинетики в работе были использованы следующие реактивы: 1-нафтилфосфат, мононатриевая соль моногидрат (1-NPP) («TCI», Япония), тринатриевая соль 2-фосфо-L-аскорбиновой кислоты (AA2P) («Solarbio», Китай), п-нитрофенилфосфат динатриевая соль гексагидрат (pNPP) («SRL», Индия), 4-аминофенил фосфат мононатриевая соль гидрат (pAPP) («Biosynth», Великобритания), 1-нафтол («ЛенРеактив», Россия), рекомбинантная щелочная фосфатаза (рЩФ) в 20 мМ фосфатном буфере pH 7.4 с заявленной активностью >7100 Ед/мг («Raymebio», Китай). В качестве раствора-электролита для проведения реакций субстрата с ЩФ использовали 50 мМ диэтаноламиновый буфер pH 9.5 (далее обозначается DEA), состоящий из 50 мМ диэтаноламина («SRL», Индия), 5 мМ хлорид магния («Реахим», Россия), 100 мМ хлорида калия («Реахим»). В работе использовали раствор, содержащий эквимолярное количество 1 мM гексационоферрата(II) калия и 1 мM гексацианоферрат(III) калия («Универхимик», Россия) в качестве редокс-зонда и 10 мМ фосфатный буферный раствор, рН 7.5 (PBS) для электрохимических экспериментов. При проведении иммуноферментного анализа (ИФА) с электрохимической детекцией использовали: в качестве захватывающих антител (Ab1) – моноклональные антитела (АТ) к ПКТ («Auker Biotech», Китай), в качестве детектирующих антител – поликлональные АТ к ПКТ («Hytest», Россия), меченные ЩФ «Raymebio» (Ab2–ЩФ), прокальцитонин («Hytest») (ПКТ). Следующие реагенты использовали для приготовления растворов: Tween-20 («Русхим», Россия), бычий сывороточный альбумин (BSA) («Helicon», Россия). В качестве твёрдого «носителя» для Ab1 использовали магнитные наночастицы с тозил-активированной поверхностью (Mag-Tosyl) («Bioeast», Китай). Реакцию связывания проводили в иммунологических планшетах medisopr («Sovtech», Россия). Все используемые реагенты имели квалификацию не ниже х.ч. Все растворы и электролиты приготовлены на основе деионизированной воды (Milli-Q). Методы Предобработку электрода проводили в 10 мМ PBS методом хроноамперометрии (ХА) в течение 10 мин при потенциале 1.6 В. Построение кривых, отвечающих ферментативной кинетике Михаэлиса-Ментен, проводили на основе экспериментов с инкубированием 2 нМ рЩФ с известной концентрацией субстрата в течение 20 мин при комнатной температуре (~25°C) в буфере DEA. Концентрацию субстрата повышали до достижения плато. Для каждой регистрируемой концентрации использовали новый электрод, измерения воспроизводили дважды. После инкубации регистрировали токи в режиме дифференциально-импульсной вольтамперометрии (ДИВА) при скорости сканирования 20 мВ/с в буфере DEA. Расчет активности рЩФ относительно выбранного субстрата проводили после 20- минутной инкубации 1 мМ 1-нафтилфосфата с различным количеством фермента в буфере DEA. После инкубации регистрировали токи в режиме ДИВА в диапазоне потенциалов от -0.3 В до 0.4 В при скорости сканирования 20 мВ/с и хроноамперометрии (ХА) при потенциале 0.15 В в течение 60 с. Для оценки количества продукта, образуемого во время каталитической реакции субстрата с ферментом, строили калибровочные зависимости окисления известной концентрации 1–нафтола на электродах, предобработанных в 10 мМ PBS, как описано выше. Активность рЩФ сопоставляли с концентрацией образовавшегося продукта. Для анализа, расчета скорости ферментативной реакции и констант Михаэлиса применяли программное обеспечение Origin 2021 («Origin Lab», США). Для характеристики поверхности ПГЭ применяли циклическую вольтамперометрию (ЦВА), измерения проводили в диапазоне потенциалов от -0.5 В до 0.5 В в растворе, содержащем ионы переменной валентности [Fe(CN)6]4-/3-, при различных скоростях сканирования потенциала (от 400 мВ/с до 10 мВ/с); спектроскопию импеданса (EIS) измеряли при потенциале половины окислительного пика, который был установлен по ЦВА, амплитуда (Eac) составляла 10 мВ, диапазон частот составил от 50000 Гц до 0.1 Гц. Предобработку в 10 мМ PBS проводили как описано выше. Предобработку серной кислотой осуществляли в 0.2 М растворе серной кислоты в режиме ЦВА (1 цикл) в диапазоне потенциалов от -1.2 В до 1.5 В при скорости сканирования 100 мВ/с. Проведение ИФА включало классические стадии «сэндвич» анализа: 30-минутная инкубация Ab1 – ПКТ (Ab1 500 нг/лунку) при 37°С в термошейкере («Elmi», Латвия); промывка с помощью магнитной сепарации раствором 1х PBST; 30-минутная инкубация Ab1 – ПКТ c Ab2 – ЩФ (концентрированный раствор Ab2 5.7 мг/мл разбавляли в 500 раз) при 37°С в термошейкере; промывка с помощью магнитной сепарации раствором 1хPBST (10 мМ PBS + 0.05% Tween-20); 20- минутная инкубация с раствором субстрата (1 мМ) при комнатной температуре. После последнего шага применяли магнитную сепарацию частиц, отбирали продукт ферментативной реакции с помощью дозатора (80 мкл), наносили пробу на ПГЭ и проводили измерение в режиме ДИВА. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методика выбора субстрата для рЩФ
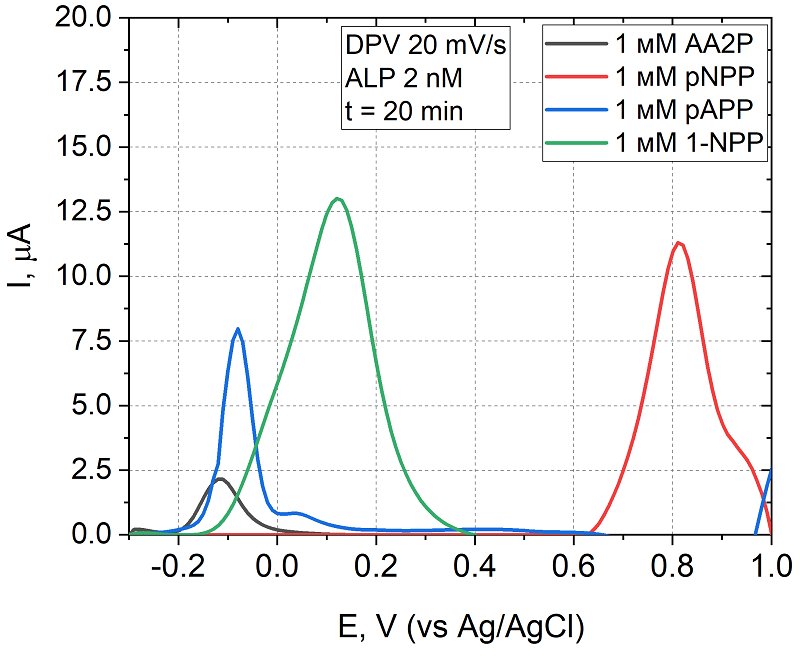
Щелочная фосфатаза – фермент класса гидролаз, катализирующий отщепление фосфатной группы от различных молекул. Результатом взаимодействия рЩФ с ее субстратом является электроактивный продукт, способный к прямому окислению на электроде [6]. Для исследования ферментативной кинетики и получения электрохимических характеристик окисления продуктов использовали ПГЭ, обработанные в PBS. В качестве субстратов были проанализированы п-нитрофенилфосфат (pNPP), фосфат аскорбиновой кислоты (AA2P), п-аминофенилфосфат (pAPP) и 1-нафтилфосфат (1-NPP) [2, 26]. В результате ферментативной реакции, катализируемой ЩФ, образуются нитрофенол, аскорбиновая кислота, аминофенол и нафтол соответственно. Появление пика окисления продукта после 20-ти минутной инкубации фермента и субстрата зарегистрировано с помощью ДИВА и представлено на рисунке 1. Наиболее положительным потенциалом окисления обладает п-нитрофенол – продукт ферментативной реакции субстрата п-нитрофенилфосфата (p-NPP), пик которого регистрируется при потенциале 0.85 В. При построении графиков фоновый ток был вычтен. Экспериментально установлено, что ни субстрат, ни фермент не окисляются на электроде в исследуемом диапазоне потенциалов.
На основе данных, полученных с помощью ДИВА, была построена зависимость в координатах i([S]), где i – ток пика окисления продукта. Зависимость тока окисления продукта от начальной концентрации субстрата была аппроксимирована регрессией Михаэлиса-Ментен [27-29] в соответствии с уравнением (1).
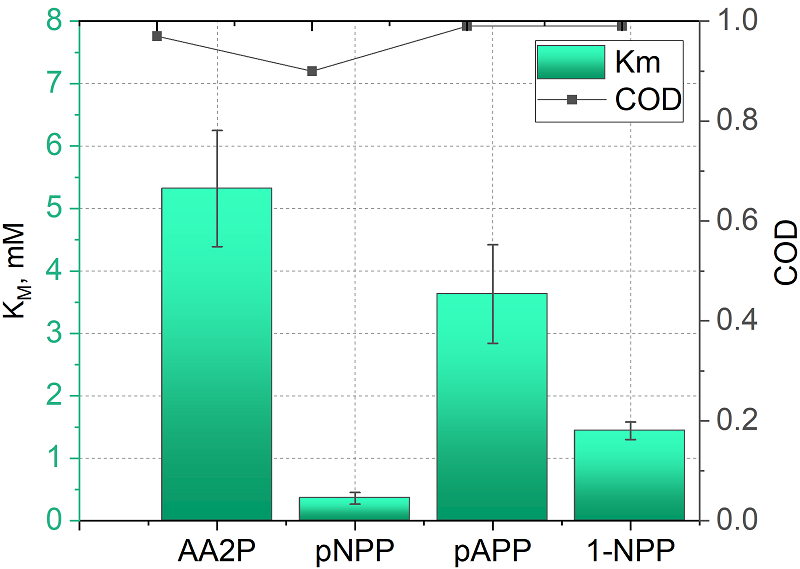
Характеристики субстратов при аппроксимации данных уравнением 1 представлены на рисунке 2. Таким образом, наибольшим значением кажущейся Km обладает субстрат 2-фосфо-L-аскорбиновая кислота (AA2P), что в рамках теории соответствует наихудшему связыванию субстрата с ферментом ЩФ. Коэффициент детерминации (COD, R2) во всех случаях составил не менее 0.9.
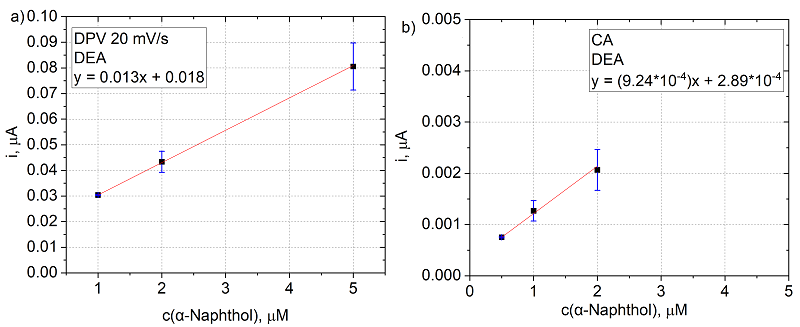
На основании анализа кинетических характеристик (рис. 2), учитывая коэффициент детерминации (R2) и потенциал электроокисления продуктов ферментативной реакции рЩФ с субстратами, был сделан выбор в пользу субстрата 1-нафтилфосфата (1-NPP), продукт ферментативной реакции которого – нафтол – окисляется при потенциале 0.15 В (отн. Ag/AgCl) и имеет наименьшее значение Km среди продуктов, окисляющихся при сравнительно низких потенциалах. Исследование ферментативной активности в отношении выбранного субстрата Калибровочные зависимости тока от концентрации продукта ферментативной реакции 1–нафтола строили из данных, полученных: 1) в режиме ДИВА при потенциале 0.15 В и 2) в режиме ХА при потенциале 0.15 В (60 с). В таблице 1 приведены параметры полученных зависимостей, аппроксимированные линейной регрессией, выражающейся в общем уравнении: i(мкА) = k(мкА/мМ) × [NAP](мМ) ± b(мкА). Предел обнаружения (LOD, limit of detection) рассчитывали по уравнению 3×SD/k; в качестве фонового тока выступал ток, зарегистрированный в DEA буфере [30].
Из полученных данных следует, что показатель чувствительности (k) значительно выше при регистрации токов в режиме ДИВА. Однако ХА режим обеспечивает меньший предел обнаружения продукта благодаря снижению шумов при длительной стабилизации тока. Таким образом, выбор метода детекции определяется целевыми параметрами разрабатываемого датчика. Величины токов, полученные после инкубации рЩФ с субстратом 1-нафтил фосфатом (1-NPP) в течение 20 мин, подставляли в уравнение линейной зависимости тока от концентрации 1–нафтола и находили концентрацию продукта, синтезированного во время ферментной реакции. Рост активности фермента с увеличением его концентрации в системе демонстрирует применимость 1-NPP в иммуносенсорах, где сигнал пропорционален содержанию биомаркера (табл. 2). Для сравнения в таблице 2 приведены данные для активности фермента с фосфатом аскорбиновой кислоты (AA2P) в качестве субстрата. Из таблицы 2 видно, что активность рЩФ с 1-NPP в качестве субстрата в 4–6 раз превышает активность фермента с AA2P, что коррелирует с более низкой величиной Km для 1-NPP (рис. 2) и подтверждает его преимущество в анализах, требующих высокой скорости гидролиза.
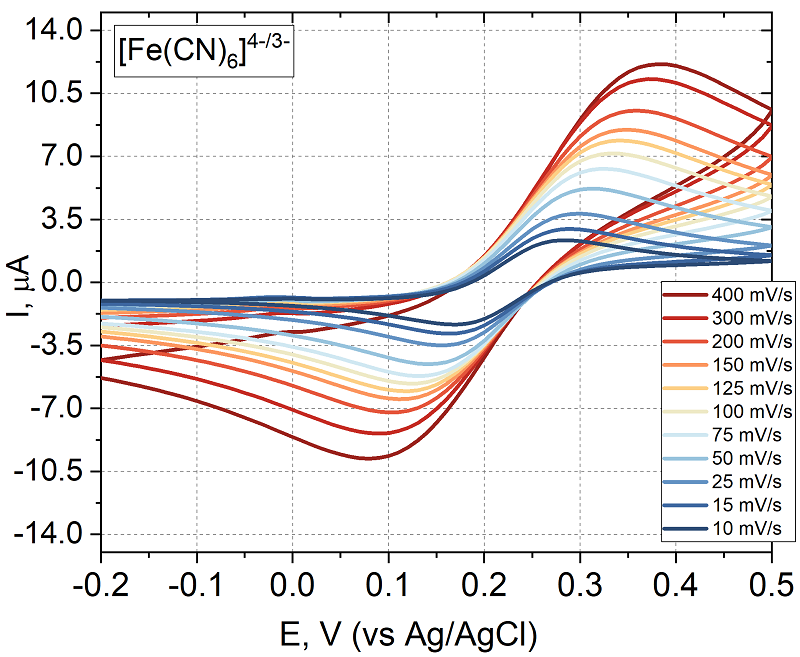
Таким образом, 1-NPP является оптимальным субстратом для электрохимического определения активности рЩФ благодаря высокой скорости ферментативной реакции и низкому потенциалу окисления нафтола. Полученные данные подтверждают возможность интеграции 1-NPP в формат иммуносенсоров для лабораторной диагностики. Достижение более низкого предела обнаружения продукта ферментативной реакции за счет простой предобработки электрода Экспериментальный анализ условий пробоподготовки стабильных электродов с хорошими электроаналитическими характеристиками. Параметры электрохимической реакции. В предыдущем разделе был подобран оптимальный для ЩФ на основе электрохимических характеристик, полученных при электроокислении продукта ферментативной реакции на электроде. При разработке электрохимического ферментного иммуносенсора важным этапом является не только подбор оптимального субстрата для фермента, но и достижение оптимальных характеристик поверхности электрода для оптимизации отклика при окислении продукта. Для подбора субстрата использовали обработку ПГЭ в PBS в течение 10 мин. Чтобы добиться лучшего отклика относительно 1-нафтола (продукта ферментативной реакции 1-нафтил фосфата, 1-NPP) и снижения предела обнаружения применили обработку электрода серной кислотой. Для сравнения влияния различных предобработок использовали методы ДИВА и ХА [31]. В электрохимии оценка константы скорости переноса электронов k0 представляет первостепенный интерес при изучении характеристик электродных материалов. Константа скорости даёт представление о скорости переноса электронов между электроактивным веществом и поверхностью электрода, и о том, определяет ли материал электрода общую скорость электрохимической реакции [32]. Самым широко используемым методом определения k0 является циклическая вольтамперометрия [19, 32]. На рисунке 3 приведена ЦВА для ПГЭ до обработки в эквимолярном растворе ферри/ферроцианида калия в качестве внешнего электролита при разных скоростях сканирования.
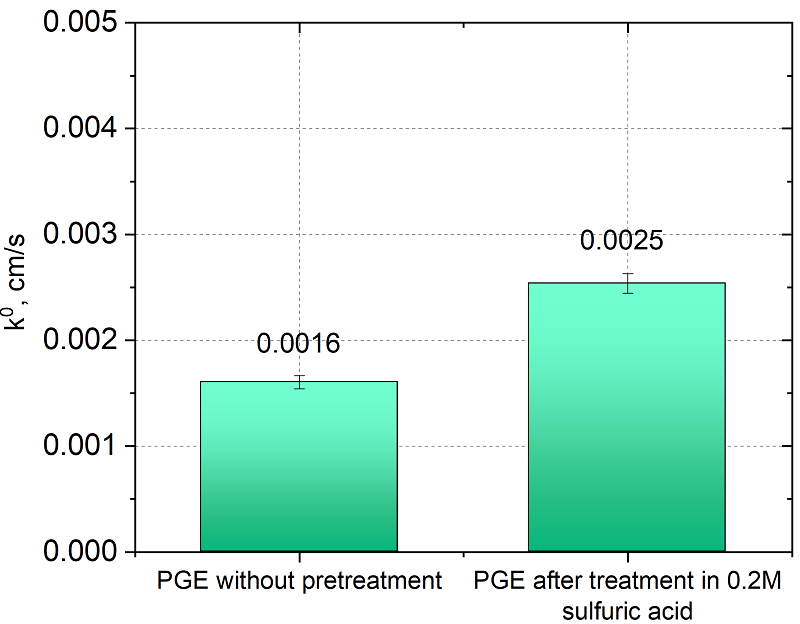
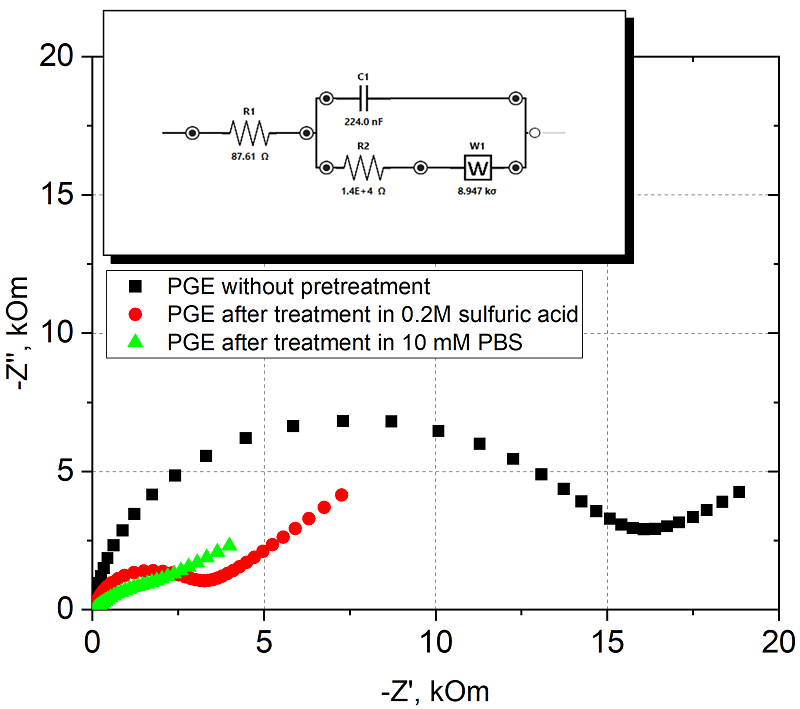
На рисунке 4 представлено сравнение констант гетерогенного переноса электрона для ПГЭ без предобработки и после обработки серной кислотой. Константа скорости переноса электрона после обработки серной кислотой увеличивается. При обработке в PBS реакция переставала иметь квазиобратимый характер и расстояние между пиками не изменялось с изменением скорости сканирования.
Площадь электроактивной поверхности электрода находили из данных ЦВА при разных скоростях развертки по уравнению Рейнольдса-Шевчика при 25°С [27]. На рисунке 5 представлено сравнение электроактивных площадей до и после обработки электродов в PBS и в серной кислоте.
Наибольший вклад в улучшение характеристик электрохимического процесса с участием редокс пары Fe(CN)64-/3- дает обработка фосфатным буферным раствором в режиме ХА. Поскольку данные ЦВА при разных скоростях развертки потенциала не дали возможности для расчета k0 по методу Никольсона для ПГЭ, обработанных в PBS, так как процесс стал преимущественно обратимым (разница между пиками от 10 до 400 мВ/с не менялась и составила 90.7 мВ), для вычисления константы гетерогенного переноса были использованы данные спектроскопии электрохимического импеданса (EIS). Из рисунка 6 видно снижение сопротивления переноса электрону при использовании предобработок в серной кислоте и PBS. На вставке представлена эквивалентная схема химической реакции для аппроксимации и расчета значений элементов, входящих в ее состав (схема соответствует классической цепи Рэндлса [32], ошибка при моделировании процесса химической реакции, аппроксимирующей схемой для элемента, отвечающего сопротивлению переноса электрона, не превышала 1.8 %).
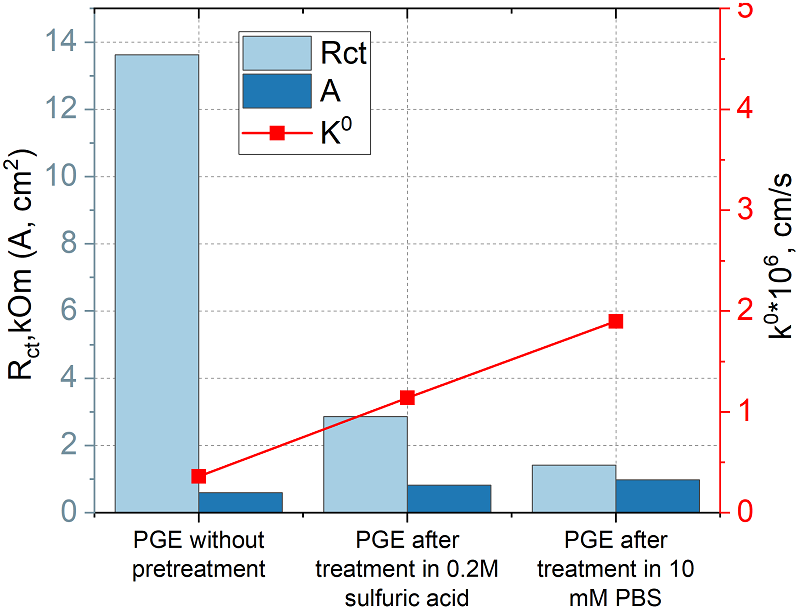
При расчете константы гетерогенного переноса использовали среднее значение электроактивной площади поверхности, полученной по данным ЦВА. На рисунке 7 представлено соотношение изменения основных электрохимических параметров при предварительной обработке электрода. Наблюдается закономерное снижение Rct и увеличение A и k0 при обработке в кислоте и PBS.
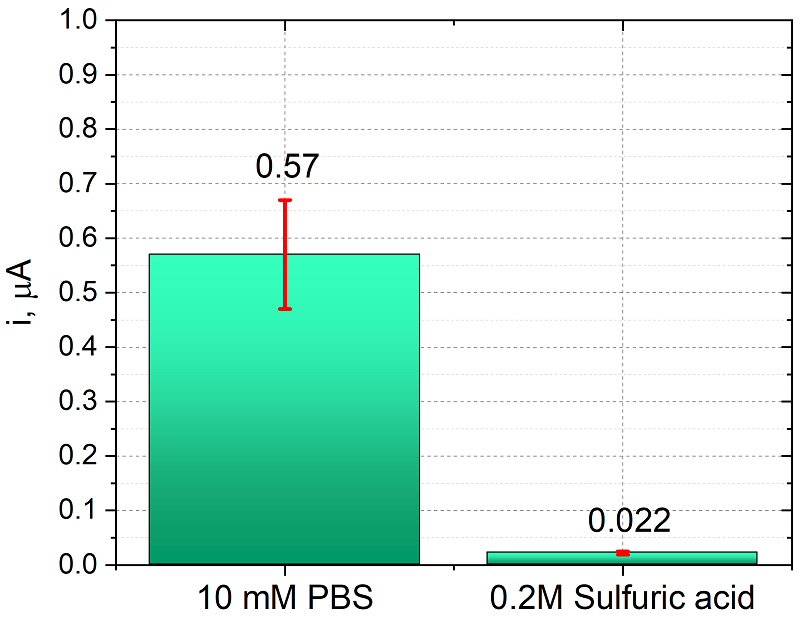
Обработка как кислотой, так и PBS значительно снижает сопротивление переносу электрона, за счет чего константа гетерогенного переноса возрастает в 10 раз по сравнению с исходной поверхностью. Сравнение предобработок ПГЭ при прямом окислении продукта ферментативной реакции (1-нафтола). На рисунке 8 приведены значения токов, регистрируемые в диэтаноламиновом электролите (фоновые токи DEA), на ПГЭ после различной предобработки. Из рисунка 8 видно, что обработка в серной кислоте значительно снижает фоновые токи (в 25 раз относительно обработки в PBS), также стандартное отклонение фоновых токов снижается с ±0.1 мкА до ±0.003 мкА.
За счет снижения фонового тока удалось добиться лучшего предела обнаружения относительно нафтола. Для ПГЭ, обработанных в серной кислоте, так же, как и для ПГЭ с предобработкой в PBS, были зарегистрированы токи прямого окисления нафтола на электроде в режимах ДИВА и ХА. На рисунке 9 представлены соответствующие концентрационные зависимости тока электроокисления нафтола.
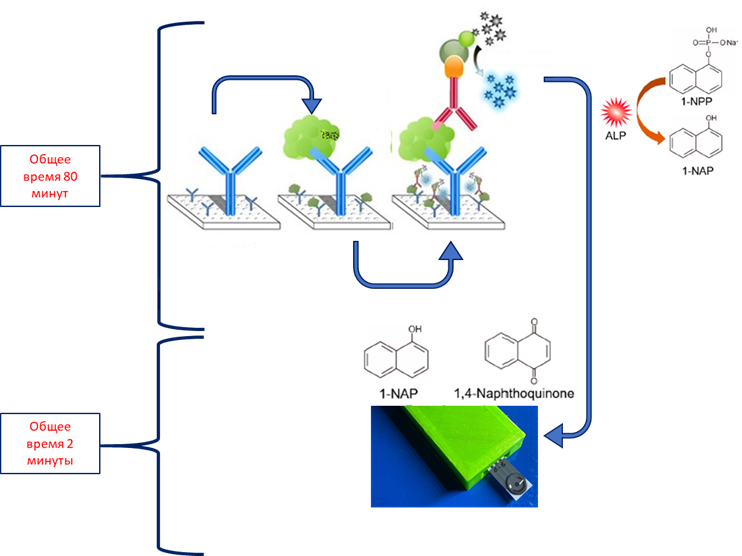
Таким образом, обработка ПГЭ электродов серной кислотой способствует снижению предела обнаружения (LOD) по 1–нафтолу с 68 мкМ до 0.73 мкМ в режиме ДИВА, и с 2.70 мкМ до 0.09 мкМ в режиме ХА относительно электродов, обработанных в 10 mM PBS. Электрохимический иммуноферментный анализ с оптимальным субстратом рЩФ и обработкой поверхности ПГЭ в формате «сэндвич» анализа на прокальцитонин. Для проведения ИФА с электрохимической детекцией были использованы захватывающие моноклональные антитела к прокальцитонину, сорбированные на магнитные наночастицы и детектирующие поликлональные антитела, меченные ЩФ. Иммунная реакция связывания антигена с антителом проходила в плашках вне зоны ПГЭ. Процесс занимал 80 мин и подробно описан в разделе «Методика». После проведения ферментативной реакции в присутствии субстрата (1-NPP), отбирали 80 мкл продукта ферментативной реакции (1-нафтола), наносили пробу на ПГЭ и проводили измерение в режиме ДИВА (рис. 10).
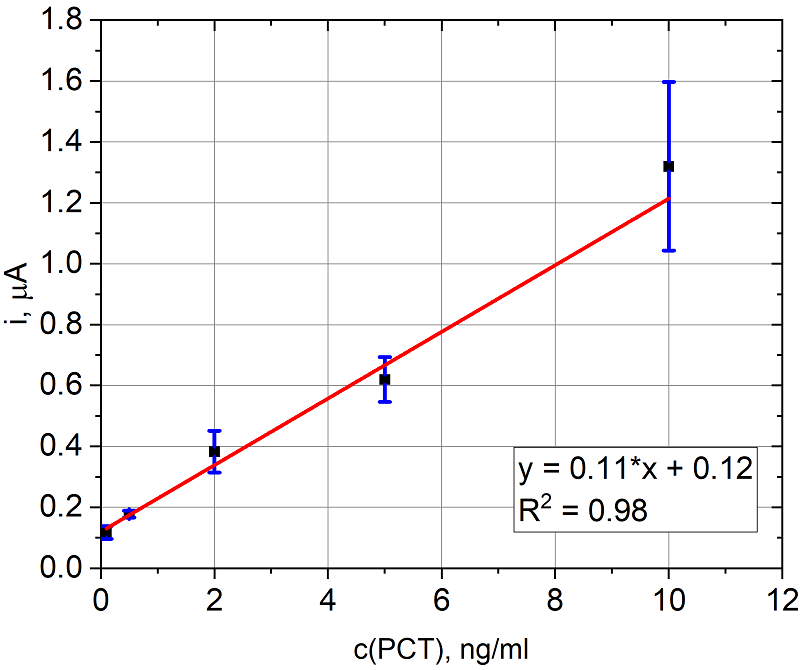
Разработанный иммуносенсор с электрохимической детекцией был опробован на образцах ПКТ. На рисунке 11 представлена зависимость тока от концентрации прокальцитонина (ПКТ) в модельных буферных растворах (PBS).
Предел обнаружения составил 0.8 пг/мл. Коэффициент чувствительности - 109 нА×мл/мг. ЗАКЛЮЧЕНИЕ Проведен электроанализ субстратов ЩФ (п-нитрофенилфосфат (pNPP), фосфат аскорбиновой кислоты (AA2P), п-аминофенилфосфат (pAPP) и 1-нафтилфосфат (1-NPP)). Исследована ферментативная кинетика в отношении лучшего субстрата ЩФ ― 1-NPP. Охарактеризована поверхность ПГЭ электрохимическими методами для обоснованного выбора способа предобработки электродной поверхности. С использованием предобработки ПГЭ в серной кислоте удалось добиться значительного снижения фонового тока и снизить предел обнаружения 1-нафтола, который является продуктом ферментативной реакции, катализируемой щелочной фосфатазой, с 68 мкМ до 0.73 мкМ в режиме дифференциально-импульсной вольтамперометрии и с 2.70 мкМ до 0.09 мкМ в режиме хроноамперометрии. Выбранные субстрат и предобработка применены в количественном иммуноферментном анализе для определения прокальцитонина в стандартных растворах. Коэффициент чувствительности и предел обнаружения составили 109 нА×мл/мг и 0.8 нг/мл соответственно. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период 2021–2030 годы (№ 122030100168-2). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|