|
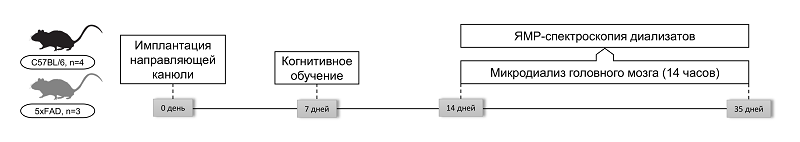
МЕТАБОЛИЧЕСКОЕ ПРОФИЛИРОВАНИЕ ИНТЕРСТИЦИАЛЬНОЙ ЖИДКОСТИ ГИППОКАМПА МЫШЕЙ ЛИНИИ 5XFAD ПОСЛЕ КОГНИТИВНОЙ НАГРУЗКИ: ПИЛОТНОЕ ИССЛЕДОВАНИЕ 1Российский центр неврологии и нейронаук, 125367, Москва, Волоколамское шоссе, 80; *e-mail: yuliakomleva@mail.ru Ключевые слова: болезнь Альцгеймера; гиппокамп; микродиализ; ЯМР-спектроскопия; метаболизм; кетоновые тела DOI: 10.18097/BMCRM00291 ВВЕДЕНИЕ Болезнь Альцгеймера (БА) является наиболее распространённой формой деменции и ведущей причиной возрастной когнитивной дисфункции во всём мире, охватывая до 70% всех случаев деменции [1]. Патологическое снижение когнитивных функций при БА развивается медленно, но прогрессирующе и необратимо, приводя к когнитивной дисфункции, нарушению памяти и поведенческим изменения. Несмотря на интенсивные исследования, патогенез заболевания остаётся не до конца изученным. По имеющимся данным, около 70% факторов риска БА связаны с генетическими и метаболическими нарушениями, включая ожирение, сахарный диабет и гипертонию [2, 3]. Современные представления о патофизиологии БА выходят за рамки традиционной амилоидной гипотезы и включают в себя нарушение энергетического метаболизма головного мозга, особенно в гиппокампе – структуре, которая критически вовлечена в процессы памяти и обучения [4]. На ранних доклинических стадиях заболевания наблюдаются митохондриальная дисфункция, снижение активности ферментов окислительного фосфорилирования, переключение на анаэробный гликолиз и активация глиальных клеток [5–9]. Снижение метаболизма глюкозы является одним из ранних и наиболее устойчивых биомаркеров БА, наблюдающимся задолго до клинической манифестации заболевания [10]. Гипометаболизм глюкозы нарушает работу как гликолиза, так и цикла трикарбоновых кислот, что приводит к снижению уровня пирувата и цитрата [10]. В условиях энергетического дефицита мозг активирует альтернативные пути метаболизма, включая использование кетоновых тел (ацетона, ацетоацетата, β-гидроксибутирата) для поддержания функции нейронов. Такая адаптация рассматривается как компенсаторный механизм, направленный на поддержание энергетического гомеостаза в условиях метаболического стресса [11–13]. Несмотря на наличие обширных данных о нарушении обмена глюкозы, например, вследствие развития инсулинорезистентности при БА, роль альтернативных энергетических субстратов (включая кетоны и короткоцепочечные жирные кислоты), а также их влияние на когнитивные функции, в основном изучали в клеточных и животных моделях или в рамках вмешательств, таких как кетогенная диета [14]. В клинических обсервационных исследованиях повышенный уровень пирувата в спинномозговой жидкости был зафиксирован у пациентов с БА и сосудистой деменцией [15, 16], тогда как снижение концентрации цитрата и сукцината в плазме ассоциировалось с ускоренным когнитивным снижением [17]. Предыдущие исследования на трансгенных моделях БА, включая мышей линии 5xFAD, продемонстрировали ранние нарушения в энергетическом метаболизме головного мозга задолго до появления когнитивных симптомов [18]. Однако большинство работ ограничивались анализом в состоянии покоя и не учитывали влияние когнитивной нагрузки, которая может дополнительно усиливать метаболические расстройства за счёт увеличенного спроса на энергию в нейронах и глии в активных регионах мозга [19]. Когнитивная стимуляция, особенно при обучении в парадигме условно-пассивного избегания, активно задействует гиппокампальные сети и сопровождается усилением гликолиза, увеличением потребления глюкозы и лактата, а также активацией астроцитов и развитием окислительного стресса [20]. Ранее мы показали, что у мышей линии 5xFAD с генетической моделью БА к 28 суткам после когнитивной нагрузки происходит манифестация неврологического дефицита и нарушений нейрогенеза и ангиогенеза в гиппокампе [21]. Поэтому важно оценить, как меняется метаболическая пластичность гиппокампа в ответ на когнитивную нагрузку у животных с моделью БА. В настоящем исследовании с использованием методов in vivo микродиализа и ЯМР-спектроскопии были охарактеризованы изменения в метаболическом профиле интерстициальной жидкости гиппокампа у трансгенных мышей 5xFAD и животных дикого типа на 7 и 28 сутки после когнитивного обучения. МЕТОДИКА Животные В исследовании использовали самцов мышей дикого типа C57BL/6, полученных из Питомника «Столбовая» Научного центра биомедицинских технологий (Россия) (контроль, n=4), и трансгенных мышей линии B6SLJ-Tg(APPSwFlLon,PSEN1M146LL286V)6799Vas, полученных из Федерального исследовательского центра проблем химической физики и медицинской химии РАН (Россия) (5xFAD, n=3), представляющих модель болезни Альцгеймера. Возраст животных на момент начала эксперимента составлял 6 месяцев. Всех животные содержали в стандартных условиях вивария при 12-часовом цикле свет/темнота, с неограниченным доступом к корму и воде. Когнитивное обучение Для индукции когнитивной нагрузки использовали парадигму условно-пассивного избегания (passive avoidance task) с использованием специализированной установки («Panlab Harvard Apparatus», Испания), состоящей из светлой и тёмной камер, разделённых гильотинной дверью. В первый день животные проходили сессию привыкания, в ходе которой их помещали в светлую камеру с открытой дверью, и животные могли свободно перемещаться между камерами. Животных, не вошедших в тёмную камеру в течение 180 с, исключали из дальнейшего эксперимента. На следующий день проводили обучающую сессию: при входе животного в тёмную камеру дверь автоматически закрывалась, и через решетчатый пол подавался слабый электрический разряд (0.2 мА, 50 Гц, 3 с). После воздействия животных возвращали в индивидуальные клетки. Данная модель используется для оценки индуцированной когнитивной пластичности и активации гиппокампальных нейросетей [22]. Микродиализ головного мозга Для сбора интерстициальной жидкости гиппокампа in vivo использовали методику микродиализа у свободноподвижных животных на 7 сутки и 28 сутки после когнитивного обучения. За 7 суток до когнитивного обучения, в область СА1 гиппокампа (координаты по Paxinos and Franklin, AP: -2.0 мм, ML: -1.8 мм, DV: -1.3 мм) под анестезией имплантировали направляющие канюли. В день сбора интерстициальной жидкости в направляющие конюли вводили микродиализные зонды CMA7 с длиной активной мембраны 1 мм и молекулярным отсечением 55 кДа («CMA Microdialysis AB», Швеция). Микродиализ осуществляли в течение 14 ч. Аликвоты хранили при -80°С до проведения ЯМР-спектроскопического анализа. Общая схема эксперимента, с детализацией по временным точкам проведения основных манипуляций, представлена на рисунке 1. ЯМР-спектроскопия Метаболомный анализ образцов проводили с использованием протонной ЯМР-спектроскопии высокого разрешения. 30 мкл образца интерстициальной жидкости смешивали с 200 мкл метанола. Далее образец центрифугировали 5 мин 12000 g, и супернатант концентрировали в токе азота. Далее для пробоподготовки к исследуемому образцу добавляли 500 мкл дейтерированного фосфатного буфера (150 мМ, pH 7.05), содержащего азид натрия (2 мМ) в качестве антибактериального консерванта и натриевой соли дейтерированной триметилсилилпропансульфоновой кислоты (DSS-d6) (0.1 мМ) в качестве внутреннего стандарта. После встряхивания и центрифугирования (5 мин, 12000 g, комнатная температура) образцы помещали в стандартные ЯМР-пробирки диаметром 5 мм. Спектры регистрировали на спектрометре ЯМР AVANCE Neo 700 МГц («Bruker BioSpin», Германия) с использованием криодатчика Prodigy (Институт фармации и биотехнологии, РУДН, Россия) при температуре 25°C с использованием импульсной последовательности noesypr1d (точек данных - 131072, количество пустых сканирований - 4, количество сканирований - 800, ширина спектра - 19.84 м.д., время сбора данных — 4.7 с, релаксационная задержка — 3.0 с). Обработку спектров и количественное определение концентраций метаболитов проводили с помощью программного обеспечения Chenomx NMR Suite v 9.0 («Chenomx Inc.», Канада). В результате для каждого метаболита были установлены концентрации (мМ), отражающие его содержание в интерстициальной жидкости каждого животного за 14-часовой период сбора проб. Статистический анализ Данные представлены как среднее ± стандартная ошибка среднего (M ± SEM). Статистическую обработку проводили методом двухфакторного дисперсионного анализа (two-way ANOVA) с поправкой Сидака на множественные сравнения (GraphPad Prism 8.0). В качестве факторов рассматривались генотип (C57BL/6 против 5xFAD) и время (7 и 28 сутки). Уровень значимости устанавливали как p < 0.05.
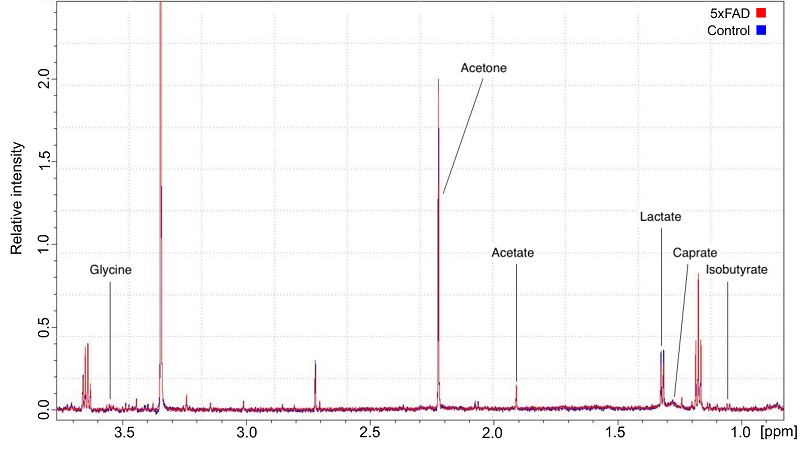
РЕЗУЛЬТАТЫ Посредством ЯМР-спектроскопии количественно были определены профили концентраций метаболитов, включая глицин, ацетон, ацетат, лактат, капрат и изобутират, в интерстициальной жидкости гиппокампа мышей линий C57BL/6 и 5xFAD на 7 и 28 сутки после когнитивного обучения (рис. 2).
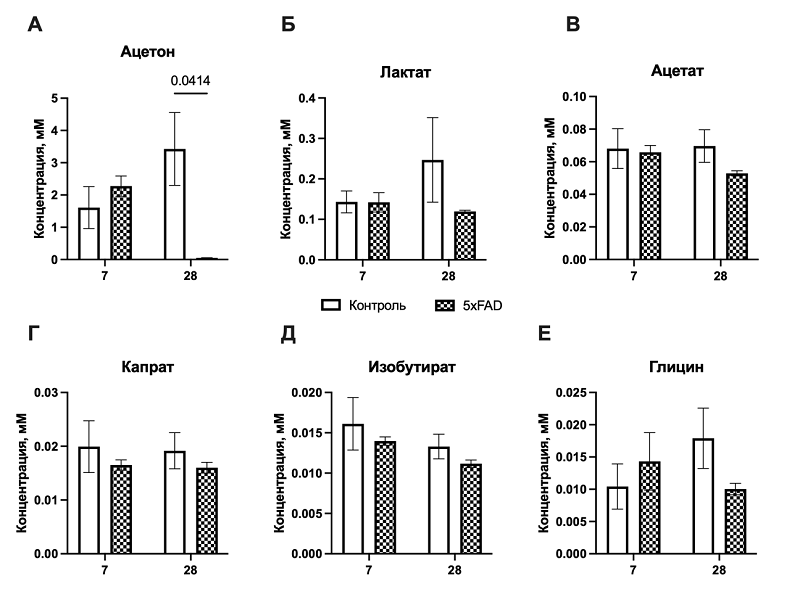
Общая оценка концентраций найденных метаболитов показала, что уровни ацетона и лактата в обеих исследуемых группах существенно превышали концентрации других детектируемых соединений (рис.3). Сравнительный анализ динамики концентрации метаболитов у мышей различных генетических групп в отдаленные сроки после когнитивного обучения выявил статистически значимые изменения уровня ацетона — ключевого маркера содержания кетоновых тел и метаболической пластичности мозга. [23]. Было обнаружено значимое взаимодействие факторов «генотип» × «время» (p = 0,0301). Действительно, на 28 сутки после обучения уровень ацетона у мышей линии 5xFAD был достоверно ниже, чем в контрольной группе (p = 0.0414, рис. 3А), тогда как на 7-е сутки межгрупповые различия отсутствовали (p = 0.7675). Полученные данные согласуются с нашими предыдущими результатами, демонстрирующими нарушение формирования навыка условно-пассивного избегания у мышей 5xFAD на 28 сутки после обучения [21]. Таким образом, можно предположить ограниченную способность трансгенных животных поддерживать кетоновый метаболизм в отсроченном постнагрузочном периоде, что потенциально может влиять на формирование данного навыка в условиях БА-ассоциированного метаболического стресса. Схожее снижение концентрации на 28-е сутки наблюдалось для лактата и ацетата (рис. 3Б, В), которые, как и ацетон, могут являться альтернативными источниками энергии для нейронов и астроцитов в условиях БА-ассоциированного метаболического стресса [13]. Однако эти изменения не достигли статистической достоверности. В совокупности полученные результаты обосновывают перспективность дальнейших исследований, направленных на изучение роли альтернативных энергетических субстратов в механизмах метаболической пластичности мозга при нейродегенерации, в частности их вклада в энергетическое обеспечение синаптической передачи и консолидации памяти.
Среднецепочечные жирные кислоты, в том числе капроновая кислота, поступают в организм с пищей и синтезируются кишечной микробиотой, легко проникают через гематоэнцефалический барьер и метаболизируются в митохондриях до ацетил-КоА [24]. У мышей линии 5xFAD уровень производной капроновой кислоты был ниже по сравнению с контрольной группой (рис. 3Г). Хотя эти различия не достигли статистической значимости, они согласуются с гипотезой о нарушении липидного обмена при болезни Альцгеймера [25] и снижении доступности среднецепочечных жирных кислот как дополнительных источников энергии [26]. Учитывая нейропротективные и прокогнитивные свойства среднецепочечных жирных кислот [27], дальнейшее изучение терапевтического потенциала препаратов на основе среднецепочечных жирных кислот для коррекции когнитивного дефицита при болезни Альцгеймера представляет научный интерес. Изобутират, редко изучаемый в контексте нейродегенеративных заболеваний, демонстрировал тенденцию к снижению у мышей линии 5xFAD по сравнению с контрольной группой как на 7, так и на 28 сутки после когнитивного обучения, однако статистическая значимость этих изменений не была достигнута (рис. 3Д). Уровень глицина, выполняющего функции тормозного нейромедиатора и ко-агониста NMDA-рецепторов, также не показал статистически значимой зависимости от факторов «генотип» или «время» (рис. 3Е). В совокупности полученные данные указывают, что у мышей с генетической моделью БА (линия 5xFAD) в отсроченном периоде после когнитивной нагрузки, когда у них проявляются признаки когнитивного дефицита, формируется специфический метаболический профиль, потенциально характеризующийся ограниченной способностью трансгенных животных поддерживать кетоновый метаболизм. Наиболее отчётливо эти изменения у животных с моделью БА по сравнению с животными контрольной группы проявляются к 28 суткам, что может свидетельствовать о нарушении метаболической «поддержки» таких процессов, как нейрогенез и неоангиогенез. ОБСУЖДЕНИЕ В настоящем исследовании с применением методов in vivo микродиализа и ЯМР-спектроскопии была проведена оценка метаболического ответа гиппокампа на когнитивную нагрузку у трансгенных мышей линии 5xFAD и животных дикого типа. Основное внимание было уделено динамике концентраций энергетически значимых и глиально-ассоциированных метаболитов (включая лактат, ацетат, изобутират, ацетон, капрат и глицин). Среди изученных соединений статистически достоверные различия между группами наблюдались только по ацетону, однако выявленные изменения в кетоновом профиле заслуживают отдельного рассмотрения. Поскольку ацетон является кетоновым телом, а кетоновые тела могут служить альтернативным источником энергии для нейронов при сниженной доступности глюкозы [12], снижение концентрации ацетона в мозге у мышей линии 5xFAD в период, характеризующийся показанной нами ранее манифестацией когнитивного дефицита, нарушениями нейрогенеза и гиппокампального ангиогенеза после когнитивной нагрузки [21], может указывать на ограниченную метаболическую пластичность при болезни Альцгеймера. Этот эффект может быть связан как с нарушением β-окисления жирных кислот, так и с митохондриальной дисфункцией, которые характерны для патогенеза БА [28]. Следует отметить, что концентрация ацетона превосходила таковую для лактата. Высокая концентрация может быть обусловлена процедурой имплантации зонда, которая индуцирует формирование зоны локального метаболического стресса. В этой области наблюдается активация липолиза в поврежденных клетках, что увеличивает доступность субстратов для кетогенеза, а также развитие транзиторной гипоксии, приводящей к сдвигу энергетического метаболизма в сторону анаэробного гликолиза и усиленной продукции лактата [29–31]. Изменения концентрации других метаболитов не достигали статистической значимости, что может быть связано с ограниченным размером выборки в рамках данного пилотного эксперимента. Тем не менее возможные сдвиги в использовании короткоцепочечных и среднецепочечных жирных кислот (изобутират, капрат), аминокислот (глицин) и соединений, актуальных для реализации нейрон-астроглиального метаболического сопряжения (лактат, ацетат) также требую внимания. Так, например, изобутират, продукт катаболизма аминокислот с разветвлённой цепью и микробного метаболизма, в ряде работ связывается с поддержанием энергетического и редокс-гомеостаза в ЦНС [26]. Капрат как среднецепочечная жирная кислота также может использоваться мозгом в качестве дополнительного энергетического субстрата [26]. Известно, что такие кислоты способны служить дополнительным источником энергии для мозга и повышать эффективность митохондриального окисления [25]. Снижение уровня глицина может влиять как на нарушение аминокислотного метаболизма, так и на регуляцию NMDA-рецепторов [32, 33]. Изменение уровне ацетата может отражать нарушение астроцитарного метаболизма и нейрон-астроглиального метаболического сопряжения [25]. Таким образом, полученные в ходе данного пилотного исследования результаты обуславливают необходимость дальнейшего изучения динамики этих метаболитов на расширенной выборке мышей линии 5xFAD, что в будущем внесет вклад в понимание хронологии развития энергетического дефицита и позволит идентифицировать новые биомаркеры ранних метаболических нарушений при болезни Альцгеймера. ЗАКЛЮЧЕНИЕ Выполненный пилотный анализ метаболитов интерстициальной жидкости гиппокампа методом ЯМР-спектроскопии позволил выявить, что у мышей с моделью болезни Альцгеймера (линия 5xFAD) в отсроченном периоде после когнитивной нагрузки формируется специфический метаболический профиль, характеризующийся тенденцией к снижению концентрации ацетона — ключевого показателя кетонового метаболизма. Данное изменение может отражать ограниченную способность к поддержанию кетонового обмена и, как следствие, сниженную метаболическую гибкость в условиях нейродегенеративного процесса. Хотя различия по большинству метаболитов не достигли статистической значимости, выявленные тенденции в уровнях ацетата, лактата, капрата и изобутирата указывают на возможные сдвиги в использовании альтернативных энергетических субстратов и в работе механизмов нейрон-астроглиального метаболического сопряжения. Эти результаты согласуются с современными представлениями о метаболических нарушениях при болезни Альцгеймера и подчеркивают необходимость дальнейших исследований с расширением выборки и включением оценки митохондриальных и глиальных маркеров. Таким образом, полученные данные подтверждают перспективность использования интегрированных подходов in vivo микродиализа и ЯМР-спектроскопии для оценки динамики метаболических изменений в гиппокампе при когнитивной нагрузке. Расширение подобных исследований позволит уточнить роль кетоновых тел и короткоцепочечных жирных кислот в поддержании энергетического гомеостаза и когнитивных функций при нейродегенеративных заболеваниях. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все процедуры были выполнены в соответствии с международными этическими стандартами обращения с лабораторными животными, с соблюдением принципов гуманности, согласно ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами» и были одобрены локальным этическим комитетом (протокол No 5-3/22 от 01.06.2022). БЛАГОДАРНОСТИ Авторы выражают благородность заведующей лабораторией экспериментальной патологии ЦНС Института мозга Российского центра неврологии и нейронаук к.б.н. Ставровской А.В. за помощь с оперативным вмешательством на мышах. ФИНАНСИРОВАНИЕ Исследование выполнено за счет гранта Российского научного фонда № 22-15-00126-П Молекулярные механизмы церебрального ангиогенеза в реализации феномена нейропластичности при хронической нейродегенерации. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|