К 40-летию Института физиологически активных веществ РАН
|
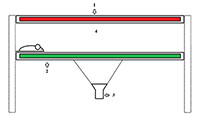
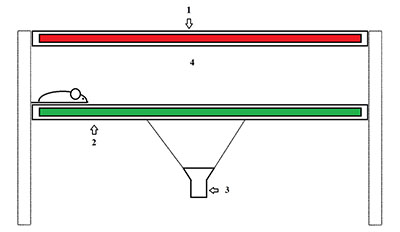
Эволюция методик оценки моторной функции лабораторных грызунов, моделирующих нейродегенеративные заболевания Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: chicheva.mariya@gmail.com Ключевые слова: нейродегенерация; походка; животные модели; моторная функция DOI: 10.18097/BMCRM00030 ВВЕДЕНИЕ Нейродегенеративные заболевания (НДЗ) представляют собой группу патологий, для которых характерна постепенная потеря функции нейронов [1]. В зависимости от того, какая из групп нейронов поражается в первую очередь, различают моторные (с преимущественным поражением мотонейронов, вследствие чего для клинической картины характерны прогрессирующие парезы конечностей, а затем и остальной мускулатуры) и сенсорные НДЗ (в первую очередь поражаются сенсорные нейроны, характерна постепенная потеря когнитивных функций, прогрессирование деменции). Оценка моторных функций имеет важное значение при изучении патологий, связанных с дегенерацией мотонейронов [2]. Изучение параметров походки животных, моделирующих болезни двигательного нейрона, может выявить изменения, происходящие на досимптоматической стадии развития заболевания, что в дальнейшем можно аппроксимировать на пациентов и использовать как ранний диагностический признак. Для патологий, в первую очередь затрагивающих сенсорные нейроны, оценка моторных нарушений выходит на первый план в период острой симптоматики. Изучение механизмов потери подвижности и соотнесение их с изменениями, происходящими на молекулярном уровне, даёт возможность более чёткой диагностики нейродегенеративных заболеваний. Для изучения моторных нарушений необходимы методы оценки движения животных. В разное время для этого использовались различные системы, их эволюция привела к возможности более точно оценивать большее количество параметров. 1. МЕТОДИКИ ОЦЕНКИ МОТОРНЫХ ФУНКЦИЙ Изначальным, самым простым методом оценки походки лабораторных грызунов является техника чернильных следов [3-5], которая остается актуальной и в настоящее время. На пальцы и лапы животного наносятся чернила, при необходимости – разных цветов [6], после чего животное запускается по бумаге мелкой линовки вдоль коридора. Далее полученные следы оцениваются вручную с помощью линейки [7, 8]. Особенного внимания заслуживает метод обсчёта следов, предложенный de Medinaceli [9], который был впоследствии использован, в том числе и для проведения исследований походки при нейродегенеративных заболеваниях [10]. Позднее появились методы оценки походки, предполагающие видеосъёмку с вентральной стороны животного, бегущего вдоль прозрачного коридора [11]. Это позволило компьютеризировать процесс обсчета данных. Пласт в исследовании походки грызунов, моделирующих болезни двигательного нейрона, составляют статьи с использованием беговых дорожек, которые пришли на смену ранее описанному методу [12]. Заслуживает особого внимания методика оценки походки, сочетающая в себе два вышеописанных метода: животное снимается с вентральной стороны во время бега по прозрачной беговой дорожке [13, 14]. Производством оборудования для таких исследований в настоящий момент занимаются следующие компании «Columbus Instruments» (США) (Gait Analysis Treadmill Exer Gait) и «Mouse Specifics, Inc.» (США) (DigiGait). Сейчас существует целый ряд современных систем, позволяющих оценивать походку лабораторных животных. Среди них – система TreadScan («Clever Sys Inc.», США) [15], достоинством которой являются относительно небольшие размеры и способность программы обрабатывать видеозаписи, сделанные с помощью других методик. Недостатком является ее неспособность оценить степень нажима на конечность. 2. СИСТЕМА CATWALK Наиболее современным и продуманным методом оценки походки лабораторных грызунов является система CatWalk («Noldus», Нидерланды). Суть методики состоит в следующем: животное бежит по относительно длинному коридору в тёмном помещении. Зеленый свет, излучаемый флуоресцентной лампой, расположенной по бокам от стеклянной пластины, по которой бежит животное, отражается внутри нее, за исключением точек, где лапы мыши контактируют с поверхностью пластины. Там свет рассеивается и освещает область контакта. Интенсивность освещения области соприкосновения пропорциональна степени нажима. Снизу стоит камера, осуществляющая видеосъемку животного с вентральной стороны. Специальная компьютерная программа, обрабатывающая видео, автоматически распознаёт следы, а также определяет степень нажима на поверхность в каждой точке пространства. Схема установки представлена на рисунке. Первое упоминание о системе в научной литературе датируется 2003 годом [16]. Основная область ее применения – изучение последствий травм нервной системы, хирургических вмешательств [17, 18]. Многие работы написаны с использованием CatWalk как инструмента оценки боли при артрозах и других воспалительных заболеваниях опорно-двигательного аппарата. [19, 20].
Ряд статей посвящен и исследованиям хореи Гентингтона. Часть авторов работала на трансгенной модели tgHD: животные несут кассету, кодирующую часть htt гена (ряд CAG повторов) под контролем эндогенного htt промотора. Так, авторы [21] с помощью системы CatWalk обнаружили отличия между экспериментальной и контрольной группами крыс в таких параметрах как Stand Index (скорость, при которой лапа теряет контакт с поверхностью) и Swing (длительность отсутствия контакта конкретной лапы с поверхностью во время шагового акта). Другая статья [22] подтверждает изменение параметра Swing и находит снижение длительности контакта лапы с поверхностью (Duration of paw contact) почти для всех конечностей. Ещё одна группа авторов работала на мышах линии R6/2 (аналог tgHD) [23], и им удалось детектировать снижение длины следа в экспериментальной группе животных. Ряд исследований посвящен изучению бокового амиотрофического склероза (БАС), как одной из самых острых форм нейродегенеративных заболеваний с поздней постановкой диагноза и неблагоприятным прогнозом. Большую часть работ составили исследования на классической модели БАС – линиях трансгенных мышей SOD1 с видоизменённым геном Cu/Zn супероксид-дисмутазы – фермента в норме отвечающего за расщепление токсического супероксида (побочного продукта окислительного фосфорилирования) и превращающего его в кислород и пероксид водорода. Очевидно, мутации в этом белке приводят к окислительному стрессу, который, в свою очередь, влияет на патологию БАС [24]. Группа ученых [25] иследовала ранние манифестации симптоматики с помощью системы CatWalk. В результате удалось установить отличия с группой сравнения в таком параметре как расстояние между передней и задней лапой в шаговом акте (relative position). Другая группа авторов [26], работая с той же моделью, продемонстрировала статистически значимые отличия группы контроля от экспериментальной группы по трём параметрам: время контакта передних конечностей с поверхностью (forelimb stand time), длина следа передних лап (Print Length – fore paws) и рабочий цикл (Duty cycle – forelimbs) – стабильно повторяющийся шаговый акт (у SOD1 он становится неравномерным). К возрасту 90 дней становятся достоверными отличия в таком параметре как Support-diagonal, что означает, что мыши перестают себя стабильно удерживать на двух диагонально расположенных лапах. Ряд коллективов занимались влиянием дополнительных изменений на генном уровне на развитие патологии у SOD1 мышей. Так, группа учёных [27] изучает с помощью системы CatWalk эффективность внедрения 2 генов – PRDX3 и NRF2 (гены, кодирующие антиоксидантные белки: перредоксин 3 и транскрипционный фактор с доменом CNC и участком лейциновой молнии), оба на базе конструкта AAV6. К сожалению, достоверных отличий в динамике развития патологии между животными SOD1 контрольной и экспериментальных групп обнаружить не удалось. Позже другой группой авторов [28] было детектировано замедление прогрессии симптоматики БАС у мышей линии SOD1, несущей лентивирусную конструкцию α CAR IGF-1 LV. Исследование эффекта делеции в гене MST1, представленной в обеих аллелях, в линии мышей SOD1 показало, что такой параметр как длина шага был значительно ближе к показателям дикого типа у мышей с гомозиготной делецией [29]. Кроме изменений на генетическом уровне с помощью CatWalk пытались оценивать влияние потенциальных лекарственных препаратов на развитие патологии у мышей SOD1. Так, группой авторов [30] было найдено соединение S+-апоморфин, влияющее на транскрипционный фактор Nrf2 – ключевой регулятор нейропротекции посредством стимулирования запуска антиоксидантного ответа. С помощью системы CatWalk было зафиксировано замедление уменьшения длины шага у мышей SOD1, которые получали S+-апоморфин, по сравнению с контрольной группой. Система CatWalk активно используется при создании новых моделей БАС. При фенотипировании линии мышей – двойных нокаутов по ядерному фактору гепатоцитов-6 (Hnf6-/-), который является транскрипционным активатором семейства OneCut [31] с помощью системы CatWalk были выявлены достоверные отличия от контрольной группы по двум параметрам – интенсивность нажима задних конечностей (intensity of the hind paw contacts) и расстояние между задними конечностями (hind limb base of support). Для нокаутной линии мышей AMPKα2-/- (лишённых α2-содержащей формы 5’-аденозин монофосфат-активируемой протеинкиназы – формы AMPK, играющей важную роль в нервной и мышечной ткани) [32] были выявлены изменения аналогичные мышам SOD1 – укорачивалась длина шага (stride length) как передних, так и задних конечностей. Кроме того, была показана сходная динамика relative position – расстояния между постановкой передней и соответствующей задней лапы в следующем шаговом такте. Для новой линии, основанной на патологической агрегации белка fused in sarcoma – FusΔNLS/+ [33, 34] выявлена статистически достоверное укорочение длины шага (stride length) и увеличение вариации скорости (body speed variation), то есть, мышь начинает двигаться «перебежками», чередуя периоды быстрого движения с остановками. Аналог CatWalk на рынке – система GaitLab («ViewPoint», Франция) [35], но она является менее популярной и не обладает расширенным арсеналом методов анализа по сравнению с системой CatWalk.. ЗАКЛЮЧЕНИЕ Из проведенного анализа можно сделать вывод, что современные системы оценки походки уверенно завоёвывают место среди передовых методик изучения нейродегенеративных заболеваний, число публикаций с их использованием увеличивается, а схемы интерпретации полученных с их помощью данных усложняются. БЛАГОДАРНОСТИ Работа поддержана грантом РФФИ (№ 16-04-01089), содержание животных обеспечено программой поддержки биоресурсных коллекций ИФАВ РАН (ФАНО №0090-2017-0016) и проведена на оборудовании ЦКП ИФАВ РАН, в рамках Государственного задания ИФАВ РАН (тема по ГЗ № 0090-2017-0019) и программы РАН тема №48.8. «Поиск и исследование механизмов действия нейропротекторов и стимуляторов когнитивных функций». ЛИТЕРАТУРА
|