|
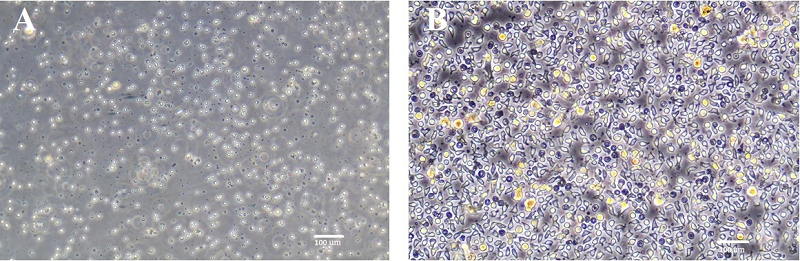
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ СОЗРЕВАНИЯ ДЕНДРИТНЫХ КЛЕТОК ПРИ ИХ СТИМУЛЯЦИИ БАКТЕРИАЛЬНЫМ ЛИПОПОЛИСАХАРИДОМ ИЛИ ФАКТОРОМ НЕКРОЗА ОПУХОЛЕЙ АЛЬФА 1Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, 119121, Москва, ул. Погодинская, 10; *e-mail: biocell@inbox.ru 2Московская гимназия на Юго-Западе №1543 им. Ю.В. Завельского, 119571, Москва, ул. 26 Бакинских комиссаров, 3 корп. 5 3Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского, 117997, Москва, ул. Большая Серпуховская, 27 Ключевые слова: дендритные клетки; индуцированное созревание; фактор некроза опухолей; липополисахарид; клеточные вакцины DOI: 10.18097/BMCRM00309 ВВЕДЕНИЕ Дендритные клетки (ДК) – «профессиональные» антиген-презентирующие клетки (АПК), обеспечивающие взаимосвязь между естественной иммунорезистентностью и адаптивным иммунитетом. Миелоидные (конвенциональные) ДК могут дифференцироваться из гемопоэтических стволовых клеток [1] или из моноцитов периферической крови [2] под действием гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и интерлейкина-4 (IL-4). Находясь в различных тканях, ДК способны мигрировать в участок воспаления по градиенту хемокинов, таких как CCL3 и CCL20 [3], и, подобно макрофагам, поглощать антигены [4]. Для распознавания чужеродных антигенов миелоидные ДК экспрессируют на своей поверхности толл-подобные рецепторы (TLR), способные взаимодействовать с пептидогликанами, липополисахаридами, флагелином, фрагментами внеклеточной ДНК и двухцепочечной РНК, а также другими патоген-ассоциированными молекулярными паттернами (PAMP) [5]. Кроме того, экспрессирующиеся на мембране ДК лектины С-типа (DEC205 и DC-SIGN (CD209)), схожие с рецепторами маннозы, способны распознавать углеводородные структуры на поверхности патогенов [6]. Процесс неспецифического распознавания и захвата чужеродных антигенов, характерный для естественных иммунологических реакций, в случае с ДК является начальным этапом развития адаптивного иммунного ответа. Под действием факторов воспаления ДК снижают интенсивность рецептор-опосредованного эндоцитоза и подвергаются созреванию. В процессе созревания ДК начинают экспрессировать хемокиновые рецепторы CCR4, CCR7 и CXCR4, способствующие их миграции в лимфоидные органы [3]. Кроме того, зрелые ДК существенно повышают уровень экспрессии молекул II класса главного комплекса гистосовместимости (ГКГ) – HLA-DR, а также костимулирующих молекул CD80, CD83, CD86, CD40, необходимых для активации Т-лимфоцитов, при их взаимодействии с ДК [7]. Находясь в лимфоидных органах, зрелые ДК презентируют процессированный антиген T-лимфоцитам в виде пептидов в комплексе с молекулами ГКГ, вызывая тем самым активацию и клональную экспансию клеток, специфичных к данному антигену. Отличительной особенностью ДК является их способность к кросс-презентации [8]: они способны представлять поглощенный антиген в контексте не только молекул ГКГ второго (HLA-DR), но и первого класса (HLA-ABC). Это позволяет синхронизировать активацию CD4-позитивных T-хелперов и CD8-позитивных цитотоксических лимфоцитов, которые распознают различные пептиды одного и того же антигена в составе молекул ГКГ второго и первого класса соответственно. В связи с этим ДК являются необходимым участником успешной индукции первичного иммунного ответа. Уникальные иммунологические свойства ДК делают актуальным их использование в качестве клеточной вакцины для лечения онкологических и хронических инфекционных заболеваний. Незрелые ДК могут быть получены in vitro из моноцитов крови пациентов в результате индуцированной дифференцировки и «нагружены» необходимыми антигенами [9]. Дальнейшее созревание ДК и введение их пациенту способствует активации иммунного ответа на данный антиген. При этом, зрелость ДК является критическим параметром для достижения желаемого результата. Незрелые ДК не только оказываются неэффективными индукторами клональной активации эффекторных лимфоцитов, но и обладают способностью инициировать развитие периферической толерантности, вызывая анергию T-лимфоцитов и стимулируя образование T-регуляторных клеток [10]. В связи с этим для получения зрелых ДК in vitro применяют различные индукторы, стимулирующие экспрессию HLA-DR и необходимые для эффективной активации лимфоцитов костимулирующих молекул. В данной работе мы сравнили эффективность стимуляции созревания ДК при помощи бактериального липополисахарида (LPS) и провоспалительного цитокина – фактора некроза опухолей альфа (TNFα). МЕТОДИКА Выделение моноцитов и лимфоцитов Клетки получали из образцов периферической крови здоровых доноров, предоставленных банком крови Национального медицинского исследовательского центра хирургии им. А.В. Вишневского. Все образцы были предварительно проверены на отсутствие гемотрансмиссивных инфекций. Мононуклеарную фракцию клеток выделяли методом седиментации в градиенте плотности раствора Фиколла (ρ=1.077 г/см3; «ПанЭко», Россия), при 400 g в течение 40 мин при комнатной температуре (центрифуга «Eppendorf», США). Клетки, собранные из мононуклеарного кольца градиента (сбор проводили на льду), были дважды отмыты в фосфатно-солевом буферном растворе (PBS) центрифугированием при 300 g (8°C, 10 мин). Клетки помещали в среду RPMI 1640 («ПанЭко») с пятипроцентным содержанием инактивированной при 56°C в течение 25 мин эмбриональной телячьей сыворотки (ЭТС) («HyClone», США) в культуральных флаконах площадью 25 см2 («SPL Lifescinces», Ю. Корея) из расчёта 5 млн. клеток на флакон. Флаконы были оставлены в CO2-инкубаторе («Sanyo», Япония) (37°C, 5% CO2) на 2 ч. Далее среду переносили во флакон площадью 75 см2 (культура, обогащенная лимфоцитами) и оставляли в CO2-инкубаторе. Флаконы с прикрепленными к подложке моноцитами дополнительно отмывали раствором Хенкса («ПанЭко») для уменьшения их контаминации лимфоцитами. К оставшимся моноцитам добавляли 5 мл полной среды, включавшей RPMI 1640 («ПанЭко»), 10 мМ Hepes буфер («STEMCELL», Канада), 1 мМ пируват натрия («STEMCELL»), 24 мкг/мл гентамицина («ПанЭко») и 5% инактивированной ЭТС. Подсчет количества клеток и фотографирование культур Для подсчета клеток 5 мкл клеточной суспензии смешивали с 5 мкл красителя трепановый синий («Invitrogen», США), окрашивающего мертвые клетки. Полученные 10 мкл суспензии загружали в слот для автоматического счетчика клеток Countess II («Invitrogen»). Фотосъемку культур проводили при помощи цифровой камеры Nikon D5000 («Nikon», Япония) и инвертированного микроскопа с фазовым контрастированием Axiovert 40 CFL («Carl Zeiss», Германия). Индукция дифференцировки и созревания ДК Для индукции дифференцировки к культуре моноцитов добавляли GM-CSF (80 нг/мл) и IL-4 (50 нг/мл) («SCI-STORE», Россия). После этого клетки культивировали в CO2-инкубаторе. На 3 день к ним добавляли 1 мл полной среды, содержащей GM-CSF и IL-4 по 100 нг/мл. На 5 день в часть флаконов, помимо GM-CSF и IL-4, добавляли 20 нг/мл TNFα («Prospec», Израиль) и 1 мкг/мл простагландина Е2 (PGE2) («Sigma», США) или 1 мкг/мл LPS («Sigma»). Через 3 дня эффективность созревания оценивали цитометрически по экспрессии HLA-DR и костимулирующих молекул. Оценка пролиферации лимфоцитов при их сокультивировании с ДК Сокультивирование ДК и лимфоцитов проводили в 24-луночных планшетах («SPL Lifescinces»). В планшет переносили открепившиеся от подложки незрелые ДК в количестве 500 тыс. клеток на лунку. В часть лунок вносили 1 мкг/мл LPS или 20 нг/мл TNFα и 1 мкг/мл PGE2. На следующие сутки к ним добавляли аллогенные лимфоциты из расчета 1 млн. клеток на лунку и сокультивировали 3 суток. Лимфоциты предварительно окрашивали, инкубируя с CFSE («Sigma») 1 мкг/мл в течение 5 минут при 37˚C и отмывали 3 раза. Для анализа стадии клеточного цикла, неокрашенные лимфоциты сокультивировали с ДК при аналогичных условиях 2 суток. Проточная цитофлуориметрия Для выявления поверхностных молекул, клетки окрашивали антителами в 50 мкл PBS содержащем 2% инактивированной ЭТС. Использовали моноклональные антитела к мембранным маркерам, конъюгированные с флуорохромом («BD Biosciences», США) в количестве, рекомендованном производителем (5 мкл на тест). Инкубацию проводили при 4°С в течение 40 мин. Далее образцы дважды отмывали от остатков антител в PBS. Клеточный осадок фиксировали в 100 мкл 2% параформальдегида («BD Biosciences») в темноте в течение 15 мин, после чего к каждому образцу добавили по 500 мкл PBS. Для анализа клеточного цикла, лимфоциты фиксировали в 200 мкл охлажденного до -20С° этанола (70%). Клетки инкубировали не менее 1 ч в морозильнике при -20°С и затем добавляли 300 мкл PBS. Непосредственно перед цитометрическим анализом клетки отмывали дважды PBS путем центрифугирования при 300 g в течение 7 мин и ресуспендировали в 500 мкл PBS. В суспензию добавляли пропидиум иодид (PI, «Sigma») 10 мкг/мл. Анализ флуорисценции PI проводили в канале фикоэритрина (PE) в линейных координатах. Анализ образцов производили при помощи проточного цитофлуориметра-сортера FACSAria III («BD Biosciences»). Анализ флуоресценции антител проводили в соответствующих каналах в логарифмических координатах. Анализ данных Анализ и графическую обработку цитометрических данных проводили в программе FlowJo, часть гистограмм создана при помощи Excel. Статистические тесты выполнены с использованием программы SigmaPlot. Достоверными считали различия при p < 0.05 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Получение незрелых ДК Выделенные мононуклеарные клетки разделяли на моноцитарную и лимфоцитарную фракции за счет способности моноцитов прикрепляться ко дну культурального флакона (рис. 1A). В процессе дальнейшего культивирования моноциты дифференцировались под действием GM-CSF и IL-4 в более крупные ДК, имеющие характерную неровную форму. При этом в процессе дифференцировки моноциты, по-видимому, сохраняли свою пролиферативную способность, о чем свидетельствует увеличение количества клеток в культуре (рис. 1B). К пятому дню дифференцировки большинство клеток откреплялось от поверхности культурального флакона.
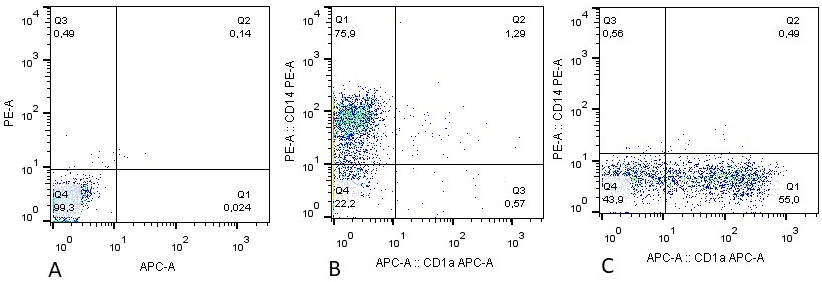
Эффективность дифференцировки ДК оценивали с помощью проточной цитометрии по исчезновению на клеточной мембране моноцитарного маркера CD14 и появлению CD1a ― маркера незрелых ДК, который появляется на некоторых клетках и выполняет функцию презентации липидных антигенов [11]. На пятый день культивирования без GM-CSF и IL-4 в составе культуральной среды моноциты сохраняли экспрессию характерного для них и макрофагов маркера CD14. В случае включения в состав среды указанных цитокинов, экспрессирующие CD14 клетки практически полностью исчезали и появлялись клетки, экспрессирующие CD1a (рис. 2), что свидетельствует об успешной дифференцировке моноцитов в ДК.
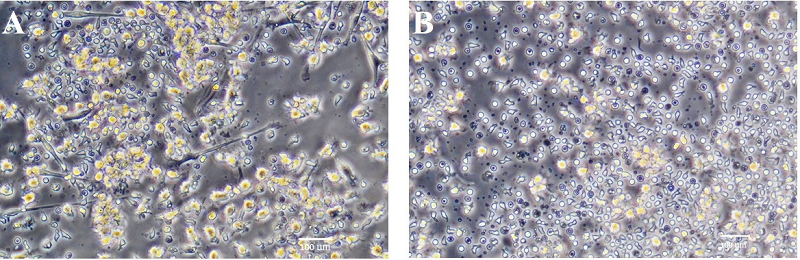
Индуцированное созревание дендритных клеток Для сравнения функциональной активности ДК, подвергнутых созреванию под действием различных биохимических факторов, мы использовали сочетание TNFα и PGE2, которые широко применяются в качестве главных компонентов коктейля для получения ДК вакцин [12]. Ранее, в том числе и в нашей работе, было показано, что добавление PGE2 существенно увеличивает способность TNFα стимулировать созревание ДК [13]. В качестве альтернативы использовали бактериальный LPS, стимулирующий созревание за счет взаимодействия с TLR4 на поверхности ДК [14]. Вещества добавляли к культурам незрелых ДК на 5 день с начала индуцированной дифференцировки и через 3 дня оценивали их созревание (рис. 3).
Как видно на рисунке 3, при стимуляции созревания с помощью LPS, помимо ДК, в культуре присутствует небольшое количество клеток с вытянутой морфологией, характерной для макрофагов (рис. 3А). Такой тип клеток не выявляется при созревании ДК под действием TNFα (рис. 3В). В связи с этим можно предположить, что LPS индуцировал дифференцировку части клеток, не подвергшихся окончательному превращению в ДК, по макрофагальному пути. Кроме того известно, что TNFα способен инициировать апоптоз клеток, не прошедших созревание, таких как толерогенные ДК [15].
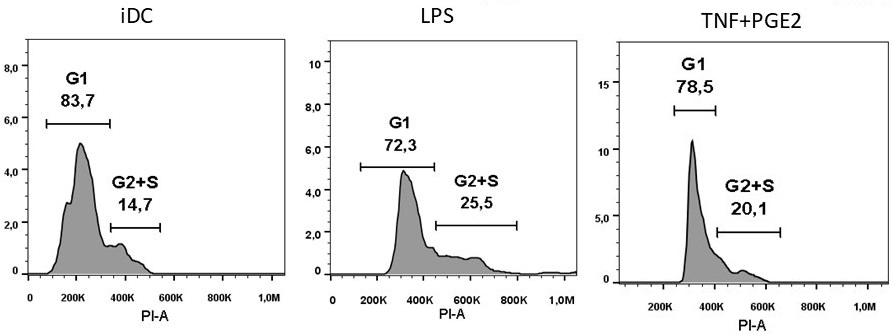
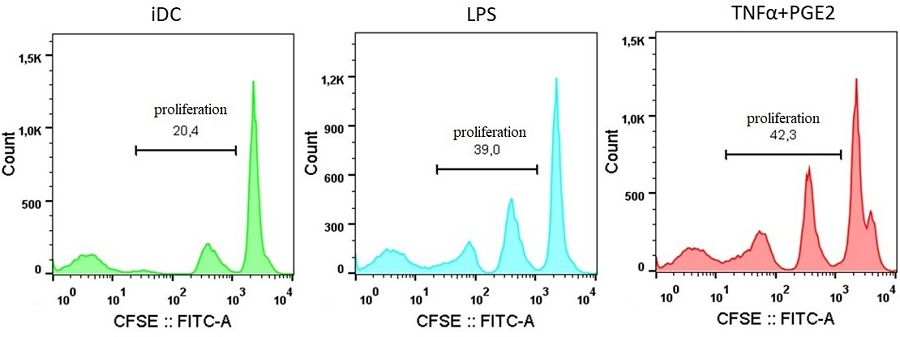
Оценка способности ДК стимулировать пролиферацию аллогенных лимфоцитов. Поскольку активация пролиферации T-лимфоцитов является основной функцией ДК, мы оценили способность ДК, полученных с использованием альтернативных способов созревания, стимулировать пролиферацию лимфоцитов. Аллогенные лимфоциты добавляли через сутки после начала созревания ДК. На вторые сутки сокультивирования оценивали распределение лимфоцитов по стадиям клеточного цикла, а еще через сутки анализировали пролиферацию предварительно окрашенных CFSE лимфоцитов по изменению интенсивности флуоресценции этого красителя. При сокультивировании с незрелыми ДК лишь 14.7% лимфоцитов находились в G2/S фазе клеточного цикла (рис. 4). Сокультивирование лимфоцитов со зрелыми ДК увеличивало долю лимфоцитов в G2/S фазе в обоих случаях. Лимфоциты сокультивированные с ДК, стимулированными LPS- или TNFα+PGE2, находились в G2/S фазе в 25.5% и 20.1% случаев соответственно.
Окрашенные CFSE лимфоциты после сокультивирования с ДК анализировали при помощи проточной цитометрии. Аллогенные лимфоциты сокультивируемые со зрелыми ДК показали примерно в 2 раза более высокую пролиферативную активность по сравнению с незрелыми ДК (рис. 5). При этом добавление в монокультуру лимфоцитов исследуемых стимуляторов созревания не вызывало их пролиферацию (результат не показан). Кроме того, как видно из рисунка 5, подавляющее большинство пролиферирующих в присутствии незрелых ДК лимфоцитов сделали не более одного деления. Это может быть связано с тем, что на момент сокультивирования с ДК у этих лимфоцитов были уже запущены механизмы инициации пролиферации. Таким образом, эксперименты по сокультивированию показали, что зрелые ДК, независимо от способа индукции их созревания, лучше стимулируют пролиферацию лимфоцитов, чем незрелые.
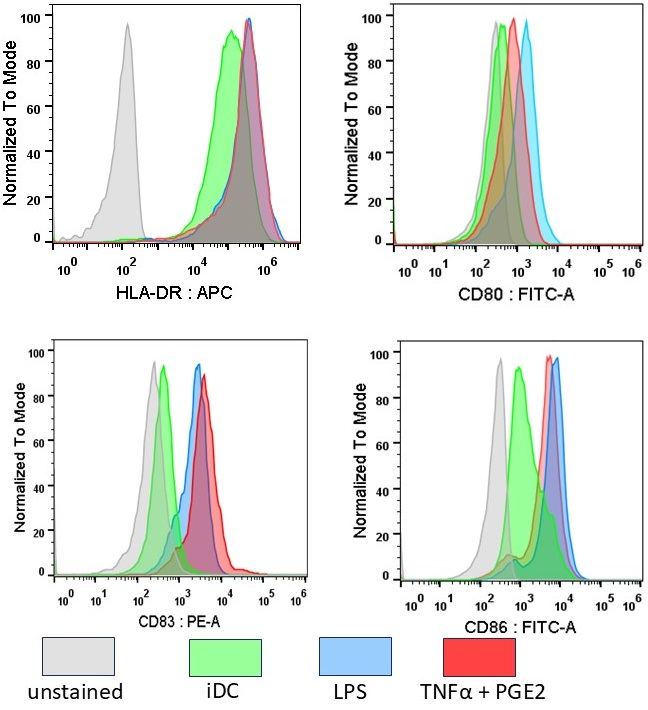
Экспрессия HLA-DR и костимулирующих молекул на ДК после их созревания Важным критерием зрелости ДК является высокая экспрессия на их поверхности HLA-DR, участвующего в презентации антигенных пептидов T-лимфоцитам, а также костимулирующих молекул, необходимых для их активации. В связи с этим была проведена цитометрическая оценка уровня экспрессии HLA-DR и костимулирующих молекул CD80, CD83 и CD86. В результате проведенного анализа незрелых ДК и ДК, подвергнутых альтернативной индукции созревания, были выявлены некоторые различия уровня экспрессии отдельных маркеров созревания (рис. 6). Как и ожидалось, созревание ДК приводило к заметному (примерно в 5 раз) увеличению присутствия HLA-DR на клеточной мембране, причем независимо от способа индукции созревания. Имело место и небольшое увеличение экспрессии CD80, особенно при использовании LPS. Кроме того, при любом из использованных способов стимуляции созревания, на ДК наблюдался существенный рост экспрессии CD83 и CD86.
Тот факт, что CD86 при созревании ДК экспрессируется активнее, чем CD80 хорошо известен. Это связано с особенностями функциональной активности двух костимулирующих молекул, распознающих один и тот же лиганд [16]. В отношении CD83, другими авторами было показано, что при LPS-индуцированном созревании ДК он появляется на мембране быстрее и в большем количестве по сравнению с CD40, CD80 и CD86 [17]. В своей более ранней работе мы также показали, что на фоне экспрессии таких молекул как CD11c, СD40, CD80, CD86, CD209, CCR7 экспрессия CD83 является наиболее информативным маркером созревания ДК, поскольку эта молекула практически отсутствует на незрелых клетках [13]. Хотя как LPS, так и TNFα стимулируют созревание ДК, запускаемые ими молекулярные механизмы различаются. LPS, связываясь с рецепторным комплексом TLR4/MD-2 на поверхности ДК, запускает два основных сигнальных пути. Один из них активируется после интернализации и через адаптерную молекулу TRIF и киназу TBK1 индуцирует продукцию интерферонов I типа. Второй, более ранний, запускается сразу после рекрутирования адаптерного белка MyD88. Этот каскад активирует IRAK-киназы и TRAF6, что приводит к активации транскрипционного фактора NF-κB, который индуцирует экспрессию целого ряда ко-стимулирующих молекул и провоспалительных цитокинов, включая TNFα [18]. При активации созревания ДК с использованием TNFα, также активируется NF-κB, но при участии других адаптеров и киназ. TNFα действует через специфические рецепторы (TNFR1 и TNFR2) на поверхности ДК. Связывание TNFα с рецептором приводит к рекрутированию комплекса белков, включающего TRADD, RIPK1, TRAF2/5. Этот комплекс, в свою очередь, активирует киназный каскад (IKK комплекс), который фосфорилирует ингибитор IκB, высвобождая NF-κB [19]. Таким образом, LPS моделирует патоген и инициирует процесс созревания ДК de novo через распознавание PAMP, в то время как TNFα действует как медиатор текущего воспалительного процесса. По-видимому, именно этим обусловлено частое использование LPS, самого по себе или в сочетании с агонистами других TLR, тогда как TNFα лучше проявляет свои стимулирующие свойства в составе коктейлей с другими провоспалительными цитокинами и PGE2. TNFα, образующийся в результате воздействия LPS на ДК, по-видимому, участвует в аутокринной и паракринной стимуляции их созревания. Активация TLR4 приводит к быстрой (в течение минут) активации сигнальных путей MAPK и NF-κB [20]. Это индуцирует транскрипцию генов "немедленного раннего ответа", к которым относится и TNFα. Известно, что LPS приводит к пиковой концентрации TNF-α в супернатанте через 6-8 часов после стимуляции [21], что вполне укладывается в динамику созревания ДК in vitro под действием LPS. Несмотря на то, что использование агонистов TLR, включая LPS, для индукции созревания ДК кажется предпочтительным, в клинической практике «золотым стандартом» считаются стимулирующие коктейли на основе TNFα. Возможно это связано с их большей специфичностью в отношении провоспалительных сигналов. Не исключено, что обнаруженные в наших экспериментах признаки макрофагальной дифференцировки являются следствием определенной пластичности клеточного ответа на LPS. Однако имеются сомнения и в отношении индукции созревания с помощью TNFα. Есть данные, что образующиеся при этом зрелые ДК слабо секретируют IL-12, необходимый для активации Th1-клеток и появления цитотоксических лимфоцитов [22]. Это может приводить к нежелательному гуморальному ответу и даже к индукции регуляторных Т-клеток. Напротив, ДК, созревшие под действием LPS, лучше активируют Th1-клетки [23], но обладают слабой миграционной активностью, недостаточной для миграции в регионарные лимфоузлы [24]. Способность к миграции может быть значительно улучшена добавлением PGE2 [25], но при этом повышается риск индукции Th2 и, следовательно, гуморального ответа. Таким образом, выбор способов созревания ДК является нелегкой задачей, требующей компромиссных решений и новых подходов. ЗАКЛЮЧЕНИЕ В ходе исследования мы не обнаружили существенных различий между ДК, подвергнутыми альтернативным способам индукции созревания, по признаку экспрессии костимулирующих молекул, необходимых для развития противоопухолевого иммунного ответа, а также по способности ДК стимулировать пролиферацию лимфоцитов. При этом были обнаружены признаки, свидетельствующие о том, что использование LPS в качестве индуктора созревания ДК может способствовать дифференцировке в направлении макрофагов. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ В работе были использованы анонимизированные образцы крови здоровых доноров, предоставленные банком крови НМИЦ хирургии им. А.В. Вишневского. Работу с кровью проводили в строгом соответствии с Федеральным законом от 20.07.2012 N 125-ФЗ (ред. от 28.12.2024) «О донорстве крови и ее компонентов», а также с постановлением Правительства «Правила заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов» от 14 мая 2025 г. N 641. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030) No. 122022800499-5. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00____________) на сайте журнала. |