|
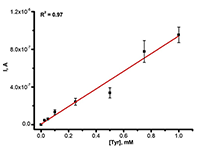
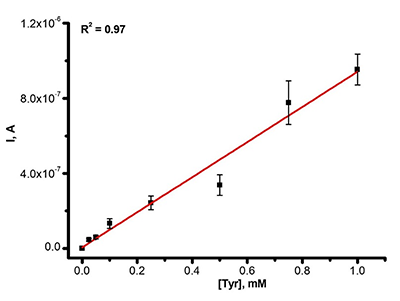
СОДЕРЖАНИЕ Рисунок 1 Типичная циклическая вольтамперограмма Рисунок 3б Зависимость окислительно тока ДИВА от концентрации тирозина в сыворотке крови Рисунок 5 Схема электроокисления пуринов Рисунок 7 Механизм электрохимического окисления/восстановления ацетаминофена Таблица 1Сравнительные характеристики электрохимических систем |
Методы электроанализа биологических молекул
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича,
119121 Москва, ул. Погодинская, 10 стр. 8, *e-mail: viktoria.shumyantseva@ibmc.msk.ru
2 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
3Химический факультет МГУ им. М.В. Ломоносова, Москва
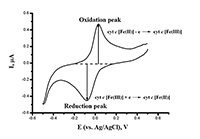
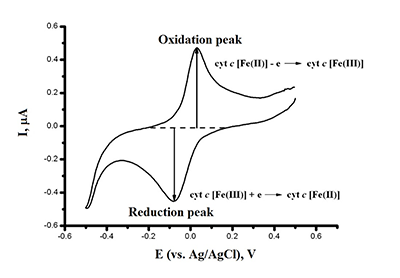
Ключевые слова: электроанализ; гемопротеины; ДНК; лекарственные препараты; электроокисление; электрокатализ DOI: 10.18097/BMCRM00032 ВВЕДЕНИЕ Электрохимические методы в биомедицинских исследованиях основаны на регистрации процессов, происходящих при получении или отдаче электронов биологическими молекулами. Особенностью электрохимических систем является то, что электрохимические методы являются количественными, и это позволяет рассчитать количество электроактивного биокомпонента в пробе. Электроанализ может быть применен не только для конструирования биосенсорных систем, но и для исследования механизма каталитических реакций, а также для разработки биореакторов на основе функционирования высокоспецифичных и стереоспецифичных белков-ферментов. Информационные параметры электроанализа позволяют рассчитать не только кинетические константы ферментативных процессов, но и охарактеризовать биоэлектрохимическую систему, определить особенности электродных процессов, электродную кинетику переноса электронов в системе электрод/фермент, определить эффективные формальные потенциалы редокс-активных компонентов, исследовать стехиометрию компонентов электродных реакций, рассчитать количество электроактивного вещества, участвующего в процессе, исследовать условия обратимости/необратимости реакций, в определенных условиях рассчитать изменение термодинамических параметров (ΔG,ΔS, ΔH), а также получить информацию о типе процесса (диффузионный или поверхностный) для исследуемого биокомпонента. Электроанализ каталитической активности цитохромов Р450 применим для расчетов кинетических параметров ферментативной реакции. Методы мониторинга химической модификации, контролируемой биохимическими событиями, такими как посттрансляционные модификации, а также структурной перестройки при комплексообразовании функционально значимых белков и пептидов с ионами металлов, перспективны для изучения конформационных перестроек биомолекул при проведении скрининга потенциальных лекарственных препаратов. Электроанализ ДНК и олигонуклеотидов позволяет определить количество ДНК в пробе, что является эффективным методом количественной оценки нуклеотидного материала в биологических образцах (плазме или сыворотке крови). Приведены примеры анализа лекарственных препаратов на основе электрохимических реакций в биологических пробах. МАТЕРИАЛЫ И МЕТОДЫ Электрохимические измерения Электрохимические измерения проводятся с использованием потенциостатов PGSTAT 12 Autolab, μAutolab Type III («Metrohm Autolab», Нидерланды) с программным обеспечением GPES, (версия 4.9.7) и PGSTAT 312N Autolab с программным обеспечением NOVA (версия 2.0). В работе используются трехконтактные электроды, полученные методом трафаретной печати («КолорЭлектроникс», Москва, http://www.colorel.ru/) с графитовыми рабочим и вспомогательным электродами и хлорсеребряным электродом сравнения. Диаметр рабочего электрода 0.2 см (площадь 0.0314 см2). Все потенциалы приведены относительно хлорсеребряного электрода сравнения (Ag/AgCl). В работе применяется метод иммобилизации гемопротеинов на печатных графитовых электродах (ПГЭ), модифицированных дидодецилдиметиламмония бромидом (ДДАБ). На поверхность рабочего графитового электрода наносят 1 мкл 0.1 М раствора ДДАБ в хлороформе. После испарения хлороформа (10 мин) наносят 1 мкл анализируемого белка соответствующей концентрации. Электроды оставляют при температуре +4˚С на 12 ч. во влажной камере, предотвращающей высыхание белков. Перед началом всех электрохимических измерений электроды инкубируют в электролитном (0.1 М KH2PO4 + 0.05 М NaCl) буфере, pH 7.4, 20 минут при комнатной температуре (22 ± 3ºС). Электрохимические измерения в анаэробных условиях проводят в герметично закрытой ячейке с помещенным в нее ферментным электродом. Ячейка заполняется 1 мл электролитного буфера, герметично закрывается, в течение 30 мин. пропускается аргон. Параметры регистрации циклических вольтамперограмм: диапазон потенциалов от +0.5 до -0.8 В, скорости развертки потенциала от 10 до 100 мВ/с. Циклическая вольтамперометрия ферментного электрода в аэробных условиях регистрируется в 1 мл электролитного буфера (0.1 М калий фосфатный буфер, рН 7.4, содержащем 0.05М NaCl). Для измерения сигнала электроокисления аминокислот в составе белков электроды модифицируют многостеночными углеродными нанотрубками (МУНТ), диспергированными в хлороформе (1 мг/мл, ультразвуковая дезинтергация 1 мин). На рабочий электрод наносят 1 мкл суспензии, после испарения хлороформа наносят исследуемый белок, аминокислоту или пептид (60 мкл). Измерения проводят в горизонтальном режиме. Для электроанализа ДНК и лекарственных препаратов рабочий электрод модифицируют дисперсией МУНТ или графена в хлороформе (1 мг/мл). Электроанализ ДНК и лекарственных препаратов проводят в горизонтальном режиме измерений при нанесении 60 мкл анализируемой пробы в 0.1 М калий фосфатном буфере (рН 7.4), содержащем 0.05М NaCl. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Электрохимическим сигналом называется временная зависимость тока или напряжения, используемая для передачи информации. Носителем информации является один или несколько параметров сигнала: амплитуда сигнала, положение сигнала (потенциал). Численное значение информационного параметра называется аналитическим сигналом. Электрохимическая ячейка должна иметь систему электродов и электролит. Для точных измерений используют три электрода: индикаторный или рабочий электрод, электрод сравнения и вспомогательный электрод (противоэлектрод). Функционирование индикаторного электрода связано с его чувствительностью к частицам, присоединяющим или отдающим электроны. Электрод сравнения имеет стабильный и воспроизводимый потенциал, не зависящий от среды, в которой проводятся измерения. Он служит эталоном, относительно которого измеряют потенциал индикаторного (рабочего) электрода. В качестве электрода сравнения часто используют хлорсеребряный электрод сравнения Ag/AgCl, имеющий потенциал +0.207 мВ относительно стандартного водородного электрода. Если раствор имеет большое омическое сопротивление, и ток, протекающий через ячейку, достаточно велик, необходимо использование вспомогательного электрода. Вспомогательный электрод обеспечивает протекание тока через ячейку. Его потенциал и ток не измеряют [1]. Электрохимические методы, применяемые для анализа биологических объектов Циклическая вольтамперометрия – метод регистрации зависимости I=f(E), т.е. тока от потенциала (потенциала относительно электрода сравнения) одновременно катодного и анодного процесса (рис. 1). Циклическая вольтамперометрия позволяет определить потенциал и амплитуду анодного процесса (Epa) и катодного процесса (Epc). Сигнал, как E=f(t) в циклической вольтамперометрии представляет собой быстрый треугольный импульс. Циклическая вольтамперограмма характеризуется пиком восстановления и окисления ионов или молекул при определённом потенциале (относительно хлорсеребряного электрода сравнения, отн. Ag/AgCl) [1-3].
Зависимость потенциала электродной реакции от активностей (концентраций) окисленной и восстановленной форм вещества выражается уравнением Нернста:
Формальный потенциал определяется уравнением:
В общем случае выражение для тока процесса Ox + nē ↔ Red описывается уравнением Батлера-Фольмера:
Для процессов, контролируемых диффузией, ток пика пропорционален корню квадратному из скорости развёртки потенциала согласно общей форме уравнения Рэндлса-Шевчика [4]:
Для обратимых электрохимических систем в отсутствии диффузии, т.е. в которых электроактивные молекулы адсорбированы на электроде или окислительно-восстановительный процесс протекает вблизи поверхности электрода, ток пиков линейно зависит от скорости развёртки потенциала и выражается следующим уравнением:
С помощью данного метода можно получить экспериментальную картину о кинетике и термодинамике многих электрохимических систем, в том числе и электрокаталитических.>
Квадратно-волновая вольтамперометрия (КВВА) – способ снижения границы определяемых концентраций при вольтамперометрическом измерении, при котором на постоянную составляющую напряжения накладывают переменную составляющую небольшой амплитуды прямоугольной формы с частотой 20-225 Гц. Хроноамперометрия (амперометрия) – метод электрохимического анализа, в котором приложенное к ячейке напряжение поддерживается постоянным, а протекающий через ячейку ток является функцией концентрации, времени и ряда других факторов. Метод, основанный на измерении тока как функции концентрации при постоянном напряжении рабочего электрода, называется амперометрическим титрованием. Дифференциально-импульсная вольтамперометрия (ДИВА) – метод регистрации зависимости тока от потенциала, при котором развертка потенциала производится в виде прямоугольных импульсов. Один импульс состоит из изменения потенциала на промежуточное значение и задержки на 5-100 мс, после которой потенциал меняется на конечное значение, которое больше начального, но меньше промежуточного. Наложение импульса потенциала на электрод в эксперименте приводит к увеличению отношения между фарадеевским током и током заряжения, поскольку первый уменьшается пропорционально 1/t1/2. Вследствие этого можно получить снижение предела определяемых концентраций. Помимо этого, ДИВА характеризуется низким значением отношения емкостного тока к фоновому. Это обусловлено двойной выборкой тока в начале и конце импульса. Потенциостат/гальваностат регистрирует разность двух токов. Для обратимой системы высота пика Δiимп на дифференциально-импульсной вольтамограмме равна
Инверсионная вольтамперометрия (ИВА) - способ снижения границы определяемых концентраций вольтамперометрического измерения, при котором до начала измерения производится предварительное концентрирование определяемого компонента из объема раствора на поверхности электрода. Концентрирование может осуществляться за счет процессов адсорбции или электроосаждения. В наших исследованиях ИВА была применена для анализа кардиомаркера тропонина I. Электроанализ наночастиц золота и серебра на поверхности рабочего электрода методами ИВА позволил разработать количественный метод регистрации этого кардиомаркера в плазме крови [6].Электроактивное покрытие электрода, т.е. поверхностная концентрация электроактивного компонента Г на электроде может быть рассчитано путем подсчета площади под вольтамперной кривой при интегрировании тока прямой развертки. Количество электроактивного вещества Г на поверхности рабочего электрода рассчитывается по закону Фарадея из циклической вольтамперограммы:
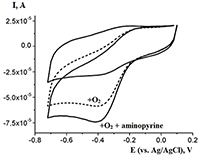
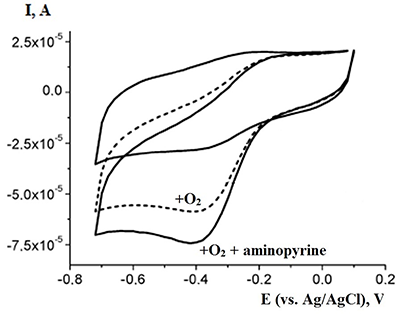
В современных потенциостатах/гальваностатах для получения и обработки результатов измерений используется соответствующее программное обеспечение. В работах по электроанализу используются различные типы электродов: как стационарные, так и 3-х контактные печатные электроды - одноразовые, промышленно выпускаемые графитовые электроды, получаемые последовательным нанесением на пластиковую основу проводящих слоев и изоляции методом трафаретной печати (ПГЭ). Размеры такого электрода 1×3 см. Выбор типа электрода определяется исследуемым биообъектом. Электроанализ каталитической активности цитохромов Р450Ферменты в качестве распознающих элементов в электрохимическом биосенсорном анализе имеют широкое распространение вследствие высокой субстратной специфичности, чувствительности, а также разработанности применения кинетических закономерностей для расчета параметров ферментативных реакций, протекающих на электроде. Цитохромы Р450 относятся к классу гемопротеинов [7]. Основная задача электроанализа этого класса ферментов – зарегистрировать процесс обратимой реакции окисления - восстановления иона железа гема в соответствии со схемой P450FeIII + e (электрон с электрода) ↔ P450FeII Взаимодействие с субстратами - кислородом и органическим соединением – выражается в увеличении восстановительного каталитического тока (рис. 2).
регистрируя каталитический ток методами вольтамперометрии или амперометрии, можно рассчитать такие важные кинетические параметры ферментативного процесса, как константу Михаэлиса (Km) и электрохимическую каталитическую константу (kcat). C помощью электрохимической формы уравнения Михаэлиса-Ментен могут быть рассчитаны кинетические параметры ферментативных реакций (Km, kcat, kcat/Km). Константа Михаэлиса определяется по электрохимической форме уравнения Михаэлиса-Ментен:
Максимальное значение каталитического тока может быть определено экспериментально по данным амперометрии при контролируемом напряжении и при насыщающей концентрации субстрата в системе. Уравнение максимального каталитического тока может быть представлено как:
Информационные параметры электроанализа позволяют рассчитать не только кинетические константы ферментативных процессов, но и охарактеризовать биоэлектрохимическую систему, определить особенности электродных процессов, электродную кинетику переноса электронов в системе электрод/фермент, определить эффективные формальные потенциалы редокс-активных компонентов, исследовать стехиометрию компонентов электродных реакций, рассчитать количество электроактивного вещества, участвующего в процессе, исследовать условия обратимости/необратимости реакций, в определенных условиях рассчитать изменение термодинамических параметров (ΔG, ΔS, ΔH), а также получить информацию о типе процесса (диффузионный или поверхностный) для исследуемого биокомпонента [1-3,10]. Электрохимические методы применяются при исследовании термодинамики ферментативного катализа изоферментов цитохрома Р450. Окислительно-восстановительный потенциал является функцией от температуры, изменения энтальпии и энтропии и может быть выражен уравнением
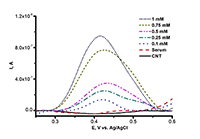
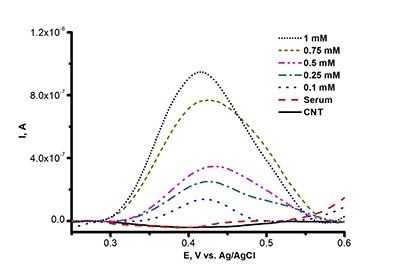
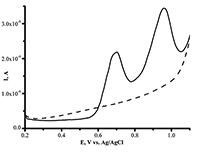
Окислительно-восстановительный потенциал гемопротеинов зависит от взаимодействия гема как с лигандами, так и с апобелком. Таким образом, определение E0Ꞌ как функции от температуры позволяет исследовать термодинамику при взаимодействии изоферментов цитохрома Р450 с лигандами (в том числе с субстратами или ингибиторами). Изменение энтальпийного фактора отражает взаимодействие между ионом железа гема и лигандами, а изменение энтропийного фактора свидетельствует о конформационной реорганизации фермента, связанной с окислительно-восстановительными процессами [9,11]. Электроанализ белков на основе окисления аминокислотных остатков Электрохимический анализ белков и пептидов, не содержащих простетических групп, может быть осуществлен с помощью реакции окисления аминокислотных остатков для решения биомедицинских задач, в частности связанных с регистрацией различных типов посттрансляционных модификаций белков [12]. В 1980 г. две независимые группы под руководством V. Brabec и J. A. Reynaud впервые показали окисление белков на твердых электродах [13,14]. Из аминокислот, входящих в состав белков, помимо Cys и Cys-Cys, удалось зарегистрировать окисление Меt, His, Тyr и Тrp. Необходимо отметить, что в отличие от Тyr, Тrp и Cys, электроокисление остатков His, Cys-Cys и Меt происходит при достаточно высоких положительных потенциалах. В реакции окисления участвуют электроактивные группы аминокислот, находящиеся на поверхности молекулы и ориентированные к поверхности электрода [15]. Модификация рабочей поверхности электрода многостеночными углеродными нанотрубками (МУНТ) существенно усиливает сигнал электроокисления аминокислот [16] (рис. 3 a,б).
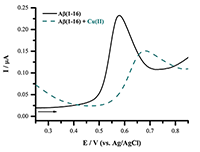
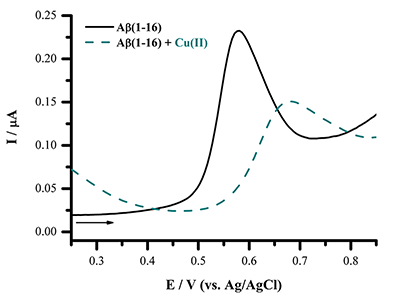
Важной областью применения реакции окисления аминокислотных остатков является процесс агрегации белков, играющий одну из ключевых ролей при нейродегенеративных заболеваниях. Ингибирование неправильного сворачивания белков в нейротоксичные олигомерные агрегаты – одна из стратегий поиска лекарственных средств для лечения данных заболеваний. Так, при болезни Альцгеймера в мозге происходит образование олигомеров и нерастворимых фибриллярных агрегатов амилоида-бета (Aβ). Aβ представляет собой растворимый нейропептид (4.5 кДа), состоящий из 38-42 аминокислотных остатков. Из электроактивных остаков, Aβ содержит три His6, His13 и His14, один Меt35 и один Тyr10. Однако, окисление остатков His и Меt требует высоких положительных потенциалов, превышающих 1 В (отн. Ag/AgCl), к тому же до сих пор не показано их окисление для Aβ. С другой стороны, единственный остаток Тyr Aβ(1-40) и Aβ(1-42), представляющих две изоформы Aβ различной длины, легко окисляется в нейтральных рН при потенциалах 0.6-0.7 В (отн. Ag/AgCl) подобно другим нейропептидам, содержащим один остаток Tyr. Прямой электрохимический подход может быть использован для мониторинга агрегации Aβ в различных условиях: в присутствии ионов Fe(II), Cu(II) и Zn(II) (Aβ(1-42), Aβ(1-16), Aβ(1-40) в присутствии сим-триазиновых производных в качестве модуляторов агрегации (Aβ(1-42)) или в присутствии пентапептида, разрушающего β-пластины, как ингибитора агрегации (Aβ(1-42)). Ионы металлов (в частности Zn(II) и Cu(II)) выполняют важную функцию в патологическом процессе агрегации, а Aβ взаимодействует с ионами металлов через метал-связывающий домен, состоящий из N-концевых аминокислотных остатков 1-16. Основываясь на измерении сигнала окисления единственного остатка Тyr10 Aβ, был разработан электрохимический экспресс-анализ комплексообразования между Aβ и ионами металлов. С этой целью был выбран водорастворимый синтетический пептид Aβ(1-16), представляющий металл-связывающий домен Aβ. Образование комплексов Aβ(1-16) с ионами двухвалентных металлов (Zn(II), Cu(II), Mg(II) и Ca(II)) было исследовано при концентрации Aβ(1-16) 5×10–5 М и при концентрации ионов металлов в области 1×10–5 – 5×10–2 М в Трис-буфере с рН от 5 до 9. Прибавление Zn(II) либо Cu(II) ионов значительно снижало пик окисления Aβ(1-16) и вызывало сдвиг потенциала пика в область более положительных значений, в то время как ионы Mg(II) и Ca(II) не оказывали какого-либо эффекта в пределах экспериментальной ошибки (рис. 4) [17].
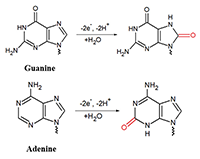
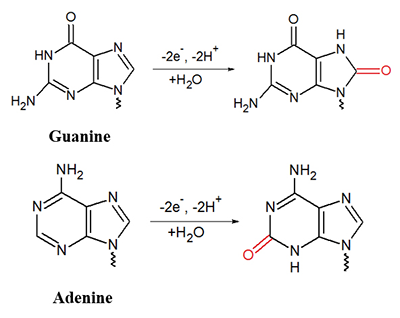
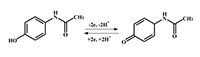
Альбумин сыворотки человека и миоглобин мышц лошади показали схожее поведение относительно тестируемых ионов металлов. Электрохимический анализ белков в области положительных потенциалов окисления аминокислот может быть применен для изучения комплексообразования других функционально значимых белков и пептидов с ионами металлов. Электрохимические методы определения ДНК В основе электрохимических методов определения концентрации нуклеиновых кислот лежит способность гетероциклических азотистых оснований, входящих в состав нуклеотидов, электрохимически окисляться на поверхности электрода. Регистрируя зависимость тока, протекающего через рабочий электрод, находящийся в контакте с электроактивным веществом, от разности потенциалов между рабочим электродом и электродом сравнения, можно получить данные о концентрации электроактивного вещества, кинетике и термодинамике электрохимической реакции. Электрохимические методы для изучения реакции переноса электронов между основаниями ДНК и ртутным электродом были впервые использованы более 50 лет назад. Тем не менее, до сих пор электрохимические методы исследования ДНК остаются актуальными и перспективными, поскольку применение современных твердых материалов для получения электродов и способов модификации электродов позволяет увеличить чувствительность методов, упростить протоколы проведения исследований, снизить их стоимость. Все гетероциклические основания, входящие в состав ДНК, пурины (аденин (А) и гуанин (G)); и пиримидины (тимин (Т) и цитозин (C)) способны электрохимически окисляться на поверхности электрода по pH-зависимому механизму [10,18] (рис. 5).
Пурины окисляются в области значительно меньших положительных потенциалов, чем пиримидины, окисление которых происходит только в сильно положительной области, что вызывает трудности при их регистрации, связанные с «окном потенциалов» используемых типов электродов. Также во многих работах было показано, что для одинаковых концентраций пуринов и пиримидинов наблюдаемые пики окисления пуринов были значительно более интенсивны. По этим причинам электрохимические методы исследования ДНК, как правило, базируются на регистрации окисления пуринов (рис. 6).
В электрохимических методах при определении концентрации двухцепочечной ДНК для расчета количества пиримидинов пользуются правилом Чаргаффа, в соответствии с которым количество тимина равно количеству аденина, а количество гуанина равно количеству цитозина (А=Т, G=C).
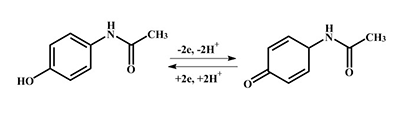
Активно разрабатываются новые углеродные наноматериалы для модификации электродов с целью снижения потенциала электроокисления гетероциклических оснований [18]. Было показано, что использование стеклоуглеродных рабочих электродов, модифицированных мезопористыми углеродными волокнами, смещает потенциал окисления по сравнению с немодифицированным электродом, что дает возможность зарегистрировать электроокисление не только пуриновых оснований А и G, но и пиримидиновых оснований Т и C [19]. Анализ лекарственных препаратов с помощью электрохимических методов Аналитические методы анализа лекарственных средств необходимы на различных стадиях дизайна новых лекарственных средств, исследовании их стабильности и контроля качества, изготовлении рецептурных форм, исследовании фармакокинетики и фармакодинамики, метаболических биотрансформаций ксенобиотиков, проведении доклинических и клинических испытаний. Высокочувствительные методы анализа необходимы в постмаркетинговом контроле качества, а также при злоупотреблении наркотическими средствами. Электроанализ и использование наноматериалов является одним из наиболее чувствительных, экономичных и информативных методов в современной аналитической химии, биохимии, фармакологии. Электроанализ лекарственных препаратов основан на реакции электроокисления/электровосстановления и регистрации амплитуды сигнала при потенциале окисления/восстановления препарата [20] (рис. 7). Алгоритм анализа лекарственных препаратов с использованием электродов, получаемых методом трафаретной печати, заключается в проведении эксперимента в горизонтальном режиме измерений, что позволяет использовать минимальное количество пробы (60 мкл анализируемого раствора).
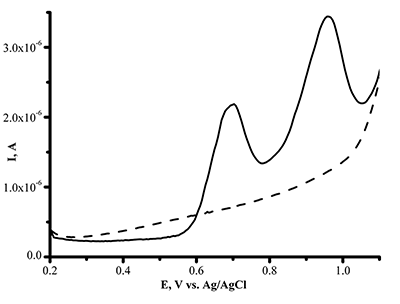
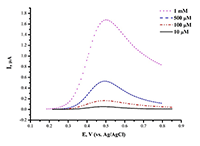
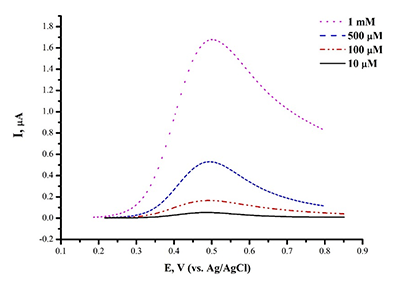
Парацетамол (ацетаминофен, N –ацетил-п-аминофенол) широко используется как жаропонижающее и обезболивающее средство [20,21]. При электроокислении ацетаминофена на немодифицированном графитовом электроде наблюдается пик при потенциале Еок=+0.51 ± 0.02 В (рис.8).
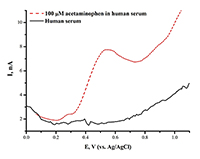
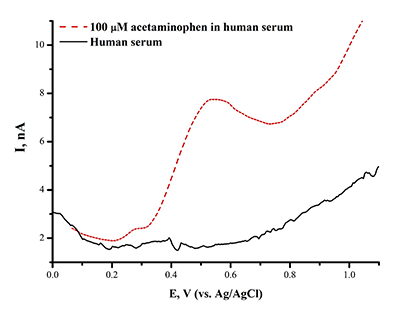
Предел определяемый концентраций для ацетаминофена составил 1.10•10-9 М. Анализ ацетаминофена в сыворотке крови дает четкий пик окисления препарата, что позволяет использовать метод в аналитических целях (рис.9). Модификация рабочей поверхности электрода дисперсиями графена, повышает чувствительность анализа в 20 раз (предел определяемых концентраций составил 5*10-11 М). Разработаны методы электроанализа диклофенака (вольтарен) Еок= 0.56 ± 0.02 В; ибупрофена (Еок= +1.20± 0.05 В) с использованием ПГЭ, модифицированных дисперсиями углеродных наноматериалов (МУНТ, графен). Исследуемые лекарственные препараты являются субстратами цитохромов Р450, поэтому такой подход является комплементарным для регистрации каталитической активности цитохромов Р450. Рассмотрены принципы, методы и возможности электроанализа различных классов биологически активных соединений, а также пути от электрохимических данных к кинетике электрокатализа (таблица 1).
БЛАГОДАРНОСТИ Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-04-00374 и Программы фундаментальных научных исследований государственных академий наук на 2013—2020 гг. ЛИТЕРАТУРА
|