К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ Рисунок 6 Действие тетраэтиламмония (ТЭА) и 4-аминопиридина (4-АП) на хлорный ток. Таблица 1 Ионный состав растворов.
|
Свойства кальций-активируемых хлорных токов в нейронах Пуркинье Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: vzam@yandex.ru Ключевые слова: метод patch-clamp; клетки Пуркинье мозжечка; кальций-активируемый хлорный ток; тетраэтиламмоний; 4-аминопиридин; нифлуминовая кислота DOI: 10.18097/BMCRM00034 ВВЕДЕНИЕ Кальций-активируемые хлорные токи являются хорошо исследованным объектом в различных органах и тканях млекопитающих: эпителиальных и секреторных клетках, клетках гладкой мускулатуры, в частности гладкой мускулатуры кровеносных сосудов, интерстициальных клетках Кахаля и др. [1]. Однако в центральных нейронах млекопитающих они обнаружены сравнительно недавно, и их исследованию посвящены немногочисленные работы. В то же время, их роль в регуляции синаптической передачи между центральными нейронами, особенно в гиппокампе, вероятно, весьма значительна, и они могут модулировать когнитивные процессы [2]. Однако применяемые до сих пор методические приемы для их исследования позволяли регистрировать хлорные токи только очень маленькой амплитуды и длительности, что существенно затрудняло проведение их фармакологического изучения. Целью данной работы была разработка методов, способных обеспечить полноценное фармакологическое исследование кальций-зависимых хлорных токов в нейронах ЦНС млекопитающих, а также изучение их свойств. МАТЕРИАЛЫ И МЕТОДЫ Электрофизиология Исследования осуществляли электрофизиологическим методом на свежевыделенных нейронах Пуркинье из мозжечка самцов крыс линии Вистар 12–15 дневного возраста (30 животных). Выделение единичных нейронов проводили ферментно-механическим способом [3]. Трансмембранные токи отдельных нервных клеток регистрировали методом локальной фиксации потенциала (patch-clamp) в конфигурации на целой клетке (whole-cell) с помощью прибора EPC-9 («HEKA», Германия) [4]. Данные обрабатывали при помощи программы Pulsfit («HEKA»). Деполяризующие ступени длительностью 10 мс подавали от холдингового потенциала –70 мВ с шагом +10 мВ. После прорыва мембраны клетки и стабилизации ответов клетки (2–3 мин) снимали два контрольных ответа, после чего добавляли раствор, содержащий блокатор. При исследовании действия ТЭА и 4-АP начинали работу с каждой клеткой с самой низкой концентрации. Для проведения экспериментов использовались внешние и внутрипипеточные растворы с ионным составом, указанным в таблице 1. Для растворов Н1, Н2, Н3, Н4, H5 (рН = 7.36) осмолярность составляла 310–320 мОсм. Для растворов В1, В2 (рН = 7.2) осмолярность составляла 280–290 мОсм. В растворы Н1, Н2, Н3, Н4 перед экспериментом добавляли 15 мМ глюкозы. Растворы с ТЭА и 4-АР готовили непосредственно перед экспериментом из маточных растворов (100 мМ) разведением в растворе Н2. Все реактивы приобретены у компании «Sigma-Aldrich» (США).
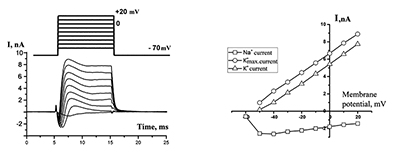
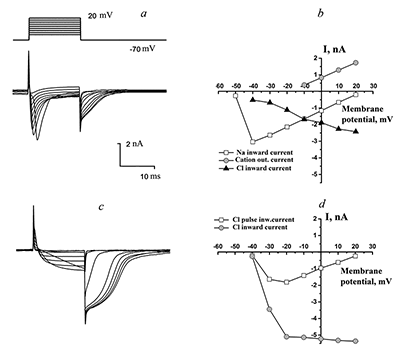
РЕЗУЛЬТАТЫ В «квазифизиологических» условиях (снаружи физиологический раствор Н1, в микропипетке-электроде — раствор В1) регистрировали ионные токи от целой клетки (рис. 1), состоящие из токов положительной и отрицательной полярности. Такие ответы соответствуют классическим исследованиям и составляют основу потенциала действия — быстрый, входящий в клетку ток ионов натрия, вызывающий деполяризацию мембраны, и выходящие токи, переносимые ионами калия, компенсирующими деполяризацию на мембране.
Однако этот ответ существенным образом менялся при замене в наружном растворе ионов Na+ на эквимолярное количество ионов ТРИС+ (рис. 2). Входящий натриевый ток исчезал, выходящий калиевый ток сохранялся с примерно той же амплитудой, а по окончании деполяризующего импульса появлялся «хвостовой» ток со сравнительно быстрой инактивацией. При мембранном потенциале +20 мВ величина τ50 составляла 4.61 мс (SD = 2.6 мс; n = 28). Потенциал активации «хвостового» тока составлял –57.1 ± 9.5 мВ (n = 31).
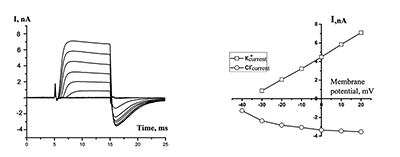
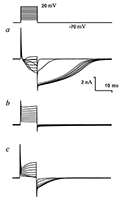
Для того чтобы определить, какой ион является носителем заряда «хвостового» тока, использовали различные внешние растворы (Н4, Н5). Состав растворов приведён в таблице. При подаче наружного раствора, не содержащего ионов натрия и хлора (раствор Н4, таблица 1), токи входящего направления исчезали полностью (рис. 3). При подаче раствора Н5 амплитуда этого тока уменьшалась, что указывает на участие ионов хлора в переносе заряда этим током и, следовательно, ток идет в выходящем направлении (из клетки во внешнюю среду).
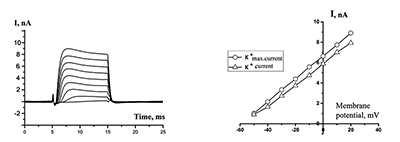
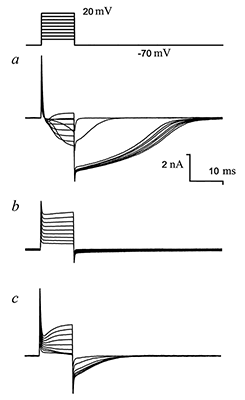
Во второй серии экспериментов использовали в пипетке раствор В2, содержащий 120 мМ ионов Cs+ вместо ионов K+. В таких условиях «хвостовой» ток появлялся даже при высокой (140 мМ) концентрации ионов Na+ с наружной стороны мембраны клетки (рис. 4, a,c). При замене стандартного раствора (раствор Н1) на раствор, не содержащий ионы Na+ (раствор Н2), происходило существенное увеличение амплитуды «хвостового» тока и его τ50 (рис. 4, b,d). Потенциал активации «хвостового» тока составил –65 ± 9 мВ (n = 12). Для этого тока при потенциале на мембране +20 мВ величина τ50 составила 5.46 ± 2.41 мс (n = 19). На рисунке 4, b видно, что при действии деполяризующих импульсов также активируется ток («внутриимпульсный»). Активация тока начиналась при –50 мВ на мембране и до –40 мВ ток имел ту же амплитуду, что и послеимпульсный «хвостовой» ток. Однако начиная со значения +30 мВ на этот «внутриимпульсный» ток накладывается активация выходящего катионного тока, придавая его вольтамперной характеристике колоколообразную форму (см. рис. 4, d).
При замене наружного раствора Н1 на безнатриевый раствор Н2 (в пипетке раствор В2) ответ клетки на ступенчатую деполяризацию существенным образом менялся. Исчезал входящий натриевый ток. «Внутриимпульсный» ток увеличивался по амплитуде, однако начиная с –30 мВ его амплитуда, как и в варианте с наружным раствором Н1, содержащим натрий, уменьшалась. Выходящий ток, переносимый ионами цезия, проходил, по-видимому, через низкоселективные калиевые каналы и/или через катионные каналы и маскировал «внутриимпульсный» ток. «Хвостовой» ток в этих условиях значительно увеличивался по амплитуде — на 27–290% с ΔIсред. = 87% (n = 11). На 5 клетках наблюдалось уменьшение амплитуды на 11–63% с ΔIсред. = –34%. При этом на всех клетках кинетика инактивации тока замедлялась: τ50 = 15.51 ± 13.13 мс (n = 16) при 20 мВ на мембране. Потенциал активации «хвостового» тока в этих условиях составил –57 ± 8 мВ (n = 16). Аппликация раствора Н2, содержащего нифлуминовую кислоту в концентрациях 25 мкм (n = 3) и 100 мкм (n = 5), приводила соответственно к ~80% и 100%-ной блокаде как деполяризующих токов во время импульса, так и «хвостовых» токов, по окончании каждой деполяризующей ступени (рис. 5).
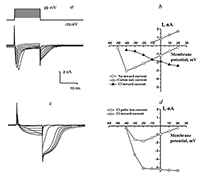
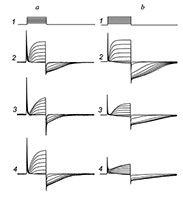
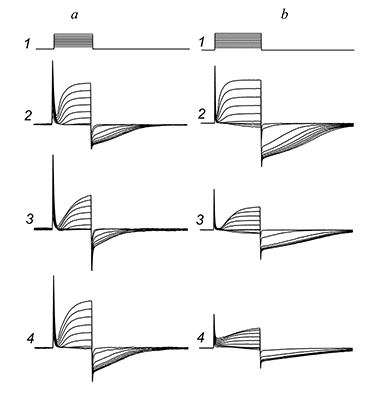
При подаче наружного раствора Н3, в котором отсутствовали свободные ионы Ca2+ (в присутствии 1.1 мМ EGTA), «хвостовой» ток исчезал почти полностью. В модели, предложенной авторами работы [5], кальций-чувствительные рецепторы хлорных каналов расположены в мембране рядом с кальциевыми каналами, активируясь при входе в клетку ионов кальция с наружной стороны мембраны. С учетом данной модели описываемый хлорный ток является кальций-активируемым (далее в тексте сокращенно СаСС). Для выделения СаСС без наложения на них ответов калиевых токов были применены известные блокаторы калиевых каналов — тетраэтиламмоний (ТЭА) и 4-аминопиридин (4-АП). В ходе исследований оказалось, что оба вещества блокируют не только выходящие калиевые токи, но и исследуемые выходящие СаСС (рис. 6).
Эффект блокирующего действия ТЭА на СаСС и выходящий калиевый токи имел дозо-зависимый характер (рис. 6,a), и «быстро отмывался» на 80–100% для всего диапазона исследованных концентраций (от 50 мкМ до 10 мМ) (n = 16). Начиная с концентрации 100 мкМ блокирующее действие 4-АП на СаСС и выходящие калиевые токи уже было практически необратимым (рис. 6,b): выходящие калиевые токи и входящие хлорные токи не восстанавливались при отмывке (n = 11). Значение IC50 для действия ТЭА на СаСС составило 130 мкМ (n = 16), для 4-АР — 110 мкМ (n = 6). Поскольку нифлуминовая кислота, ТЭА и 4-АП в одинаковой степени блокировали «внутриимпульсные» и «хвостовые» токи, можно предположить, что в обоих случаях мы имеем дело с СаСС. Просто в первом случае их активацию вызывает нарастающая деполяризация при подаче очередного импульса, а во втором — сброс потенциала на мембране с текущего уровня деполяризации до уровня потенциала холдинга (–70 мВ). Таким образом, в представленной работе убедительно доказано наличие кальций-активируемого хлорного тока в нейронах Пуркинье. ОБСУЖДЕНИЕ Проведенные исследования впервые показали, что амплитуда и кинетика исследованных кальций-активируемых хлорных токов существенно зависит от наличия во внешнем растворе ионов натрия. Удаление ионов натрия приводит к существенному увеличению амплитуды этих токов, а также увеличивает время нахождения их в открытом состоянии. Амплитуда и кинетика СаСС зависят от того, какой ион преобладает с внутренней стороны мембраны (калий или цезий). Все это указывает на то, что в регуляции работы кальций-активируемых хлорных каналов возможную роль играют Na+–K+/Cl– белки-переносчики, которые, как известно, участвуют не только в регуляции клеточного объема и прямом транспорте ионов через мембрану [6], но и в секреции калия и регуляции внутриклеточной концентрации ионов Cl– в нейронах [7]. Можно предположить, что как и в случае нейронов гиппокампа [8], этот ток может играть значительную роль в регуляции возбудимости и передачи синаптического сигнала в нейронах Пуркинье. Полученные результаты показали, что применение описанных выше методических приемов (безнатриевый внешний раствор, цезиевый внутрипипеточный раствор) делает СаСС удобным объектом для исследования фармакологического воздействия на них. В представленной работе показано, что известные блокаторы калиевых каналов ТЭА и 4-АП способны эффективно блокировать СаСС с наружной стороны мембраны в нейронах Пуркинье. Блокирующий эффект для ТЭА с внутренней стороны мембраны ранее показали Sanchez и Blatz [9] на нейронах коры крыс. Принимая во внимание, что этот тип токов присутствует в клетках многих тканей организма, включая нейроны ЦНС и мышечные клетки, установленный факт блокады ТЭА и 4-АП кальций-зависимых хлорных токов должен учитываться при дальнейших исследованиях. Особенно важно его учитывать при разработке лекарственных препаратов на основе 4-АП и его аналогов, поскольку блокада СаСС может существенно влиять на частоту генерации потенциалов пейсмекерными клетками в организме. БЛАГОДАРНОСТИ Работа выполнена по теме 48.8. «Поиск и исследование механизмов действия нейропротекторов и стимуляторов когнитивных функций» в рамках Государственного задания ИФАВ РАН (тема по ГЗ № 0090-2017-0019). ЛИТЕРАТУРА
|