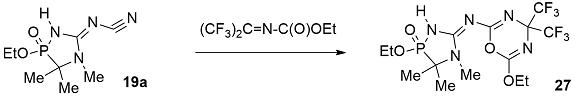К 40-летию Института физиологически активных веществ РАН
|
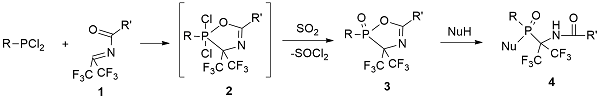
Фторсодержащие α-аминоалкилфосфорильные соединения. Синтез, химические свойства и биологическая активность Институт физиологически активных веществ Российской академии наук 142432, Московская обл. Черноголовка, Северный проезд, 1; *e-mail: alaks@ipac.ac.ru Ключевые слова: α-аминофосфонаты; имины полифторкетонов; диазафосфолы; фосфораны; цианогуанидины, биологическая активность DOI: 10.18097/BMCRM00036 ВВЕДЕНИЕ Фосфоновые кислоты и их производные, в частности α-аминоалкилфосфоновые, многие годы привлекают внимание с точки зрения их биологической активности как био-изостерных аналогов природных аминокислот [1]. Введение в структуру аминофосфонатов атомов фтора или фторированных заместителей зачастую приводит к существенному изменению химических и физических свойств, а также спектра проявляемой биологической активности. В связи с этим, разработка методов синтеза фторсодержащих α-аминофосфонатов продолжает оставаться актуальной [2]. В данном обзоре представлены полученные нами данные по синтезу фторсодержащих α-аминофосфонатов на основе доступных фосфорорганических (гидрофосфорильные соединения, различные фосфиты) и фторорганических (гексафторацетон, метилтрифторпируват, перфтор-2-азапропен) соединений и изучению химических свойств и биологической активности полученных фторсодержащих α-аминоалкилфосфорильных соединений. 1. СИНТЕЗ И ХИМИЧЕСКИЕ СВОЙСТВА Синтез фторсодержащих α-аминоалкилфосфорильных соединений предполагает два основных подхода: 1) формирование α–аминоалкилфосфорильного фрагмента из фосфорорганических и фторорганических прекурсоров; 2) введение атомов фтора или фторированных заместителей в уже существующие α-аминоалкилфосфорильные соединения. Для формирования α–аминоалкилфосфорильного фрагмента наиболее подходящими были реакции иминов полифторкетонов с соединениями трехвалентного фосфора как трехкоординированного λ3P(III), проходящие через стадию образования фосфоранов, так и четырехкоординированного λ4P(III) путем присоединения гидрофосфорильных соединений по C=N-связи. Так, в результате реакции [1+4]-циклоприсоединения иминов гексафторацетона 1 с дихлорфосфитами в среде SO2 образуются 1,4,2-оксазафосфолы 3, которые в дальнейшем мягко раскрываются различными нуклеофилами по внутримолекулярной Р-О-связи с образованием соответствующих α–аминофосфонатов и α–аминофосфинатов 4 [3-5].
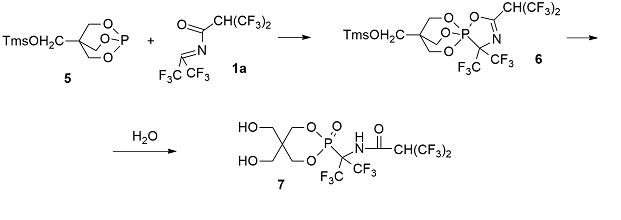
R = Alk, AlkO; R' = Alk, AlkO, Ar; Nu = AlkO, AlkNH, ArNH Аналогичным образом был синтезирован новый эффективный ингибитор пиримидинфосфорилазы 7 из бициклического фосфита 5 и α–гидрогексафторизобутирилимина гексафторацетона 1a [6]. В данном случае при гидролизе раскрываются два цикла образовавшегося фосфорана 6: как 1,4,2-оксазафосфолиноый, так и 1,2-оксафосфоринановый.
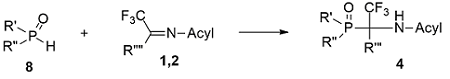
Присоединение PH-соединений 8 по C=N-связи иминов полифторкетонов 1,2 с образованием аминофосфонатов 4 протекает в большинстве случаев легко, однако легкость присоединения зависит от нуклеофильных свойств атома фосфора гидрофосфорильных соединений и электрофильности C=N-связи иминов. Так, дифенилфосфонистая кислота и О-алкилметилфосфониты экзотермично реагируют с ацилиминами гексафторацетона и метилтрифторпирувата [7,8], в то время как для завершения реакции последних с диалкилфосфитами требуется длительное нагревание реакционной смеси при 70 - 80°С [9-11]. Имин гексафторацетона, обладающий наименее электрофильной C=N-связью, легко присоединяет дифенилфосфонистую кислоту, для реакции с метилалкилфосфонитами уже необходимо нагревание в запаянной ампуле, а продукты взаимодействия с диалкилфосфитами получены не были [12,13].
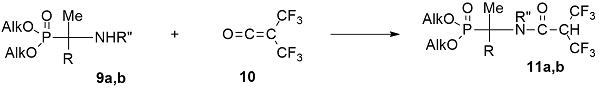
R' = Me, Ph, AlkO; R''' = CF3, C(O)OAlk R'' = Ph, AlkO; Acyl = Alk(O), AlkOC(O), ArC(O), HetC(O), ArSO2 Присутствие в α-положении аминоалкилфосфорильных соединений двух трифторметильных групп существенно увеличивает длину Р-С-связи [11,13,17], что, в свою очередь, оказывает влияние на химические и биологические свойства подобных соединений. Была показана легкая гидролизуемость Р-С-связи в 1-ацетиламино-1,1-бис(трифторметил)метилдифенилфосфиноксиде [14] и 1-фенилсульфониламино-1,1-бис(трифторметил)метилфосфонате [16] и установлено, что подобные фторированные аминофосфонаты необратимо ингибируют различные ферменты, по-видимому, в результате легкого разрыва Р-С-связи и образования ковалентной связи остатка α-аминофосфоната с активным центром эстераз (см. Биологическую активность). Легкодоступные α-аминоалкилфосфонаты 9, получаемые по реакции Кабачника-Филдса из диалкилфосфотов, метилалкилкетонов и аммиака или метиламина, были выбраны для реализации подхода к синтезу фторсодержащих α-аминоалкилфосфорильных соединений путем введения атомов фтора или фторированных заместителей в уже существующие соединения с P-C-N остовом. α-аминоалкилфосфонаты 9a,b экзотермично реагируют с бис(трифторметил)кетеном, образуя соответствующие фторированные N-ацил-α-аминоалкилфосфонаты 11a,b [18]. Полученные аминофосфонаты 11a,b являются как обратимыми, так и необратимыми ингибиторами ацетил- и бутирилхолинэстераз, а также сериновых протеиназ при экспрессии рекомбинантного проинсулина [19].
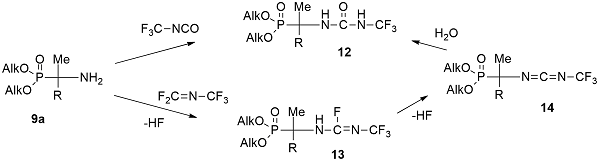
R'' = H (a), Me (b) Аминоалкилфосфонаты 9a экзотермично реагируют с трифторметилизцианатом, образуя соответствующие трифторметилмочевины 12 [20], и с перфтор-2-азапропеном, образуя фосфорилированные трифторметилфторамидины 13 [21]. Дальнейшее дегидрофторирование фторамидинов 13 приводит к образованию фосфорилированных трифторметилкарбодиимидов 14 [22], которые легко присоединяют молекулу воды с образованием известных трифторметилмочевин 12 [20] (формула 5).
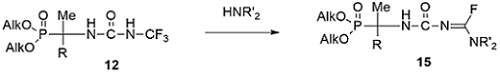
Синтезированные таким образом фторсодержащие α-аминоалкилфосфорильные соединения 12-14 были интересны с точки зрения превращений фторсодержащих фрагментов при взаимодействии с различными нуклеофилами, в качестве которых были выбраны аммиак и амины. При взаимодействии трифторметилмочевин 12 с вторичными аминами после дегидрофторирования трифторметильной группы следовало замещение только одного атома фтора в образующейся дифторметиленовой группе с образованием фторамидинов 15, отличительной особенностью которых по данным рентгеноструктурного анализа (РСА) являлся эффект F--сверхсопряжения [23,24].
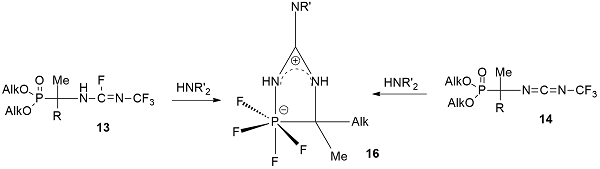
Результатом взаимодействия фосфорилированных трифторметилфторамидинов 13 и карбодиимидов 14 неожиданно оказались соединения гексакоординированного фосфора 16 - 5-диалкиламино-2,2,2,2-тетрафтор-1,4,2-диазафосфоратолы [25-29]. Полученные фосфоратолы 16 были первыми нейтральными моноциклическими фосфоратами со связью Р-С в цикле, а метод, которым они были получены, является нетрадиционным для синтеза фосфоратов. По-видимому, образование фосфоратолов протекает через образующийся фосфорилированный трифторметилгуанидин, трифторметильная группа которого полностью фторирует атом фосфора с одновременным замыканием цикла.
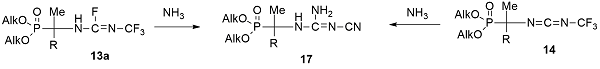
Взаимодействие фосфорилированных трифторметилфторамидинов 13a и карбодиимидов 14 с аммиаком приводит к образованию цианогуанидинов 17 в результате присоединения молекулы аммиака по двойной C=N-связи с последующим полным дегидрофторированием трифторметильной группы [30]).
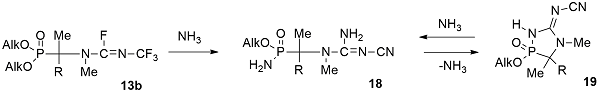
В отличие от фосфорилированных трифторметилфторамидинов 13a их N-метилированный аналог 13b взаимодействует с аммиаком с образованием цианогуанидина 18, который обладает амидоэфирной группой в фосфорильной части молекулы [32,33]. По-видимому, промежуточный трифторметилгуанидин фторирует атом фосфора до фторангидрида, который в избытке аммиака замещается на аминогруппу. Амидоэфир 18 при кипячении в ацетонитриле элиминирует аммиак, образуя 1,4,2-диазафосфол 19. Диазафосфол 19 легко раскрывается в жидком аммиаке с образованием исходного амидоэфира 18.
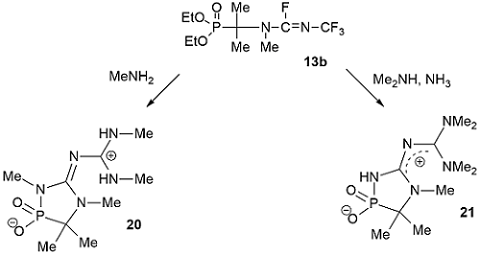
В результате взаимодействия фосфорилированного трифторметилфторамидина 13b с метиламином образуется 1,4,2-диазафосфол 20, имеющий цвиттерионную структуру [34]. Молекулярная структура 1,4,2-диазафосфол 20 была однозначно подтверждена РСА, который был выполнен для ацетонитрильного полусольвата моногидрата полученного цвиттериона [35]. При выдерживании трифторметилфторамидина 13b в спиртовом растворе аммиака и диметиламина (1:1) с высоким выходом образуется цвиттерионный 1,4,2-диазафосфол 21, структура которого также была подтверждена РСА [36].
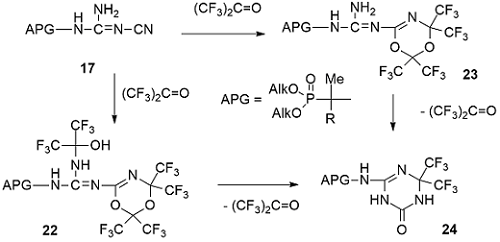
Фосфорсодержащие цианогуанидины 17 и 19, обладающие нуклеофильной цианогруппой и аминогруппой гуанидина, представляли интерес для дальнейшей модификации фторсодержащими электрофильными реагентами, такими как гексафторацетон и его ацилимины. Так, фосфорсодержащие цианогуанидины 17 легко реагируют с гексафторацетоном с образованием соответствующих 1,3,5-диоксазинов 22 и 23 в зависимости от количества эквивалентов гексафторацетона, которые при 20ºС медленно или при кипячении в бензоле быстро элиминируют гексафторацетон с образованием 1,3,5-триазинонов 24 [35]. Представленная молекулярная структура 1,3,5-триазинонов 24 была однозначно подтверждена выполненным РСА, который исключил альтернативную структуру 1,3,5-триазинонов по положению внутрициклической C=N-связи [38] .
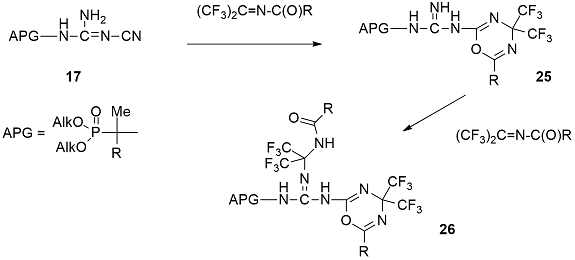
При взаимодействии фосфорсодержащие цианогуанидинов 17 и 19a с иминами гексафторацетона первоначально образуются продукты реакции [2+4]-циклоприсоединения – 1,3,5-оксадиазины 25 и 27. В данном случае цианогруппа фосфонатов 17 и диазафосфола 19а реагирует в качестве донорного диенофила, а имины гексафторацетона в качестве электрофильных гетеродиенов [39,40]. Дальнейшее присоединение иминов гексафторацетона протекает по иминному атому азота гуанидинового фрагмента с образованием 1,3,5-оксадиазинов 26 [39] .
2. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ Значительная часть синтезированных фторсодержащих α-аминоалкилфосфорильных соединений была исследована в качестве ингибиторов эстераз различного происхождения и функций. N-Гексафторизобутирил-α-аминоалкилфосфонаты 11a,b оказались необратимыми ингибиторами ацетил- и бутирилхолинэстераз. Анализ кинетики ингибирования активности ферментов позволил сделать предположение об инактивации ферментов как результата фосфорилирования эстеразного центра за счет разрыва Р-С-связи фосфонатов [18]. Полученный результат дал основание предложить малотоксичные для микроорганизмов α-аминоалкилфосфонаты 11a для блокирования активности сериновых протеиназ культуральной среды при экспрессии рекомбинантного проинсулина. Добавление фосфоната 11a (Alk = R = Et, R” = H) в ходе культивирования штамма B. Subtilis AJ73 не замедляло рост штамма, но заметно снижало деградацию проинсулина - целевого продукта процесса - протеиназами культуральной жидкости [19]. Как было показано выше, присутствие в α-положении аминоалкилфосфорильных соединений двух трифторметильных групп существенно увеличивает длину и этим облегчает разрыв Р-С-связи, что приводит к образованию ковалентной связи остатка α-аминофосфоната с активным центром различных ферментов. Так дифенилфосфиноксид и циклический фосфонат, гескафторбутирилимина гексафторацетона, эффективно ингибируют пиримидинфосфорилазу [6] и α-тромбин, а α-аминофосфонаты и –фосфинаты, полученные из алкоксикарбонил- и трифторацетил- иминов гексафторацетона проявили активность в отношении ацетилхолинэстеразы [9]. Комплексное исследование по взаимодействию сериновых гидролаз с О,О-диалкил-1-фенилсульфониламино-1,1-бис(трифторметил)метилфосфонатами показало, что ингибирование четырех исследованных эстераз действительно протекает через фосфорилирование активного центра с разрывом Р-С-связи аминофосфонатов, которые являются новым типом ингибиторов ферментов [16,17]. В Табл. 1 суммирована биологическая активность фторсодержащих α-аминоалкилфосфорильных соединений, представленных в данном обзоре.
ЗАКЛЮЧЕНИЕ Нами показаны возможности синтеза фторсодержащих α-аминофосфонатов на основе доступных фосфорорганических и фторорганических соединений формированием α–аминоалкилфосфорильного фрагмента из фосфорорганических и фторорганических прекурсоров и введением атомов фтора или фторированных заместителей в уже существующие α-аминоалкилфосфорильные соединения. Ряд синтезированных фторсодержащих α-аминофосфонатов проявил ингибирующее действие в отношении α-тромбина, различных сериновых гидролаз, пиримидинфосфорилазы, проявляя свойства антикоагулянтов, нейропротекторов и противоопухолевых препаратов. Изучение химических свойств и биологической активности полученных фторсодержащих α-аминоалкилфосфорильных соединений указывает на их перспективность для развития фосфорорганической, фторорганической и медицинской химии. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Государственного задания 2018 года (тема № 0090-2017-0023). ЛИТЕРАТУРА
|