К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ |
Анализ иммунохимических показателей при вертеброгенном болевом синдроме
Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1,
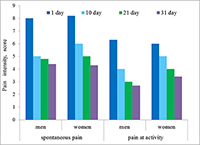
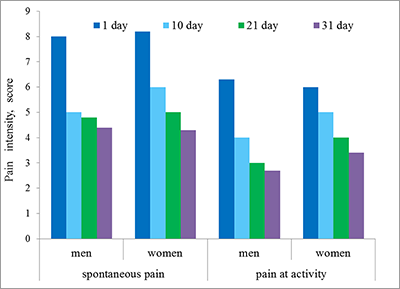
*e-mail: annalevashova3@gmail.com Ключевые слова: карбоксилэстеразы; пролекарства; лекарства со сложноэфирными группами; ингибиторы; полифторалкил-2-имино-1,3-дионовый скаффолд DOI: 10.18097/BMCRM00039 ВВЕДЕНИЕ Боль в спине – это серьезная медицинская и социально-экономическая проблема, с которой сталкиваются 60–90% населения. Болевой синдром является второй по частоте причиной временной нетрудоспособности и пятой по частоте причиной госпитализации. Распространенность хронической боли в спине (ХБС) составляет от 24% до 56.7% [1]. Однако боль — это субъективный феномен, и выраженность боли не всегда прямо связана с интенсивностью ноцицепции – нейрофизиологическим механизмом передачи болевого импульса [2]. При диагностике хронической боли и выборе методов лечения врачи сталкиваются с фактором субъективности в оценке боли пациентом, особенно выраженном при хроническом болевом синдроме (ХБС) [3]. На индивидуальное восприятие боли влияют пол, возраст, социальные факторы, условия или обстоятельства, при которых возникла боль, психологическое состояние человека и др. [4]. Мужчины и женщины по-разному описывают боль [5]. Мужчины концентрируются на стратегии решения проблемы, женщины фокусируются на межличностных и социальных аспектах, в их поведении прослеживаются тенденции к катастрофизиции БС [5]. Над решением проблемы объективизации оценки БС работают специалисты различных областей. В настоящее время основными методами оценки боли являются субъективные методы – разнообразные опросники, основанные на оценке боли самим пациентом [6]. В связи с этим разрабатываются методы, повышающие объективность оценки БС и позволяющие проводить оценку ноцицептивного компонента боли. Перспективными являются методы определения биохимических показателей. Во многих исследованиях установлено, что в проведении и ингибировании болевого сигнала участвует огромное количество биологических активных молекул, которые принадлежат к различным системам организма [7,8]. В торможении болевого импульса основную роль играет опиоидергическая система. Показано, что уровень опиоидных пептидов (ОП): β-эндорфина, орфанина и др. существенно изменяется при ХБС [9-11]. Хронической боли часто сопутствуют тревожные расстройства и депрессия [12], так как они связаны общими механизмами патогенеза [12]. В частности, существенную роль в патогенезе ХБС и депрессии играет дефицит биогенных аминов (БА): серотонина (5-НТ), дофамина, норадреналина [12,13]. Это связывают с гиперактивностью гипоталамо-гипофизарно-надпочечниковой системы [12]. Изменения в продукции биологически активных молекул влияют на состояние гомеостаза и отражаются на уровне факторов гуморального иммунитета – естественных антителах (е-Ат), которые в норме присутствуют в организме всех здоровых лиц [14] и являются своеобразным «зеркалом» индивидуального молекулярно-клеточного состава организма. При патологии изменяются индивидуальные профили сывороточного содержания е-Ат соответствующей направленности [14]. В частности, при дорсалгии достоверно изменяется уровень е-Ат к некоторым регуляторам боли [15]. Также обсуждается уровень е-Ат к нейромедиаторам антиноцицептивной системы усиления и хронизации ХБС [16]. В данной работе проведено детальное исследование иммунологических показателей (е-Ат) у больных с хроническим вертеброгенным болевым синдромом в динамике, а также проведен мониторинг интенсивности боли модифицированным субъективным методом – по дифференциальной визуально-аналоговой шкале (ВАШ) с целью выяснения роли е-Ат к эндогенным регуляторам БС: ОП – β-эндорфину и орфанину и БА – серотонину и дофамину и сравнения показателей двух методов. МАТЕРИАЛЫ И МЕТОДЫ В исследование было включено 189 пациентов (88 мужчин и 101 женщина), средний возраст 46.5±11.7 лет, имеющих в анамнезе ХБС и госпитализированных с острой болью в спине. Контрольную группу составили 44 пациента, не имеющих ХБС. Критерии включения: сильная боль в пояснично-крестцовом отделе, с интенсивностью не менее 6 баллов по ВАШ в каком-либо из функциональных состояний; отсутствии тяжелых сопутствующих соматических, неврологических или психических заболеваний. Критерии исключения: наличие объёмных образований, системные заболевания (болезнь Бехтерева и т.д.), инфекционные заболевания, травмы. Оценку степени выраженности боли проводили методом опроса по дифференциальной шкале интенсивности боли. Лечение проводили по следующей схеме: диклофенак 75 мг 3 мл внутримышечно (первые 5-7 дней), затем применяли таблетированные формы 75 мг 1 р/день после еды, мидокалм 50 мг 3 р/день, витамин В12 1000 мкг 1 р/день (14 дней). Измерение всех показателей проводили в день госпитализации, в 1 день (1 этап), на 10 день (2 этап), 21 день (3 этап) и 31 день наблюдений. Определение уровней е-Ат к эндогенным биорегуляторам в сыворотке крови (β-эндорфину, орфанину, серотонину и дофамину) проводили методом твердофазного иммуноферментного анализа (ИФА), описанного в работе [17]. Синтез конъюгированных антигенов осуществляли по методике, разработанной нами ранее [17]. У исследуемых лиц осуществляли забор 5 мл венозной крови натощак. Пробирки с кровью помещали в термостат на 30 мин при температуре 37ºС, либо оставляли на 18 ч при температуре 4ºС и далее центрифугировали при 3000 об. в течении 5 мин (центрифуга Centrifuge CM-6M, “ELMI Ltd”, Латвия). Полученные образцы хранили до момента тестирования. Статистическую обработку данных проводили с помощью программы «Statistica 6.0». Для оценки эмпирических распределений полученных данных использовали критерий нормальности. В случае нормального распределения признаков значимость их различий в группах определяли с помощью t-критерия Стьюдента. Для распределений, отличающихся от нормального, использовали таблицы сопряженности с применением критерия χ². Достоверными считали различия между группами при р <0.05. Для описания степени отклонения от нормы исследуемых показателей (е-Ат) у пациентов были рассчитаны М (медианное значение) и SD (среднеквадратичное отклонение) по данным контрольной группы для каждого эндогенного биорегулятора (ЭБ). В качестве нормальных значений уровня антител к эндогенным биорегуляторам считали интервал М ± SD. К пониженным показателям относили значения ниже значения М – SD. Повышенные значения находились в интервале от (М + SD) до (М + 3SD), к высоким относили значения, превышающие значение М + 3SD. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В ряде исследований показано, что в восприятии и вербальной оценке боли существуют гендерные различия [4,5]. Поэтому в нашем исследовании пациенты были разделены на мужскую и женскую группы, и мониторинг и анализ показателей производился раздельно. Классическим и наиболее распространенным методом оценки выраженности боли является самотестирование по ВАШ. В нашем исследовании была применена усовершенствованная – дифференциальная ВАШ. Применение этой шкалы позволяет повысить точность оценки, анализируя показатели в различных функциональных состояниях: при активности (выполнение обычных действий в виде ходьбы, наклонов, приседаний и т.д.), в покое (нахождение в положении лёжа или сидя в дневное время), ночью при пробуждении от боли, при её внезапном возникновении (при минимальном движении или в покое). Результаты динамического исследования интенсивности боли по дифференциальной ВАШ представлены на рисунках 1 и 2. При изучении дифференциальных компонентов БС на 1 этапе обнаружено, что наиболее интенсивной является боль при спонтанном возникновении, 6-9 баллов у мужчин и 6-10 баллов – у женщин. При движении интенсивность боли была несколько ниже 4-7 баллов у мужчин и 5-7 баллов – у женщин. К концу периода наблюдения (через 31 день) только 38% мужчин и 32% женщин сообщили об отсутствии спонтанной боли и 23% мужчин и 20% женщин – об отсутствии боли при активности.
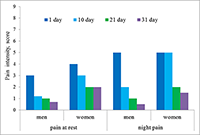
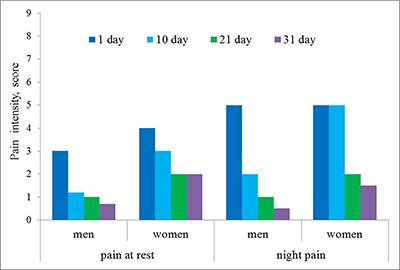
Существенно менее выражена боль в покое и ночью. Показатели составили, в среднем, 1-5 баллов у мужчин и 2-6 баллов у женщин в день поступления в стационар. Около половины всех больных не испытывали боль в покое и ночью на 4 этапе. Сравнение выраженности боли между гендерными группами показало, что интенсивность болевого синдрома статистически не различалась как при поступлении, так и при выписке. Однако на 10-й день у мужчин показатели интенсивности были достоверно ниже, чем у женщин (р<0.05). В настоящее время антитела к нейромедиаторам рассматривают как фактор обратной связи взаимодействия нервной и иммунной систем [16]. Иммунная система может влиять на ноцицепцию и антиноцицепцию через е-Ат к нейромедиаторам, участвующим в регуляции болевого импульса. Однако роль таких антител в болевом процессинге изучена недостаточно. Нами было проведено определение уровней антител к медиаторам опиодной группы – β-эндорфину и орфанину, и биогенным аминам – серотонину и дофамину. Сравнительный анализ показателей е-Ат в сыворотке крови пациентов и в контрольных группах показал (табл. 1), что у пациентов, как мужчин, так и женщин, уровни всех исследуемых антител в среднем (медианные значения) статистически значимо выше, чем показатели в контрольных группах. Это позволило проводить дальнейшее исследование профилей антител больных с целью выявления тенденций и закономерностей.
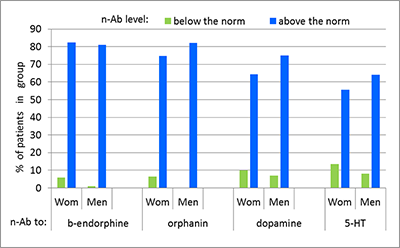
Также был проведен анализ индивидуальных показателей е-Ат к ЭБ у больных с ХБС в мужской и женской группах. В результате было установлено, что у большинства пациентов (56-82%) содержание е-Ат выше нормы, а у незначительной части (0-11%) – ниже нормы (рис. 3). Суммарно, в группе мужчин 72-82% (в среднем 79.5%) имеют отклонения профилей е-Ат к ЭБ от диапазона нормальных значений, среди женщин – 69-88% (в среднем 78.3%).
Из данных, представленных на рисунке 3, также следует, что у больных более выражен иммунный ответ к ОП по сравнению с ответом к БА, поскольку численность пациентов с уровнями е-Ат к β-эндорфину и орфанину, диапазона выше нормальных значений больше тех же показателей по е-Ат к серотонину и дофамину в среднем на 12% у мужчин и на 18.5% у женщин. Этот факт отражает более важную роль опиоидергической системы в механизмах антиноцицепции. Сравнение показателей между гендерными группами показывает, что у мужчин в среднем на 10% чаще встречаются е-Ат к биогенным аминам диапазона «выше нормы», чем у женщин. Более детальный анализ индивидуальных профилей антител (разделение на группы с повышенным и высоким уровнем антител) показал (табл. 2), что, в целом, в женской группе встречаемость высоких уровней антител выше. Наиболее заметны различия в уровнях е-Ат к ОП: у женщин показатели выше, чем у мужчин в среднем на 21%. Особенно высокая серопозитивность у женщин к пептиду орфанину, так как численность женщин с высоким содержанием е-Ат к орфанину (55.6%) статистически значимо больше аналогичного показателя группы повышенных значений (19%, р<0.001).
Определенные особенности суммарных профилей е-Ат были обнаружены и внутри гендерных групп. Так, более явными стали различия показателей иммунного ответа к ОП и БА. У женщин высокий уровень е-Ат к β-эндорфину и орфанину обнаруживался достоверно чаще, чем к дофамину (р<0.03) и серотонину (р<0.0001). У мужчин высокий уровень е-Ат к β-эндорфину выявлялся достоверно чаще, чем к серотонину (р=0.007), и чаще, чем к орфанину, но на уровне тенденции (р=0.06). Также было проведено динамическое исследование уровней е-Ат к ЭБ. Сравнение индивидуальных профилей е-Ат, полученных в первый день обследования и на заключительном этапе, показало незначительные колебания в содержании антител. Следует отметить достоверное повышение показателей в группе высоких уровней е-Ат к орфанину (31%, р=0.003) у мужчин, а также значимые изменения в индивидуальных профилях некоторых пациентов. В целом по группам через 31 день наблюдения уровни антител оставались выше нормального диапазона у большинства пациентов. По-видимому, это связано с долговременным паттерном реагирования гуморальной иммунной системы. Важно подчеркнуть, что наблюдаемое длительное поддержание патологических уровней е-Ат к регуляторам боли может негативно отражаться на динамике ХБС [16], тормозить процесс выздоровления и снижать эффективность лечебных мероприятий. ЗАКЛЮЧЕНИЕ Таким образом, исследование иммунологических показателей у больных хронической болью в спине показало, что существуют гендерные отличия не только в субъективном восприятии боли, но также и в сывороточном содержании антител к некоторым регуляторам болевого сигнала. Установлено, что у многих пациентов уровни е-Ат к исследованным регуляторам боли (β-эндорфину, орфанину, серотонину, дофамину) значительно выше нормы, и это патологическое состояние сохраняется, несмотря на существенное снижение интенсивности БС, что согласуется с литературными данными [16]. Это наблюдение имеет значение в исследовании механизмов хронизации и поддержании болевого состояния, указывая на то, что антитела к нейромедиаторам антиноцицептивной системы играют важную роль в усилении и пролонгации ХБС. БЛАГОДАРНОСТИ Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013 – 2020 годы (№ госрегистрации 01200952666). Авторы выражают глубокую благодарность врачу РМАПО кафедры неврологии Мосейкину Илье Александровичу, за сбор и предоставление клинического и биологического материала обследуемых больных. ЛИТЕРАТУРА
|