К 40-летию Института физиологически активных веществ РАН
|
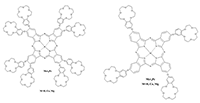
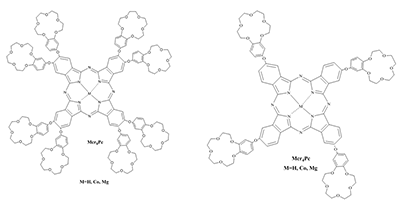
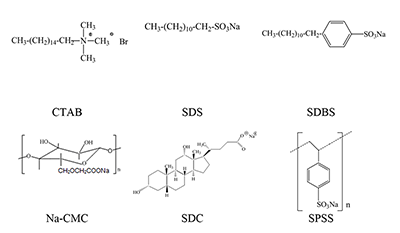
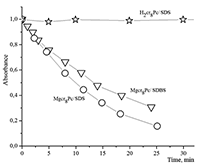
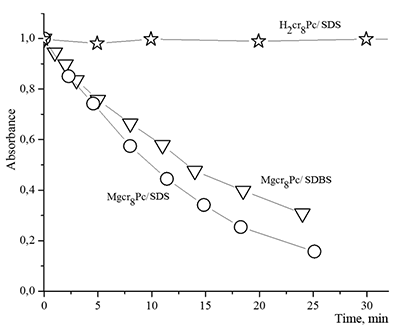
СОДЕРЖАНИЕ Рисунок 1 Структурные формулы окта- и тетра-(бензо-15-краун-5)фталоцианинов. Рисунок 2 Структурные формулы исследованных ПАВ. Рисунок 16 Изменение ЭСП мицеллярного раствора Mgcr8Pc/SDBS во времени при облучении. Рисунок 17 Кинетика фотовыцветания растворов Mgcr8Pc/SDS, Mgcr8Pc/SDBS и Н2cr8Pc/SDS. |
Краун-содержащие фталоцианины – потенциальные сенсибилизаторы для фотодинамической терапии. Синтез, свойства и роль нековалентных взаимодействий
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
*e-mail: mager1988@gmail.com Ключевые слова: фталоцианины; фотодинамическая терапия; микрогетерогенные среды; спектроскопия DOI: 10.18097/BMCRM00042 ВВЕДЕНИЕ Поиск эффективных сенсибилизаторов при фотодинамической терапии (ФДТ) онкологических заболеваний является актуальной задачей. Метод ФДТ основан на совместном использовании сенсибилизатора, молекулярного кислорода и света определенной длины волны. Координационные соединения на основе фталоцианинов (ФЦ), благодаря их уникальным свойствам (стабильности, низкой токсичности, интенсивному поглощению в красной и ближней ИК-областях электромагнитного спектра, фотофизическим и фотохимическим эффектам) являются весьма перспективными соединениями для разработки фотосенсибилизаторов для фотодинамической терапии [1,2]. Триплетные свойства (квантовый выход и время жизни) для фталоцианинов, содержащих диамагнитные ионы металлов, высоки, что приводит к эффективной генерации синглетного кислорода (1О2) и эффективному разрушению опухолей. Поскольку активные формы кислорода в растворе генерируются только при участии мономерной формы ФЦ, агрегация в полярных средах и низкая растворимость в воде являются основными ограничениями использования фталоцианинов в медицине [3]. Наличие агрегатов приводит к безызлучательной релаксации поглощенной энергии, уменьшая квантовый выход люминесценции и время жизни возбужденных состояний [4]. Одним из подходов к увеличению растворимости ФЦ в воде является введение периферических заместителей, содержащих фрагменты краун-эфиров. Известно, что краун-эфиры – аннелированные [5] или присоединенные к макроциклу ФЦ через кислородный мостик [6] – приводят к катион-индуцированной агрегации ФЦ путем формирования супрамолекулярных комплексов «гость-хозяин» с катионами металлов. Формирование таких комплексов способствует растворению краун-содержащих фталоцианинов в полярных средах, когда в качестве «гостя» выступают катионы щелочных металлов. Далее состояние ФЦ в водном растворе определяется эффектами с участием солюбилизирующего агента, в качестве которого принято использовать поверхностно–активные вещества (ПАВ) различной природы – низкомолекулярных (синтетических) ПАВ, липидов и компонентов полимерных мицелл [7]. В данной работе исследованы ФЦ, содержащие четыре или восемь фрагментов бензо-15-краун-5 (рис. 1), в том числе, возможности применения ПАВ для предотвращения тенденции краун-ФЦ агрегировать в водной среде.
В качестве ПАВ исследованы как синтетические, так и биосовместимые природные соединения. При анализе структуры и свойств организованных супрамолекулярных комплексов с участием краун-ФЦ были преимущественно использованы электронные спектры поглощения (ЭСП), в которых четко отражаются изменения в состоянии ФЦ, происходящие при введении ионов щелочных металлов, ПАВ или варьировании полярности среды. МАТЕРИАЛЫ И МЕТОДЫ Реактивы. 2,3,9,10,16,17,23,24-Окта[(4´-бензо-15-краун-5)окси]фталоцианин, (1a, H2cr8Pc) и 2,3,9,10,16,17,23,24-oкта[(4´-бензо-15-краун-5)окси]фталоцианинат кобальта (Cocr8Pc) и магния (Mgcr8Pc) синтезированы по методикам, приведенным в работе [7], тетра-краун-содержащие Pс кобальта (Cocr4Pc) и магния (Mgcr4Pc) независимо получены по методике, аналогичной [8]. В работе использовали гексадецилтриметиламмоний бромистый (C16H33N(CH3)3Br, CTAB, «Aldrich», США), додецилсульфат натрия (СН3(СН2)11OSO3Na (SDS), 85%, додецилбензолсульфонат натрия (SDBS) «Fluka», Швейцария, (95%), натриевую соль карбоксиметилцеллюлозы (Na-СМС), «Aldrich», дезоксихолат натрия (≥97%) «Aldrich»), КСl и NaCl (марки «чда» для электрохимии). Растворы KCl (0.0055 и 0.05 М), CTAB (0.0086 и 0.018 М) и карбоксиметилцеллюлозы (0.64%) готовили на бидистиллированной воде. Дихлорметан (марки для спектрофотометрии, «Aldrich») перед употреблением перегоняли. Этиловый спирт обезвоживали согласно [9]. Спектрофотометрические измерения проведены на спектрофотометре Specord М-40 в растворах и на пленках {покрытие/подложка (ITO, кварц)}. Для растворов использовали 1, 2 и 10 мм кварцевые кюветы. РЕЗУЛЬТАТЫ Методом оптической спектроскопии исследовано поведение окта-[(4'-бензо-15-краун-5)]фталоцианина (H2cr8Pc), окта- и тетра-[(4'-бензо-15-краун-5)] фталоцианинатов кобальта (Cocr8Pc и Cocr4Pc) в водных растворах электролитов и в присутствии катионных и анионных поверхностно-активных веществ: гексадецилтриметиламмония бромистого (СТАВ), натриевой соли карбоксиметилцеллюлозы (Na-СMС), додецилсульфата натрия (SDS) [10], додецилбензолсульфоната натрия (SDBS), дезоксихолата натрия (SDС) [11]. Структуры этих соединений представлены на рисунке 2.
Способность краун-эфиров к комплексообразованию с катионами щелочных металлов, в частности К+ (диаметр катиона 2.66 Å), была использована для растворения краун-содержащих ФЦ в полярных средах, в том числе, и в воде. Скорость и полнота растворения Cocr8Pc в водном растворе KCl зависят от концентрации последнего [10,12]. На рисунке 3 приведен спектр раствора (1) над кристаллами соединения Соcr8Pc, характерный для низкой концентрации KCl (< 5.5•10-3 М). Поглощение в области 630 нм, а также плечо около 750 нм вместе с уширением полосы при более коротких длинах волн свидетельствуют о формировании в этих условиях агрегатов разного состава и строения. Наблюдаемое батохромное смещение максимума до λ = 750 нм относительно максимума с λ = 673 нм для мономера Cocr8Pc в CH2Cl2, равное 0.189 эВ, может являться косвенным подтверждением присутствия в растворе наночастиц ФЦ. Высокое значение оптической плотности раствора Cocr8Pc/KCl в области агрегации кофациального типа (λ = 630 нм) свидетельствует, что в этих условиях димерные гетероядерные ионные комплексы соединения Cocr8Pc являются наиболее растворимыми. Понижение концентрации KCl до 1.2•10-3 - 3•10-4 М приводит к осаждению значительной части ФЦ, спектр поглощения которого характерен для мономера Cocr8Pc в СH2Cl2 (λ = 673 нм, ε = 1.47·105 л моль-1см-1). При этом спектр (2) водного раствора над осадком отвечает состоянию Cocr8Pc в виде устойчивой высокодисперсной водной суспензии с KCl в качестве стабилизатора (рис. 3).
Повышение ионной силы раствора (концентрации KCl от 5.5•10-2 М и выше) в сочетании со способностью краун-эфиров к комплексообразованию с катионами щелочных металлов, в данном случае с К+, приводит к быстрому растворению Cocr8Pc и формированию гомогенного раствора (рис. 4, спектр 1). В этих условиях и соединение Н2cr8Pc также растворяется (рис. 4, спектр 2), то есть присутствие металла в макроцикле ФЦ не является необходимым условием процесса растворения.
Наличие максимума при 628 нм указывает на протекание преимущественно катион-индуцированной агрегации кофациального типа. Отметим, что кислородный мостик между макроциклом и заместителем, содержащим краун-эфирную группу, не препятствует формированию, как и в случае аннелированного с фталоцианином краун-эфирного фрагмента, упорядоченной структуры Mcr8Pc при комплексообразовании последних с К+ [6,12]. Спектральные характеристики (длина волны максимума поглощения λ, значение коэффициента молярного погашения ε, форма и полуширина полосы поглощения) для растворов Cocr8Pc и Н2cr8Pc в водном KCl близки (632 и 628 нм, 77000 и 76400 л моль-1см-1, 114 и 132 нм соответственно). При концентрации СТАВ (диаметр полярной группы ~ 5.8 Å), равной 8.6•10-3 М, которая заметно выше его критической концентрации мицеллобразования (ККМ) в водной среде (1.0•10-3 М [13]), окта-(бензо-15-краун-5)фталоцианинат кобальта растворяется в воде. Максимальная оптическая плотность в области Q-полосы в спектре (3) наблюдается при 614 и 750 нм (рис. 3), то есть, Pc находится в агрегированном состоянии. Центрифугирование (7000 об/мин, 0.4 ч) приводит к незначительному количеству твердого Cocr8Pc (ε = 1.47•105 л моль-1см-1 для Q-полосы в ЭСП в растворе СH2Cl2) и спектру 4 для раствора с полосами при 614, 674 и 750 нм (см. рис. 3). Аналогичная картина характерна и для Cocr8Pс в 0.018 М водном растворе СТАВ. Соединение H2cr8Pc также растворяется в водной среде в присутствии CTAB. На рисунке 5 приведены спектры поглощения для H2cr8Pc и Cocr8Pc в 8.6•10-3 M водном растворе CTAB с максимумами при 625 и 614 нм соответственно.
Введение KCl (0.055 М) в раствор Cocr8Pc с концентрацией CTAB порядка 8.6•10-3 М приводит к появлению поглощения гетероядерного димера Cocr8Pc/K+ с максимумом при 632 нм (рис. 6, спектр 2).
Спектр поглощения тетра(бензо-15-краун-5)фталоцианината кобальта (Cocr4Pc), в дихлорметане, в котором присутствует интенсивный π-π * переход при 680 нм (ε = 0.72•105 л моль-1см-1) со спутником более низкой интенсивности со стороны меньших длин волн (Q-полоса) и второй, интенсивный и более широкий, π-π * переход в ближней УФ-области (полоса Соре), типичен для ФЦ, находящегося в растворе в виде мономера (рис. 7, спектр 1), что свидетельствует о гидрофобном механизме взаимодействия молекул слабо полярного растворителя (значение εо для СН2Cl2 составляет 8.9) и ФЦ. Полуширина Q-полосы равна ~ 600 см-1. В интервале концентраций 2.5•10-6 – 2.5•10-5 М для растворов Cocr4Pс не наблюдается отклонения от закона Бугера-Ламберта-Бера. Как и в случае Cocr8Pc, СТАВ при соотношении СТАВ : Pc = (20÷40):1 не влияет на характер спектра Cocr4Pc (1.35•10-5 М) в растворе СН2Cl2, то есть эффект поляризации среды при таких концентрациях тетраалкиламмонийной соли и ФЦ не играет заметной роли. В смешанном растворителе, этиловый спирт–дихлорметан {C2H5OH/CH2Cl2 = 1:1 (об.)} спектр Cocr4Pс по сравнению с таковым в CH2Cl2 меняется, и падение интенсивности Q-полосы в области поглощения мономера при 680 нм вместе с её уширением и гипсохромным смещением свидетельствует об агрегации молекул Cocr4Pс и при низких концентрациях ФЦ (рис. 7).
Введение в этот раствор СТАВ не оказывает влияния на степень агрегации соединения (рис. 8), обусловленной изменением полярности среды (εо для СН2Cl2 и С2Н5ОН равна 8.9 и 24 соответственно). Отметим, что Cocr4Pc плохо растворяется в водном 8.6•10-3 М CTAB и находится преимущественно в виде суспензии. Иная картина наблюдается при растворении краун-содержащих ФЦ с участием анионного ПАВ – додецилсульфата натрия (SDS).
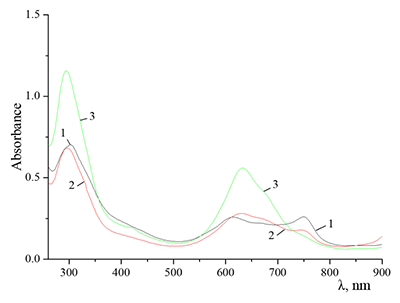
Иная картина наблюдается при растворении краун-содержащих ФЦ с участием анионного ПАВ – додецилсульфата натрия (SDS). Отметим, что диаметр иона Na+ (1.9 Å) соответствует диаметру полости 15-членного бензо-15-краун-5 (1.7-2.2 Å). В водной среде при концентрации SDS, близкой к ККМ, Cocr4Pc присутствует в виде смеси мономерной и димерной форм, причем доля последней является значительной (рис. 9, спектр 1), а при концентрации SDS ~ 0.1 М (то есть >> ККМ) – в «чистой» мономерной форме (спектр 2). Отметим, что в этом случае параметры спектра близки к спектральным характеристикам Cocr4Pc в дихлорметане (спектр 4).
При сравнении поведения H2cr8Pc и Cocr4Pc в водной среде в присутствии SDS также видно их отличие, свидетельствующее о роли восьми краун-групп в ФЦ. Так, в микрогетерогенной среде – водном растворе SDS – окта-(бензо-15-краун-5)фталоцианин, H2cr8Pc, при концентрациях SDS ≈ ККМ находится в мономерной форме (рис. 10, спектр 3), а при концентрации SDS < ККМ – преимущественно в димерной (спектр 2).
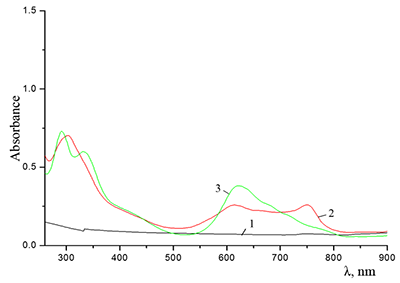
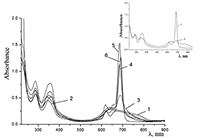
Из приведенных данных следует, что присутствие ПАВ – уникальных диспергирующих реагентов [13], способных адсорбироваться на границе раздела фаз – приводит к понижению поверхностного потенциала между кристаллическим ФЦ и раствором и способствует солюбилизации (растворению) краун-содержащих ФЦ в водной среде. Анализ поведения краун-содержащих ФЦ в водной среде проведен и в присутствии анионного полиэлектролита – натриевой соли карбоксиметилцеллюлозы (Na-CMC), водорастворимого биополимера широкого применения с гидрофильно-гидрофобными свойствами. Для Na-CMC характерны суспендирующие, стабилизирующие, пленкообразующие и др. свойства, что позволяет ожидать ее участия в создании, подобно ПАВ, микрогетерогенного окружения вокруг молекул ФЦ. Согласно спектрам поглощения для соединения Cocr8Pc в 0.64% водном растворе Na-CMC (~5•10-2 М, считая на формульную единицу при х = 1) формируется раствор, в котором присутствуют молекулы ФЦ, в том числе и в виде агрегатов разных типов (см. рис. 11, спектр 1). Соединение H2cr8Pc ведет себя аналогично. На рисунке 11 представлены также спектральные изменения, сопровождающие добавление твердого KCl к системе Pc/Na-CMC: введение KCl приводит к формированию кофациального димера Cocr8Pc с характерным гипсохромным сдвигом Q-полосы (спектр 2). При комнатной температуре они происходят немедленно, и спектр в дальнейшем не меняется. Отметим, что, как и в случае системы Cocr8Pc-СТАВ, в спектре присутствует полоса при 672 нм для мономера Cocr8Pc (рис. 11). По-видимому, это является результатом гидрофобных взаимодействий при организации молекул Cocr8Pc в присутствии Na-CMC. Тем не менее, исходя из коэффициентов молярного погашения (7.7•104 и 1.47•105 л моль-1см-1 для димера и мономера ФЦ, соответственно), именно кофациальный димер является основной частицей. Благодаря участию Na-CMC может быть получена пленка, модифицированная гетероядерным димером Cocr8Pc/KCl. Как раствор состава Cocr8Pc-KCl-Na-СМС, так и пленка этого композита были стабильны на воздухе.
Обратный порядок введения компонентов - добавление Na-CMC к раствору гетероядерных комплексов ФЦ (Cocr8Pc/KCl) - не приводит к разрушению агрегатов фталоцианина, то есть димер – гетероядерный ионный комплекс типа “сэндвич” [(Cocr8Pc)2/(K+)x] (Cl-)x – в водном растворе в присутствии Na-СМС сохраняется. Это свидетельствует о высоком значении его константы образования, что и обеспечивает растворение окта-краунсодержащих ФЦ в водной среде в присутствии KCl. Состояние агрегации Cocr8Pc в водном растворе Na-CMC сохраняется и при 0.5 М концентрации NaCl (рис. 12). В отличие от поведения системы Cocr4Pc (Cocr8Pc)/ SDS в воде (см., например, рис. 9), мономерный заряженный комплекс Cocr8Pc/Naх+ в водной среде не образуется ни с участием катионов натрия из Na-СМС, ни при дополнительном введении их в виде NaCl. Таким образом, формирование агрегированных форм краун-содержащих ФЦ в присутствии Na-CMC также свидетельствует, что определяющую роль в форме существования краун-содержащих ФЦ в водной среде играет сочетание соответствия размера катиона солюбилизирующего реагента диаметру полости краун-эфира и наличия гидрофобного окружения ФЦ.
Электронный спектр поглощения Mgcr8Pc в дихлорметане типичен для мономера металлофталоцианина (рис. 13, кривая 1). Он состоит из ряда полос в УФ- и видимой областях: уширенных N-полосы при 288 нм и полосы Соре при 360 нм, а также интенсивной Q-полосы при 690 нм (ε = 2.09•105л•моль-1см-1) с вибронной полосой при 620 нм. По сравнению с незамещенным металлофталоцианином, Q-полоса для Mgcr8Pc смещена в длинноволновую область [14]. В интервале концентраций 2.5•10-6–2.5•10-5 М для растворов Mgcr8Pc не наблюдается отклонения от закона Бугера–Ламберта–Бера.
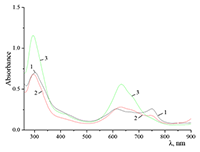
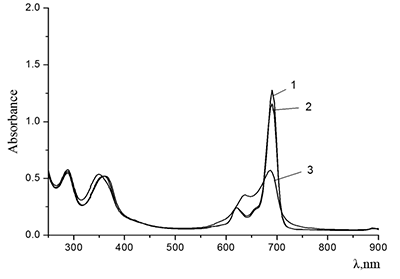
Интенсивность Q-полосы в области поглощения мономера падает с ростом концентрации спирта при титровании последним раствора Mgcr8Pc в дихлорометане (кривые 2 и 3). Появление максимума при λ = 630 нм (кривая 3) свидетельствует о кофасиальной агрегации макроциклов Pc при повышении полярности среды (повышении донорного числа растворителя) {εо (СH2Cl2) = 8.9 и εо (C2H5OH) = 24.3}). В микрогетерогенной среде Mgcr8Pc при концентрациях SDS, примерно равных ККМ, находится в мономерной форме, а при концентрации ниже ККМ – в димерной и (или) более агрегированных формах (рис. 14).
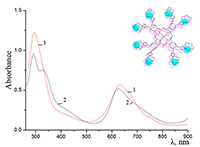
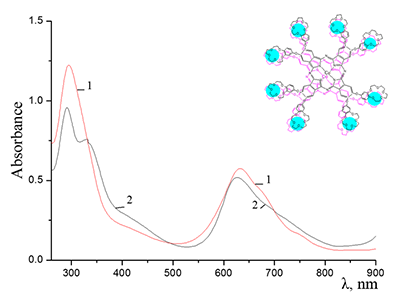
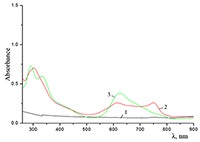
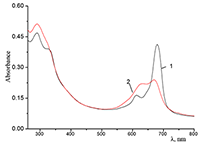
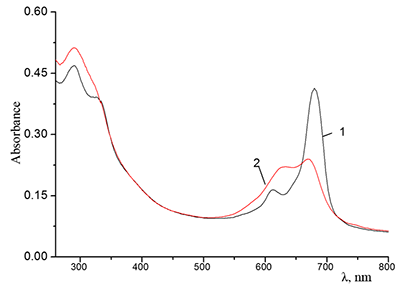
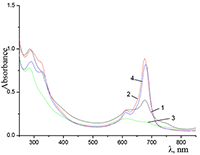
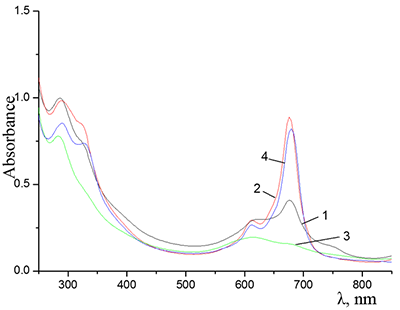
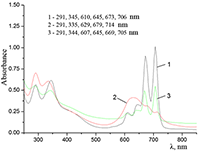
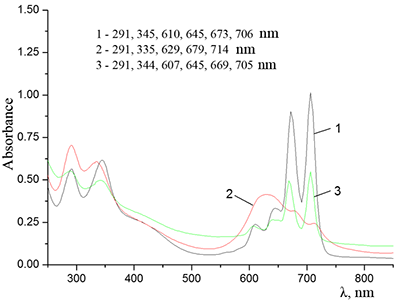
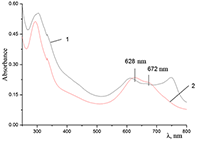
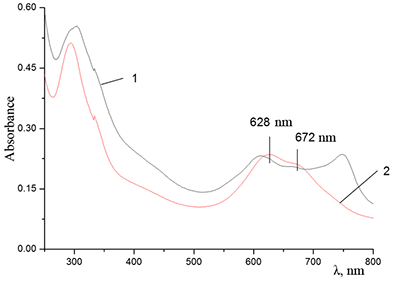
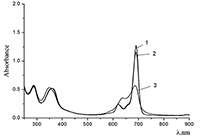
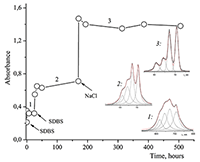
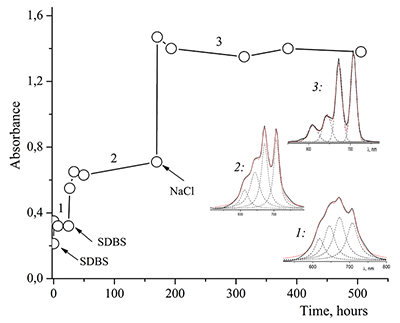
Показано, что окта-[(4´-бензо-15-краун-5)-окси]фталоцианины солюбилизируются в водных растворах анионного SDS с образованием мономеров и димеров при концентрации поверхностно-активного вещества (ПАВ), близкой к критической концентрации мицеллообразования и ниже её, соответственно. Однако в биологических системах логичнее использовать биосовместимые и биоразлагаемые ПАВ, такие как дезоксихолат натрия (SDC, рис. 2) для предотвращения агрегации фталоцианинов [11]. Установлено, что H2cr8Pс растворяется в мицеллярном растворе анионного SDC с сохранением преимущественно агрегированного состояния Pc, в том числе при разбавлении с последующим введением натриевой соли полистиролсульфоновой кислоты (SPSS) (рис. 2) или повышением ионной силы раствора (введение NaCl). Однако замена SPSS на анионный додецилбензолсульфонат натрия (SDBS) приводила к мономеризации H2cr8Pс (рис. 15).
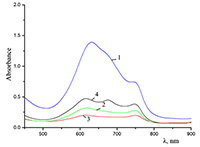
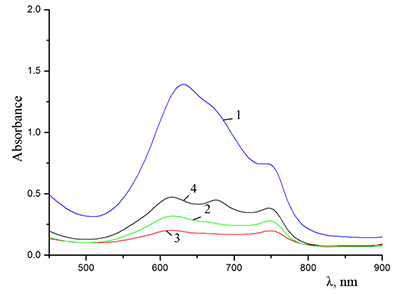
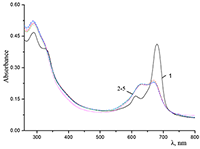
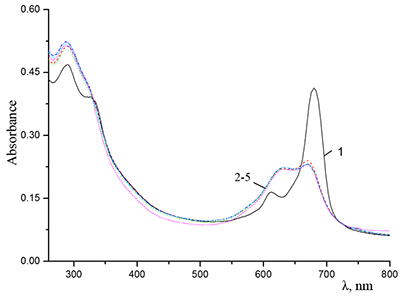
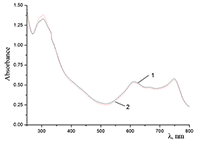
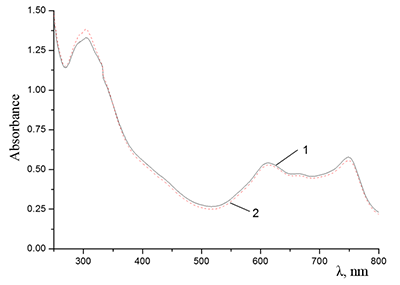
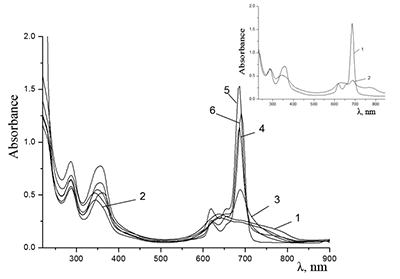
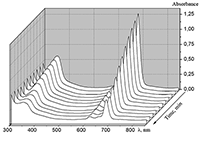
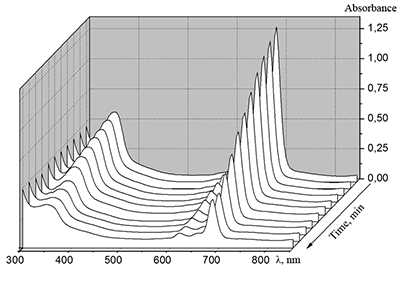
Поведение молекул ФЦ на свету, в том числе и при облучении, используется для изучения их стабильности, поскольку это является важным условием применения в ФДТ. В обычных условиях (комнатная температура, рассеянный видимый свет) водные мицеллярные растворы H2cr8Pc (ФЦ в форме мономера) стабильны на воздухе. Напротив, для мицеллярных систем с участием Mgcr8Pc наблюдается уменьшение оптической плотности раствора (в случае Mgcr8Pc/SPSS/SDC/NaCl до ~50% в течение недели). Аналогично ведет себя Mgcr8Pc, солюбилизированный в виде мономера в растворах других анионных ПАВ – SDS и SDBS. Изменение ЭСП организованной микрогетерогенной системы Mgcr8Pc/SDBS при облучении светом с λ = 578 нм в воде приведено на рисунке 16, а рисунок 17 показывает поведение длинноволновой Q-полосы ряда мицеллярных ФЦ-содержащих растворов во времени. Падение оптической плотности происходит без изменения формы В- и Q-полос относительно исходного раствора, без появления новых полос в этой области и сопровождается ростом поглощения при более коротких длинах волн, то есть наблюдается истинное фотовыцветание раствора ФЦ [15,16]. Оценка квантового выхода фотодеструкции мономера Mgcr8Pc в этих условиях дает величину порядка 4•10-4, то есть, по фотостабильности Mgcr8Pc относится к умеренно стабильным ФЦ [17,18].
ЗАКЛЮЧЕНИЕ Исследовано поведение окта- и тетра-(бензо-15-краун-5)фталоцианинов в водных растворах электролитов в присутствии поверхностно-активных веществ (ПАВ): синтетического (гексадецилтриметиламмоний бромида), додецилсульфата натрия, биосовместимых натриевой соли карбоксиметилцеллюлозы и дезоксихолата натрия. Взаимодействие СТАВ и краун-содержащих ФЦ обеспечивает растворение H2cr8Pc, Cocr8Pc и в значительно меньшей степени Cocr4Pc с формированием агрегированных форм, в том числе, кофациальных гетероядерных димеров. Наличие металла в макроцикле не является необходимым условием растворения краун-содержащих ФЦ в присутствии ПАВ или KCl. Карбоксиметилцеллюлоза Na-CMC способствует растворению ФЦ и позволяет получать из водных растворов пленки, модифицированные К+/Mcr8Pc. В водном растворе SDS – микрогетерогенной среде – H2cr8Pc при концентрациях SDS ≈ ККМ находится в мономерной форме, а при концентрации SDS < ККМ – в димерной. В аналогичных условиях (среда, содержащая ПАВ) Cocr4Pc существует в мономерной форме при концентрации SDS >> ККМ. На примере H2cr8Pc показано влияние размера катиона солюбилизирующего компонента на форму существования краун-содержащего фталоцианина в водной среде. Установлено, что в обычных условиях (комнатная температура, рассеянный видимый свет, водные мицеллярные растворы) H2cr8Pc (ФЦ в форме мономера) стабилен на воздухе. Напротив, для мицеллярных систем с участием Mgcr8Pc наблюдается уменьшение оптической плотности раствора (в случае Mgcr8Pc/ SPSS/SDC/NaCl до ~50% в течение недели). Аналогично ведет себя Mgcr8Pc, солюбилизированный в виде мономера в растворах других анионных ПАВ – SDS и SDBS. Оценка квантового выхода фотодеструкции мономера Mgcr8Pc в этих условиях дает величину порядка 4•10-4, то есть, по фотостабильности Mgcr8Pc относится к умеренно стабильным Pc. БЛАГОДАРНОСТИ Работа выполнена в рамках Государственного задания 2018 года (темы № 0090-2017-0024 и 0081-2014-0015), Программы Президиума РАН № 34 и при частичной поддержке РФФИ (грант № 18-03-00743). ЛИТЕРАТУРА
|