К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ |
Защитное действие экстракта листьев черники в отношении эксайтотоксического действия глутамата на нейроны коры мозга крыс
Институт физиологически активных веществ Российской академии наук,
142432, Черноголовка, Московской обл., Северный проезд, 1;
*e-mail: klochkov@ipac.ac.ru Ключевые слова: экстракт; черника; культивируемые нейроны; глутамат; MK-801; эксайтотоксичность DOI: 10.18097/BMCRM00045 ВВЕДЕНИЕ Известно, что экстракты из некоторых лекарственных растений, широко употребляемых в народной медицине, оказывают положительное действие при ишемии, травме мозга, нейродегенеративных заболеваниях различной природы – паркинсонизме и сенильных деменциях альцгеймеровского типа. Как правило, их механизм действия связывают, в первую очередь, с улучшением микроциркуляции крови в мозге и увеличением антиоксидантов в тканях из-за большого количества растительных флавоноидов [1]. В последнее время получены данные, свидетельствующие о прямом нейропротекторном действии растительных экстрактов и (или) их компонентов на нервные клетки in vitro. Эффект был показан на широко применяемой для подобных целей модели ишемического повреждения эксайтотоксическими аминокислотами культивируемых нейронов [2-4]. При ишемии-реперфузии выход большого количества глутамата в принейрональное пространство вызывает гиперстимуляцию глутаматных рецепторов, особенно NMDA-подтипа, и значительный вход ионов Са2+ в нейроны, что способствует их дегенерации [5,6]. Инактивация NMDA-рецепторов антагонистами, в том числе и (+)-5-Mетил-10,11-дигидро-5H-дибензо[a,d]циклогептен-5,10-имин малеатом (MK-801), предохраняет нейроны от гибели, вызываемой избытком глутамата [7]. В настоящей работе было исследовано действие лиофилизированного водного экстракта листьев черники Vaccinium myrtillus L. на способность ингибировать глутамат-стимулируемый вход ионов Са2+ в синаптосомы и предохранять культивируемые кортикальные нейроны крысы от эксайтотоксического действия глутамата в сравнении с препаратом MK-801. МАТЕРИАЛЫ И МЕТОДЫ Материалы В работе использовали реактивы производства «Sigma-Aldrich» (США). Для определения входа кальция в синаптосомы использовали радиоактивную метку 45Са2+ (удельная активность 200 ГБК/мл, производство «Sigma-Aldrich»). Животные В экспериментах использовались самцы нелинейных беспородных крыс весом 200-220 г. Животные содержались в условиях стандартного вивария с 12-часовым световым режимом и свободным доступом к воде и пище. Все манипуляции с животными проводились в соответствии с решениями комиссии по Биоэтике ИФАВ РАН. В работе использовалось оборудование Центра коллективного пользования ИФАВ РАН. Приготовление водного экстракта листьев черники Для приготовления экстракта использовали листья черники Vaccinium myrtillus L., собранные на территории Московской области в период интенсивного цветения. Собранное воздушно-сухое сырье (100 граммов) измельчали и трижды экстрагировали 300 мл дистиллированной воды при температуре 45°С в течение 1 ч. Полученный экстракт фильтровали, частично упаривали на роторном испарителе (температура бани 45°С), затем высушивали в лиофильной сушке. Полученный экстракт хранили при 0°С. Определение суммы флавоноидов в водном экстракте листьев черники Определение суммы флавоноидов проводили спектрофотометрическим методом согласно фармакопейной методике, применяемой в фармацевтической промышленности [8] и модифицированной под конкретную задачу. Оптическую плотность раствора определяли на спектрофотометре Lambda 35 («PerkinElmer», США) в кювете с толщиной слоя 1 см при λ=330 нм. Процентное содержание суммы флавоноидов Х вычисляют по формуле:
Определение глутамат-индуцированного входа ионов Са2+ в синаптосомы нейронов мозга крыс Синаптосомы коры мозга крыс выделяли из коры мозга новорожденных (9-10 дней) крыс Вистар по стандартной методике Хайоша. Кору мозга гомогенизировали в 10 объемах охлажденной 0.32 М сахарозы (5 мМ HEPES pH 7.4). Гомогенат центрифугировали в течение 10 мин при 1500 g. Полученный супернатант центрифугировали 20 мин при 10000 g [9]. Для аккумуляции радиоактивной метки 45Са2+ Р2-фракцию синаптосом суспендировали в инкубационном буфере А следующего состава: 132 мМ NaCL, 5 мМ KCL, 5 мМ HEPES, pH 7.4 (концентрация белка 1.5-2.0 мг/мл) и вносили исследуемое вещество и 45Са2+ (удельная активность 200 ГБК/мл). Захват 45Са2+ в синаптосомы стимулировали внесением глутамата в концентрации 2х10-4 М. Через 5 мин инкубации при 30°С захват останавливали фильтрованием через фильтры gF/B ( «Merck Millipore», Германия), промывая три раза ледяным буферным раствором В (145 мМ KCL, 10 мМ Трис, 54 мМ трилона В), и подсчитывали количество радиоактивной метки на жидкостном сцинтилляционном счетчике Tri-Carb 2800 TR («PerkinElmer/Packard», США). Количество захваченного 45Са2+ в синаптосомах определяли по разнице в содержании метки при стимуляции глутаматом и без стимуляции глутаматом и выражали в процентах контроля (контроль принимали за 100%). Каждая проба ставилась в трёх параллелях, и каждый препарат исследовался в двух независимых экспериментах. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ По логарифмическим кривым зависимости действия от концентрации экстракт черники близок по способности ингибировать вызываемый глутаматом вход Са2+ в синаптосомы к МК-801 (IC50 – 9.1 мкг/мл и 7.72 мкг/мл соответственно) (табл. 1). Предполагается, что основные действующие вещества экстракта листьев, используемых в медицине растений, в том числе и черники, представлены флавоноидами [10]. Содержание суммы флавоноидов в экстракте листьев черники по нашим данным составляет 6.7%, что согласуется с литературными данными [11].
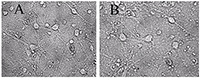
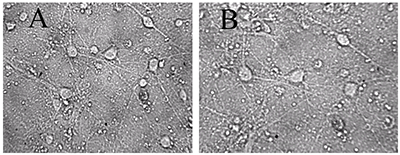
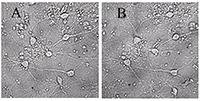
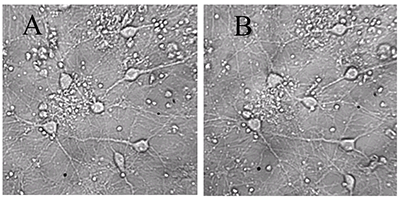
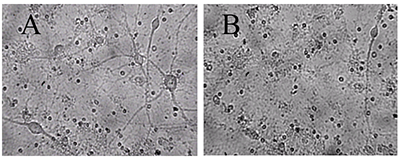
Для экспериментов на культивируемых нейронах были выбраны концентрации 10 мкг/мл экстракта черники и 10 мкМ МК-801, примерно соответствующие их IC50 по способности ингибировать глутамат-зависимый вход Са2+ в синаптосомы. Использовали предварительную инкубацию нейронов с веществами, совместную с глутаматом и последующую инкубацию.Из рисунка 1 и таблицы 2 видно, что после инкубирования с глутаматом, погибли практически все нейроны. Инкубирование с МК-801 достаточно эффективно предохраняет нейроны от действия глутамата (табл. 2, рис. 2, видно много живых нейронов). Экстракт черники предохранял зрелые, то есть имеющие ионотропные глутаматные рецепторы, культивируемые нейроны от нейротоксического действия глутамата (рис. 3, табл. 2).
Наилучшие результаты по ингибированию действия глутамата показал вариант c предварительной, совместной и последующей инкубацией нейронов с экстрактом черники, когда нейроны все время инкубировались в присутствии экстракта черники. Как следует из литературных данных, предварительное инкубирование с антагонистами глутаматных рецепторов NMDA-подтипа усиливает их защитное действие по отношению к глутамату [12], что видно на примере МК-801 (табл. 2). Возможно, и в экстракте черники присутствуют специфические ингибиторы рецепторов NMDA, однако связывание их с рецептором слабое и недостаточное для ингибирования в случае только предварительной инкубации до введения в среду глутамата. Последующее присутствие экстракта черники в среде обеспечило лучшую выживаемость нейронов, что может зависеть и от антиоксидантных свойств компонентов растительных экстрактов - флавоноидов. Наличием в экстракте черники антиоксидантов можно объяснить не только его защитные свойства, но и характерную колоколообразную форму кривой зависимости доза-эффект (табл. 2). Показано, что для многих антиоксидантов в экспериментах in vitro кривые доза-эффект имеют колоколообразную форму и довольно узкий диапазон действующих концентраций [13], что мы и наблюдали в эксперименте. Глутамат, кроме воздействия на свои специфические рецепторы, в больших концентрациях действует на клетки как сильный оксидант, уменьшает синтез глутатиона и вход ионов Са2+. Различные флавоноиды, присутствующие обычно в растительных экстрактах, способны ингибировать эти процессы [14]. В наших экспериментах большая концентрация глутамата повлияла на выживаемость незрелых нейронов в меньшей степени, чем на зрелые нейроны повлияла малая концентрация глутамата. Вероятно, поэтому действие протекторов в данном случае выражено очень слабо. В связи с этим вариант с последующей инкубацией показал лучшее защитное действие, чем вариант без него (табл. 2), что может указывать и на проявление протекторного действия флавоноидов. Возможно, именно многокомпонентность экстракта черники и обеспечивает лучшую защиту от нейротоксичности глутамата. Таким образом, нами было показано, что водный экстракт листьев черники ингибирует глутамат-индуцированный вход ионов Са2+ в синаптосомы нейронов мозга крыс и IC50 этого процесса близка к IC50 для MK-801, известного неконкурентного антагониста глутаматных рецепторов NMDA-подтипа. Водный экстракт листьев черники предохранял культивируемые нейроны коры мозга крысы от нейротоксического действия глутамата, причем выраженность ингибирования зависела от времени инкубации с экстрактом, на фоне которого действовал глутамат. БЛАГОДАРНОСТИ В работе использовано оборудование Центра коллективного пользования ИФАВ РАН. Работа выполнена в рамках Госзадания 0090-2017-0018. ЛИТЕРАТУРА
|