К 40-летию Института физиологически активных веществ РАН
|
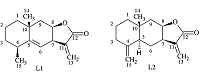
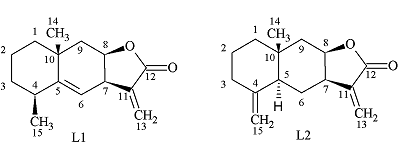
Биологическая активность алантолактонов в экспериментах на клетках Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: klochkov@ipac.ac.ru Ключевые слова: алантолактоны; цитотоксичноть; опухолевые клеточные линии DOI: 10.18097/BMCRM00047 ВВЕДЕНИЕ В последнее время интенсивно исследуются сесквитерпеновые лактоны растений семейства сложноцветных (Asteraceae) и механизмы их противоопухолевого действия. Противоопухолевая активность сесквитерпеновых лактонов реализуется, в основном, через индукцию апоптоза. Важную роль в этом процессе играют влияние лактонов на клеточный редокс-статус, образование активных форм кислорода (АФК) и, как следствие, окислительные повреждения в клетке и запуск митохондриально-зависимого пути апоптоза [1]. Алантолактон (L1) и его изомер по положению двойной связи изоалантолактон (L2) – одни из самых известных сесквитерпеновых лактонов эвдесманового типа (рис. 1). Первые работы по алантолактону появились более 120 лет назад, но его структура была установлена лишь в 1964 году [2]. Наибольшее количество соединений L1 и L2 обнаружено в корнях растения I. helenium – до 5%.
В настоящее время особенно подробно изучают противоопухолевую активность алантолактонов L1 и L2. Так, в обзоре [3] обобщена информация по описанию механизмов действия этих лактонов на апоптотические пути гибели опухолевых клеток: митохондриально- и АФК-зависимые, каспазный путь, а также c участием различных каспазных белков-регуляторов (NF-κB, PI3K-Akt, Nrf2 и др.). Лактоны L1 и L2 были выделены нами из корней растения девясил высокий (Inula helenium) в виде эквимолярной смеси, индивидуальные изомеры разделяли с помощью хроматографии на импрегнированном нитратом серебра силикагеле [4]. Активность основных сесквитерпеновых лактонов I. helenium мы оценивали по их способности оказывать токсическое действие на различные опухолевые клеточные линии, а также способность индуцировать или предотвращать окислительные повреждения липидов мембран клеток. МАТЕРИАЛЫ И МЕТОДЫ Определение жизнеспособности опухолевых клеточных линий при воздействии исследуемыми соединениями В качестве объектов для оценки цитотоксического действия природных алантолактонов использован ряд опухолевых клеточных линий, который составили адгезионные культуры аденокарциномы молочной железы (MCF7) и меланомы кожи (MS), линия аденокарциномы толстого кишечника (HCT116), экспрессирующая белок р53, и ее вариант с нокаутом этого белка (НСТ116 р53-/-), клетки легочной аденокарциномы (A549) и эмбриональная рабдомиосаркома (RD), а также суспензионная культура клеток миелоидного лейкоза (K562). Культуры клеточных линий были предоставлены Лабораторией генетики опухолевых клеток НИИ Канцерогенеза "РОНЦ им. Н. Н. Блохина", а также ИНЦ РАН. Культуры клеток человека MCF7 выращивали в питательной среде EMEM, MS и K562 в RPMI-1640, HCT116 и НСТ116 р53-/- культивировали в DMEM. В соответствующую для клеток среду добавляли эмбриональную телячью сыворотку (10% по объему), L-глутамин (конечная концентрация составляла 2 мM), а в качестве антибиотика-антимикотика использовали гентамицин (1% по объему). Культивирование проводили при 37°C в увлажненной атмосфере CO2 (5%). Для определения жизнеспособности опухолевых линий MCF7, MS и HCT116 (НСТ116 р53-/-) по МТТ-тесту [5] клетки сеяли в 96-луночный планшет в количестве 1 × 104 клеток/200 мкл полной питательной среды и культивировали при 37°C в атмосфере CO2 (5%). После 12 ч инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (100.00, 50.00, 25.00, 12.50, 6.25, 3.12 и 1.56 мкМ), и далее клетки культивировали в тех же условиях 48 ч. Для каждой концентрации эксперимент включал три повторения. Все соединения растворяли в ДМСО, конечное содержание ДМСО в лунке не превышало 1% и не оказывало токсичного действия на клетки. В контрольные лунки был добавлен растворитель в объеме 1%. После инкубации в каждую лунку было добавлено 20 мкл MTT (5 мг/мл), и планшеты дополнительно инкубировали в течение 2. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50% ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения GraphPad Prism 7.0. За 100% принимали выживаемость клеток, инкубированных без исследуемых соединений (контроль). Жизнеспособность клеток линии K562 была определена с использованием ресазурина. После инкубации с соединениями в каждую лунку было добавлено 22 мкл ресазурина с конечной концентрацией 50 мкМ. Планшеты инкубировали в течение 2 ч. Флуоресценцию восстановленного красителя определяли с помощью планшетного анализатора (возбуждение при 530 нм, эмиссия при 590 нм). Оптическую плотность и флуоресценцию клеточного материала определяли с помощью планшетного анализатора Victor3 («Perkin Elmer», США). Для предобработки N-ацетилцистеином в лунки с инкубированными клетками добавляли 3 мкл NAC (5 мМ) в соответствующей питательной среде и инкубировали в течение 4 ч, после этого вносили исследуемые соединения и определяли выживаемость клеток с помощью МТТ-теста. Значения концентраций, вызывающих 50%-ное ингибирование роста популяции клеток (IC50), средние значения, средняя ошибка эксперимента и среднеквадратичные отклонения, а также определение статистически значимой достоверности различий между группами данных рассчитывались с помощью программного обеспечения GraphPad Prism 7. Статистически значимыми считали различия по t-критерию Стьюдента р < 0.05. РЕЗУЛЬТАТЫ В качестве количественного критерия цитотоксичности тестируемых соединений был использован индекс IC50 (табл. 1).
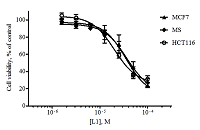
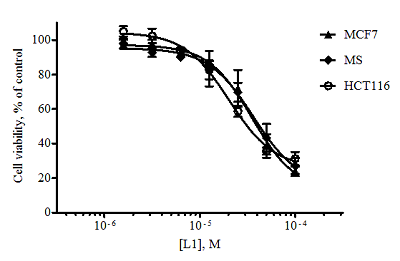
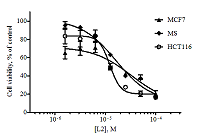
Алантолактон L1 показал приблизительно равное цитотоксическое действие по отношению к линиям HCT116, MCF7 и RD и оказался менее токсичным к клеткам A549 и MS (концентрационные кривые для некоторых линий приведены на рис. 2).
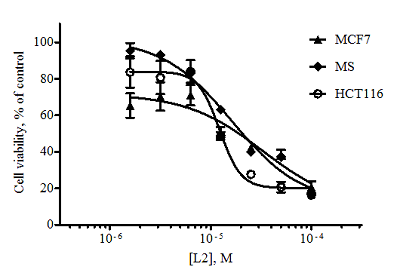
Изоалантолактон L2 показал в МТТ-тесте более высокую цитотоксическую активность по сравнению с изоалантолактоном (концентрационные кривые, рис. 3).
Для определения селективности алантолактонов к опухолевым клеткам в качестве нормальной линии клеток человека была выбрана псевдонормальная линия эмбрионального почечного эпителия HEK293. Cелективность действия у исследованных сесквитерпеновых лактонов выражена незначительно. Так, величина IC50 алантолактона по отношению к НЕК293 в 7 раз выше, чем его IC50 по отношению к НСТ116, IC50 изоалантолактона – в 7 раз выше, чем его IC50 по отношению к культуре опухолевых клеток RD. Для оценки действия лактонов на суспензионные опухолевые клетки был выполнен эксперимент на линии К562 (хронический миелоидный лейкоз). Был использован тест с ресазурином – натриевой солью 7-гидрокси-3Н-феноксазин-3-он-10-оксида – водорастворимым прижизненным красителем. Ресазурин может восстанавливаться более широким спектром ферментов в отличие от МТТ. Кроме митохондриальных дегидрогеназ, он восстанавливается также цитохромами и дегидрогеназами цитоплазмы клетки [6]. Полученные данные по определению жизнеспособности клеток лейкоза позволяют предположить общую высокую токсичность этих соединений: значение IC50 составляло 9.64±0.05 мкM для алантолактона и 6.27±0.03 для изоалантолактона. Исследование участия сигнального пути p53 в гибели опухолевых клеток Для определения участия эндогенного белка р53 в формировании цитотоксической активности исследуемых соединений использовали клеточную линию аденокарциномы толстого кишечника человека НСТ116 wt p53, экспрессирующую белок р53, и ее вариант с нокаутом этого белка (НСТ116 р53-/-). Для оценки цитотоксичности лактонов применяли МТТ-тест, количественной оценкой служил индекс IC50 (табл. 2).
Токсичность изоалантолактона для линии клеток аденокарциномы толстого кишечника человека НСТ116 wt p53 (экспрессирующей белок р53) превышает токсичность для линии с нокаутом этого белка почти в 2 раза, в то время как для алантолактона цитотоксичность в отношении обеих линий клеток одинакова. Предобработка N-ацетилцистеином Для определения роли окислительного стресса в процессе ингибирования роста клеточной линии аденокарциномы молочной железы при действии изоалантолактона исследовали цитотоксичность в присутствии N-ацетилцистеина. Для этого в лунки с инкубированными клетками добавляли 3 мкл N-ацетилцистеина (5 мМ) в соответствующей питательной среде и инкубировали в течение 4 ч, после этого вносили соединение и вычисляли значение IC50. Оказалось, что предварительная обработка N-ацетилцистеином снижает токсический эффект лактона L1.
Аналогичные результаты наблюдались и в случае оценки токсичности обоих алантолактонов в отношении клеток MS. В эксперименте с клетками аденокарциномы HCT116 в присутствии N-ацетилцистеина лактоны L1 и L2 показали снижение эффективности действия. ОБСУЖДЕНИЕ Известно, что эффективность большинства современных противоопухолевых препаратов связана с их способностью индуцировать гибель опухолевых клеток по пути апоптоза, в биохимической активации которого участвуют сигнальные пути белка р53 [7]. В связи с этим актуальным является поиск соединений, которые способны индуцировать в опухолевых клетках апоптоз в обход сигнальных путей белка р53. На основании проведенных экспериментов можно сделать вывод, что сигнальный путь р53 в механизме цитотоксичности лактона L2 является одним из основополагающих, а его изомер – алантолактон L1 индуцирует гибель клеток в обход сигнальных путей белка р53. Важную роль в индукции апоптоза играют активные АФК [8]. Известный ингибитор образования АФК– N-ацетилцистеин – был использован для выяснения роли вклада окислительного стресса, вызываемого действием соединений L1 и L2, в механизм гибели опухолевых клеток. Ранее в работе [9] было показано, что предварительная обработка различных опухолевых клеточных линий N-ацетилцистеином полностью сохраняет жизнеспособность клеток, указывая, что цитотоксическое действие изоалантолактона на клетки осуществляется в основном через генерацию АФК. По результатам проведенных экспериментов можно предположить, что в основе цитотоксической активности алантолактонов лежат механизмы, связанные не только с продукцией свободных радикалов и влиянием на окислительное повреждение липидов. В большинстве случаев антиоксидантный потенциал этих соединений не препятствует проявлению их цитотоксичности по отношению к клеточной линии HCT116. Участие АФК-зависимых механизмов в гибели клеток более выражено для линий MCF7 и MS, для которых цитотоксический эффект исследованных соединений в большей степени может быть предотвращён присутствием АФК-акцептора. Для клеток линии HCT116 такой закономерности не наблюдается. Пятичленные гетероциклы алантолактонов структурно родственны шестичленным лактонным циклам камптотецина, топотекана, иринотекана и других известных ингибиторов топоизомеразы I. Сесквитерпеновые лактоны обычно обладают антиоксидантным действием, а также проявляют хелатирующие и антирадикальные свойства [10]. Однако аланто- и изоалантолактоны в высокой концентрации (100 мкМ) обладают прооксидантными свойствами, что обнаружено методом ингибирования перекисного окисления липидов, индуцируемого ионами Fe3+. Тем не менее, при более низких концентрациях они оказывают защитное действие на клетки. Это показано при индукции окислительного стресса, вызванного пероксидом водорода (60 мкМ), и при токсическом стрессе под действием высокой дозы глутамата (30 мМ) на культуре клеток нейробластомы человека SK-N-MC. Наше исследование показало, что эти соединения перспективны для создания на их основе высокоэффективных антинеопластов. БЛАГОДАРНОСТИ В работе использовано оборудование Центра коллективного пользования ИФАВ РАН. Работа выполнена в рамках Госзадания 0090-2017-0018. ЛИТЕРАТУРА
|