К 40-летию Института физиологически активных веществ РАН
|
Сверхвысокомолекулярный полиэтилен (СВМПЭ) как основа клеточного матрикса для создания 3D клеточной культуры
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
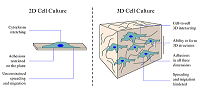
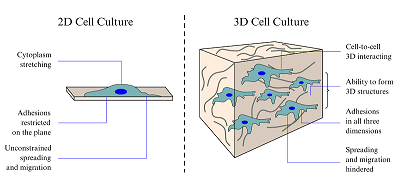
*e-mail: alexey@ipac.ac.ru Ключевые слова: моделирование 3D клеточных культур; полимеры; сверхвысокомолекулярный полиэтилен DOI: 10.18097/BMCRM00048 ВВЕДЕНИЕ Нейродегенерация и нейровоспаление являются ключевыми проблемами при различных хронических заболеваниях центральной нервной системы (ЦНС), таких как болезни Альцгеймера и Паркинсона, а также при различных нарушениях мозгового кровообращения [1,2]. Однако причины возникновения и молекулярные механизмы, ведущие к появлению нейродегенеративных процессов, остаются неизученными. Одним из методов изучения причин нейродегенеративных заболеваний и способов их лечения является работа с клеточными культурами, то есть живыми клетками вне организма. В настоящее время хорошо отработаны методы ведения клеточной культуры в классическом её проявлении в «двухмерном» пространстве, на плоской поверхности, что является ограничивающим фактором в способности воспроизводить среду, которая присутствует in vivo. Межклеточные взаимодействия являются жизненно важными для обеспечения биохимического гомеостаза, поэтому важна пространственная многоклеточная организация в среде, схожей с естественной средой в тканях. Ранее было показано, что трёхмерные (3D) клеточные системы приобретают всё больший интерес для разработки лекарственных средств и тканевой инженерии из-за их очевидных преимуществ в обеспечении более физиологически релевантной среды, особенно для тестов in vivo [3]. Причина, по которой клетки ведут себя по-разному при многих клеточных процессах, включая рост и пролиферацию, миграцию и инвазию, морфологию и чувствительность к лекарствам, кроется в дифференциальной экспрессии генов в 2D и 3D культурах [4,5]. Исследования показали, что транскрипционные и трансляционные изменения могут быть связаны с адаптацией клеточных линий [6]. Когда опухолевые клетки выделяли из их естественного 3D-окружения и культивировали in vitro, происходила перенастройка и адаптация клеток для новых 2D-условий путём изменений на транскрипционном и трансляционном уровнях (рис. 1).
Сравнение уровней экспрессии генов клеточных линиях, включающих рак молочной железы, толстой кишки, предстательной железы и легких, и их изначальных тканей показало, что примерно 30% генов по-разному экспрессируются в клеточных линиях in vitro [6]. Многие гены, которые способствуют быстрому росту и пролиферации клеток, а также те, которые позволяют клеткам реагировать на факторы в культуральной среде, часто усиливаются в клеточных линиях в условиях 2D культуры [3]. Экспрессия генов, ограничивающих рост и пролиферацию, репрессируется в 2D-адаптированных клеточных линиях по сравнению с их соответствующими тканевыми предшественниками: в раковых клетках толстого кишечника [7], рака груди [8], в опухоли лимфатической ткани [9], при лейкемии [10], рака лёгких [11], яичников [12] и простаты [13]. Это подтверждает наблюдение, что пролиферация клеток в 2D культурах быстрее по сравнению с 3D условиями [6]. Одна из причин отсутствия эффективных лекарственных средств для лечения нейродегенеративных расстройств связана с лимитированным набором моделей, которые используются при отборе активных соединений на стадии разработки. Как правило, клеточные исследования in vitro проводят в 2D формате, который по своей природе ограничивает межклеточные взаимодействия, морфологию, дифференцировку, выживаемость, сигнальные ответы, экспрессию генов и пролиферацию, наблюдаемых in vivo. Череду неудач при поиске лекарств можно объяснить несоответствием условий при отборе препарата на традиционной 2D модели, которая не обеспечивает трансляцию действия активного веществ в 3D окружение [14]. Следовательно, разработка 3D матрикса может обеспечить условия, максимально приближённые к среде in vivo, которые можно будет использовать для изучения молекулярных механизмов нейродегенеративных процессов, а также одновременно использовать данную систему для исследования функций нейроактивных веществ. 1. ТЕКУЩИЕ СТРАТЕГИИ РАЗВИТИЯ СВЕРХВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЭТИЛЕНА (СВМПЭ) К материалу клеточного матрикса предъявляются следующие требования: (1) материал должен быть биосовместимым/биоинертным; (2) материал должен давать возможность сформировать систему открытых связанных пор с целью обеспечения условий клеточной жизнедеятельности – «подвод» питания и кислорода, удаление продуктов жизнедеятельности, возможность осуществления межклеточных связей. Одним из лучших кандидатов на роль такого материала является сверхвысокомолекулярный полиэтилен (СВМПЭ). СВМПЭ обладает высокой биосовместимостью и необходимым комплексом физико-механических характеристик. На основе СВМПЭ возможно формирование различных пористых 3D структур. Недавние исследования показали перспективность разработки данных полимеров, где СВМПЭ потенциально может использоваться для изготовления пористых имплантатов, имитирующих пористую ткань [15]. СВМПЭ, помимо высокой биосовместимости и химической инертности, обладает способностью к изменению свойств в широких пределах благодаря формированию надмолекулярной структуры различного вида – в частности, модуль Юнга может меняться на 2 порядка (от 0.8 до 90 ГПа), предел прочности от 30 МПа до 3 ГПа, коэффициент трения снижается с 0.2 до 0.05 [16]. Кроме того, для СВМПЭ характерно проявление эффекта памяти формы [17]. Формирование пористой/ячеистой структуры в СВМПЭ в настоящее время осуществляется в основном путем спекания или горячего прессования порошкового сырья, в т.ч. с растворимыми солями, хотя данная технология ограничивает возможности по управлению формой ячейки (только квазиравноосная, сфероподобная) и толщиной стенки ячейки (сравнима с размером исходных частиц порошка). 2. ИССЛЕДОВАНИЯ 3D НЕЙРОНАЛЬНОЙ КУЛЬТУРЫ Распространённость исследований с использованием сложных пористых материалов для выращивания нейрональных клеток невелика, поскольку необходимо взаимодействие и синергия научных коллективов из разных отраслей науки. Группа химиков из США сообщает о подтверждении эффективности созданного ими 3D печатного материала на основе графена и полилактида-ко-гликолида – биосовместимого эластомера, который позволяет выращивать из плюрипотентных клеток нейрональные структуры, обладающие направленной проводимостью. Материал опробован при оперативном лечении повреждения позвоночника у крыс [18]. Есть сведения о неструктурированных 3D клеточных моделях, созданных путем направленной клеточной дифференцировки из hiPSCs в ростовой среде в отсутствие структурирующего агента и веществ, способствующих адгезии. В результате получаются структуры, названные человеческими кортикальными сфероидами, которые эффективно моделируют процессы, происходящие в нейрональных тканях [19]. Основная масса современных работ в области 3D культивирования нейрональной ткани посвящена созданию новых композитных гидрогелей на основе белковых компонентов с добавлением синтетических структур, способствующих направленному росту и дифференцировке культур по нейрональному типу, что достигается за счёт депонирования ростовых факторов в ячейках геля. Другая исследовательская группа из США (Wilmington, Delaware) работает над материалом, на основе которого возможно выращивание нейрональных 3D структур. Их изобретение – гидрогель на основе самоорганизующегося пептида MAX8, который в физиологических условиях образует в воде сеть с порами необходимой величины для выращивания клеточной культуры. Эксперименты были поставлены с использованием культуры клеток человеческой медуллобластомы – опухоли, возникающей в мозжечке в детском возрасте [20]. Однако эти работы выявили основной недостаток использования гидрогелей, который заключается в появлении некротических участков, формирующихся в результате затрудненного оттока отходов жизнедеятельности клеток, а также ограниченного доступа питательных сред. Группа исследователей из Университета Джорджа (Вашингтон), работая в области регенеративной медицины, создала материал на основе многослойных углеродных нанотрубок, встроенных в структуру полимера PEGDA, который печатается с помощью 3D принтера. Материал обладает высокой электропроводностью, что позволяет нейрональной культуре сохранять функциональность, присущую нервной ткани [21]. Работы китайских коллег сфокусированы на методе создания 3D нейрональных культур на углеродных нанотрубках (УНТ). Ими был предложен альтернативный материал, полученный путем смешивания модифицированных УНТ с раствором хитина. Материал хорошо зарекомендовал себя в экспериментах с культурами PC12 и RSC96, улучшал пролиферативные показатели и формирование дендритных сетей [22]. Однако был также выявлен токсический эффект использования УНТ для выращивания нейрональных культур. Корейские учёные, опираясь на опыт коллег по созданию эффективных 3D нейрональных культур на базе УНТ, создают свой композитный материал с добавлением гиалуроновой кислоты в качестве основы для гидрогеля. Кроме УНТ был использован полипиррол. Созданный ими материал способствовал нейронной дифференциации эмбриональных нервных стволовых клеток человека (hfNSC). В заключении учёные рекомендуют свои гидрогели и для регенеративных целей [23]. Европейские коллеги работают над созданием гибридного гидрогеля с использованием графена, который применяется для поддержки роста культивируемых клеток головного мозга и развивает их синаптическую активность [24]. Параллельно, другая группа учёных из США не только создала гидрогель под названием micro-TENN, но и осуществляет попытку моделировать продольный рост нейронов вдоль тяжа гидрогеля, что, по мнению авторов, позволит их разработке занять место в регенеративной медицине при повреждениях спинного мозга [25]. Ряд научных коллективов, занимающихся исследованием нейродегенеративных заболеваний на 3D моделях нейрональных культур, предпочитают коммерчески доступные гидрогели на основе самополимеризующихся белков, так как они обладают необходимым для культивирования нейрональной ткани объёмом пор. Однако и в этом случае не исключен токсический эффект [5], вызванный возможным взаимодействием клеточных культур с остатками белковых включений, ростовых факторов и других аспектов, связанных с приготовлением используемых гидрогелей [14]. Таким образом, создание 3D нейрональной культуры – очень востребованное направление, поскольку нейрональные клетки выполняют свои функции в мозге при тесном взаимодействии друг с другом. Рост клеток в 3D условиях различен и во многом естественен по сравнению с обычными условиями 2D культуры. В условиях 2D культуры клетки должны адаптироваться к плоской и твердой поверхности, что приводит к измененному клеточному метаболизму, биохимическим особенностям клеточного цикла, морфологии, функциональности и клеточным и физиологическим реакциям, по сравнению с нативными условиями в целых органах. Использование 3D нейрональной культуры снижает степень ограниченности in vitro моделей для отбора потенциальных лекарственных средств для лечения нейродегенеративных заболеваний, тем самым воспроизводя естественную среду для функционирования нейрональных клеток. Поэтому 3D клеточные модели значительно более релевантны с биологической точки зрения, что в целом является новым направлением в биологических исследованиях. 3. ИСПОЛЬЗОВАНИЕ СВМПЭ ДЛЯ СОЗДАНИЯ 3D КЛЕТОЧНОЙ КУЛЬТУРЫ Следует отметить, что принципиальным отличием СВМПЭ является его инертность, безопасность и нетоксичность, устойчивость к биоразложению, а также наличие разветвлённого матрикса для устойчивого роста и жизнедеятельности клеток. Стоит также отметить, что СВМПЭ обладает двумя важными оптическими свойствами, что делает его пригодным для анализа. Во-первых, он взаимодействует с линейно-поляризованным светом, что делает его пригодным для анализа с помощью ДИК-микроскопии. Во-вторых, материал инертен к лазерному облучению в диапазоне от 405 до 650 нм и поэтому это позволяет проводить исследование с использованием флуоресцентных меток и красителей, что является критическим при изучении динамики клеточных метаболизмов в реальном времени. Общий подход при подготовке клеточной культуры заключается в исследовании условий культивирования клеточных культур на 3D матрицах на основе СВМПЭ. Например, может быть использована культура нейробластомы человека SHSY5Y, в которой дифференцировка клеток по нейрональному типу при наличии нейрональных маркеров (нейрон-специфическая енолаза, синаптофизин) может служить характеристикой используемого материала. Также может быть использован нейротрофический эффект роста нейритов в изучаемых полимерах. Как нами было недавно показано в предварительных экспериментах на примере СВМПЭ с молекулярным весом ~5•106 г/моль, пористая структура, получаемая по технологии горячего прессования, позволяет проводить культивирование клеток нейробластомы человека SHSY5Y, что подтверждает перспективность использования 3D матриксов на основе СВМПЭ в нейробиологии. БЛАГОДАРНОСТИ Работы по изучению свойств полимеров выполнены при финансовой поддержке Российского научного фонда (№18-13-00145). Исследования клеточных моделей выполнены в рамках Государственного задания ИФАВ РАН (№0090-2017-0019) и Программы РАН (Тема № 48.8). При подготовке статьи использовалось оборудование Центра доклинических испытаний ИФАВ РАН и ЦКП ИФАВ РАН. ЛИТЕРАТУРА
|