К 40-летию Института физиологически активных веществ РАН
|
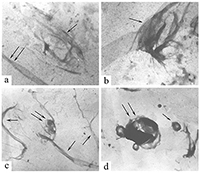
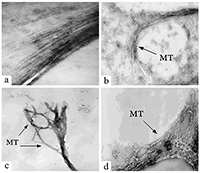
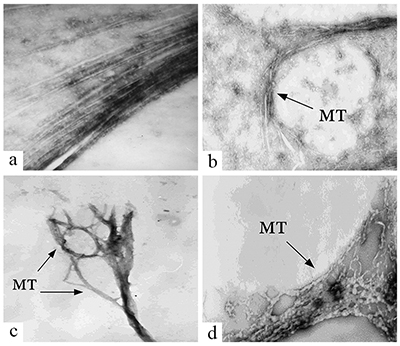
Влияние ионов металлов на микротрубочки как возможный механизм патогенеза болезни Альцгеймера Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1, *e-mail: pnshevtsov@gmail.com Ключевые слова: болезнь Альцгеймера; тубулин; микротрубочки; ионы металлов; ионы алюминия; фосфорилирование микротубуллярных белков DOI: 10.18097/BMCRM00050 ВВЕДЕНИЕ Болезнь Альцгеймера (БА) является одним из самых серьёзных заболеваний, широко распространенным в развитых и развивающихся странах мира. Приблизительное число заболевших БА – более 24 млн человек во всём мире. Причём, с увеличением возраста количество заболевших увеличивается экспоненциально: более чем 15-кратное увеличение наблюдается между 65 и 85 годами. Клинически БА представляет собой первичную дегенеративную деменцию, сопровождающуюся неуклонным прогрессированием нарушений памяти, интеллектуальной деятельности, высших корковых функций. Этиологические причины активно изучаются; есть значительное число работ и по генетической обусловленности ранних форм деменции альцгеймеровского типа, и по факторам генетической предрасположенности, связи с различными типами патологий и т.д. [1,2]. К одной из характеристик и широко признанных этиологических причин БА относится аномальное накопление в мозге ионов металлов, в частности, алюминия, железа и цинка, которые часто рассматриваются в качестве эколого-токсикологических факторов развития нейродегенеративных заболеваний [3,4]. Анализ аутопсийных проб из мозга больных БА выявил аномально высокие концентрации ряда ионов биогенных металлов в сенильных бляшках и нейрофибриллярных пучках, в частности, до 1 мМ Zn2+ и Fe3+ [5,6]. Алюминий, третий по распространенности элемент в земной коре и один из ключевых промышленных компонентов нашей повседневной жизни, также обнаружен в мозге больных как наследственной формой БА, так и при сенильной форме БА. Ряд эпидемиологических исследований показывают роль этого металла как фактора риска для развития нейродегенерации альцгеймеровского типа. В последнее время появились также данные об аномальном накоплении этого элемента в мозге больных аутизмом - заболевании, которое также связано с нейродегенеративными повреждениями мозга, и в настоящее время широко обсуждается вероятность того, что развитие этого заболевания у детей связано с использованием алюминия в адъювантах вакцин [7,8]. В мозге больных БА высокие концентрации алюминия обнаружены во внеклеточном пространстве в амилоидных бляшках [9], а также внутриклеточно; в частности, обнаружено его аномальное накопление в нейронах с нейрофибриллярными пучками [10]. 1.МИКРОТУБУЛЯРНАЯ ГИПОТЕЗА ПАТОГЕНЕЗА БОЛЕЗНИ АЛЬЦГЕЙМЕРА С нейрофибриллярными пучками связана так называемая микротубулярная гипотеза патогенеза БА, согласно которой нарушение микротубулярной системы нейронов мозга является одним из ключевых звеньев её патогенеза [11,12]. Эта гипотеза основывается на данных о значительном снижении количества микротрубочек (МТ), их длины и структуры в клетках мозга при БА, а также о гиперфосфорилировании белков, ассоциированных с микротрубочками (МАР от англ. microtubules associated proteins) – тау-белка и МАР2. Интересно, что снижение количества микротрубочек в мозге больных БА не всегда строго коррелирует с наличием нейрофибриллярных пучков [13]. Кроме того, в экспериментах in vitro обнаружено отсутствие процесса сборки МТ из тубулина (Тб) и МАР, выделенных из мозга больных БА [14]. В связи с этим актуальным является поиск патогенных факторов, способных вызывать эти аномалии микротубулярной системы, в том числе ингибирование сборки МТ, нарушение структуры МТ и гиперфосфорилирование МАР. Одним из факторов, способствующих развитию данных микротубулярных нарушений, могут быть накапливающиеся в мозге больных БА ионы металлов Al3+, Zn2+ и Fe3+ [3,4]. Для подтверждения этого предположения нами было проведено сравнительное исследование влияния ионов этих металлов на структуру МТ в процессе их сборки из Тб и МАР мозга крысы с данными по изменению структуры МТ в процессе их сборки из Тб и МАР мозга больных БА. Прежде всего необходимо было убедиться в достоверности факта снижения количества Тб в мозге больных БА. Тем более, что все предыдущие исследования были проведены на материале биопсии и только в лобной и теменной коре мозга, не затрагивая подкорковые структуры, в которых отмечены наиболее серьёзные изменения при БА – это лимбическая система, средний мозг. Учитывая это, мы провели исследования методом двумерного электрофореза в модификации O’Farell [15] некоторых областей аутопсийного мозга больных БА (71-78 лет) и лиц, не страдавших заболеваниями мозга (74-80 лет, контрольная группа) с целью выявления возможных изменений состава белков, входящих в состав МТ. Для исследования использовали лобную кору (поле 10 по Бродману), гиппокамп (лимбическая система), чёрную субстанцию (средний мозг), нижние оливы (продолговатый мозг). Нижние оливы были выбраны в качестве контроля, поскольку в продолговатом мозге не обнаружено явных морфологических признаков БА. В мозге больных БА было выявлено значительное снижение количества растворимого Тб в гиппокампе, лобной коре (поле 10) и в чёрной субстанции по сравнению контрольной группой. В нижней оливе количественных изменений растворимого Тб не обнаружено [16]. Долгое время существовало мнение о невозможности проведения in vitro сборки МТ при полимеризации Тб и MAP из мозга больных БА [14]. Однако, с нашей точки зрения, условия эксперимента у этих авторов не соответствовали особенностям белкового состава микротубулярной фракции в мозге при БА. Как известно из литературных данных и результатов, полученных нами методом двумерного электрофореза, количество Тб и MAP в мозге при БА значительно снижено. Учитывая это, мы изменили условия эксперимента, увеличив в пробе для полимеризации концентрацию общего белка с 7 мг/мл до 15 мг/мл (предполагая таким образом увеличить концентрацию Тб), также повысили концентрацию активатора полимеризации Mg2+ с 2 мМ до 6 мМ и увеличили время полимеризации с 1 ч до 6 ч. Внесение этих изменений позволило нам впервые провести in vitro полимеризацию Тб и MAP мозга больных БА и получить электронные микрофотографии образовавшихся МТ [17]. Анализ микрофотографий позволяет утверждать, что процесс сборки МТ в мозге больных БА, хотя и происходит, но значительно медленнее и с нарушениями структуры получившихся МТ. Если в норме МТ имеют строго упорядоченное расположение в виде длинных параллельных тяжей, то форма МТ, полученных в результате полимеризации Тб и МAР, выделенных из мозга больных БА, варьирует в широких пределах: от нормально ориентированных до попарноскрученных, находящихся в стадии разрушения, скручивающихся в клубки разной плотности или спутанных в пучки. Количество МТ уменьшено; при этом количество МТ нормальной структуры значительно меньше, чем МТ аномальной структуры. Сравнивая полученные нами микрофотографии с данными литературы, в которых изучались цитоморфологические изменения мозга больных БА, мы предполагаем, что зафиксированные на наших микрофотографиях клубкообразные структуры напоминают такой известный цитоморфологический признак БА, как нейрофибриллярные клубки, в которых присутствуют Тб и MAP, включая и гиперфосфорилированную форму тау-белка [12,18,19]. Таким образом, в мозге человека при БА значительно снижено количество Тб в гиппокампе, чёрной субстанции и коре (поле 10). Кроме того, в клетках мозга при БА нарушен процесс сборки МТ, в результате чего образуются дефектные МТ в виде колец, спутанных пучков, скрученных между собой МТ (рис. 1).
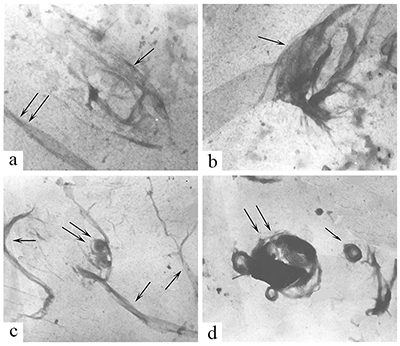
2. ВЛИЯНИЕ ИНОВ МЕТАЛЛА НА СБОРКУ И СТРУКТУРУ МИКРОТРУБОЧЕК Установив нарушение структуры МТ в мозге больных БА, мы, в соответствии с нашим предположением о возможной роли ионов металлов в этих нарушениях, провели исследование влияния ионов металлов на сборку и структуру МТ, выделенных из мозга крысы. Мы выбрали наиболее вероятных кандидатов на роль возможных патогенных факторов из всех исследованных в этом отношении ионов металлов - это ионы биометаллов железа и цинка, а также ионы алюминия. Как известно, ионы металлов крайне необходимы для нормального функционирования клеток. Среди всех белков, обеспечивающих внутриклеточные процессы, приблизительно половина относится к металлопротеинам [20]. К биометаллам, наиболее часто входящим в состав этих металлопротеинов, относятся ионы цинка и железа. Металлопротеины участвуют в обеспечении глобальных внутриклеточных процессов: регуляции экспрессии генов, синтезе энергии в митохондриях, передаче нервных импульсов в синапсе, обеспечении клеточной структуры, активности ферментов [21]. Дисбаланс в содержании биометаллов в мозге приводит к дисфункции нейронов и их гибели [22,23]. По данным литературы, ионы Al3+, Fe3+, Zn2+ способны нарушать сборку МТ [24-28]. Однако, данные по влиянию ионов Al3+ на полимеризацию Тб и МАР весьма противоречивы: одни авторы утверждают наличие у ионов Al3+ стимулирующего [26], а другие, наоборот, ингибирующего эффектов [28]. Оценка влияния ионов Zn2+ на полимеризацию Тб и МАР in vitro ранее проводилась только при высоких концентрациях ионов Zn2+ (500 мкМ), а для Fe3+ наши исследования были фактически первыми. Нами было показано, что в концентрациях от 10 мкМ до 500 мкМ все ионы металлов дозозависимо вызывают увеличение светопоглощения в in vitro тестах сборки микротрубочек. Однако это не связано с усилением образования нормальных микротрубочек – образующиеся структуры в значительной степени отличаются от структуры микротрубочек, представляющих собой длинные, однонаправленные параллельные тяжи, которые были выявлены в контрольных образцах (в отсутствии ионов металлов). При проведении полимеризации Тб и MAP в присутствии Al3+ были установлены нарушения структуры МТ, начиная с минимальной концентрации Al3+ – 10 мкМ (рис. 2). Наряду с параллельными МТ в большом количестве выявляются пучки, расщеплённые на отдельные деформированные, кольцеобразно закрученные МТ, кроме этого, отмечается появление бесформенных агрегатов. С повышением концентрации шло нарастание количества структур в виде пучков с хаотично направленными, спутанными, извитыми деформированными МТ, имеющими на своём протяжении утолщения различной формы и длины, образование кольцеобразных МТ, а при концентрациях выше 500 мкМ образовывались только агрегаты без признаков микротубулярных структур. В случае Zn2+ признаки нарушения структур МТ начинают обнаруживаться при концентрации 50 мкМ. Нарушения в структуре МТ заключаются в их укорочении, расщеплении на небольшие фрагменты, образовании спутанных пучков и, в конечном итоге, образовании аморфных агрегатов, которые превалируют в присутствии 500 мкМ Zn2+. Очевидная деформация структуры микротрубочек, образованных в присутствии Fe3+, наблюдается при ещё больших концентрациях – от 100 мкМ. В присутствии 250 мкМ Fe3+ наблюдается образование спутанных кольцеобразных клубков и пучков, а уже при 500 мкМ Fe3+ практически образуются только агрегаты и незначительное количество деформированных МТ [29].
Исследование ионов Al3+, Fe3+, Zn2+ на сборку и структуру МТ показало, что любой из исследованных нами металлов способен снижать количество нормальных микротрубочек. По степени деформирующего воздействия на микротубулярную систему клеток мозга и, соответственно, возможной значимости в патогенезе БА, ионы металлов можно расположить в следующей последовательности Al3+> Zn2+> Fe3+. Но, кроме нарушения структуры и собственно процесса сборки микротрубочек, важно было установить влияние этих металлов на одну из возможных причин этих аномалий и важный фактор патогенеза БА - гиперфосфорилирование MAP и, в частности, тау-белка. Именно с агрегацией гиперфосфорилированной формы тау-белка в наибольшей степени связан важный патоморфологический признак БА – нейрофибриллярные пучки. Нами было проведено исследование влияния ионов Al3+, Fe3+, Zn2+ в концентрации 10-500 мкМ на фосфорилирование Тб и МАР, выделенных из мозга крысы и сравнение с in vitro фосфорилированием Тб и МАР из мозга больных БА, проведенным впервые [30-32]. В результате было установлено, что все исследованные нами ионы металлов оказывали то или иное воздействие на фосфорилирование белков, входящих в состав МТ, но только в присутствии ионов Al3+ отмечается ингибирование фосфорилирования белковой зоны 94 кДа, и Тб (55 кДа), а также стимулирование фосфорилирования тау-белка (67 кДа), что практически полностью совпадает с фосфорилированием Тб и МАР из мозга БА. Сопоставление данных о нарушениях структуры МТ, наблюдаемых при сборке их из препаратов тубулина и MAP, выделенных как из мозга больных БА, так и из мозга крыс, но в присутствии ионов Al3+, Fe3+, Zn2+ подтверждают вывод о возможной роли этих металлов в нарушении структуры микротубулярного аппарата и, соответственно, в патогенезе БА. ЗАКЛЮЧЕНИЕ Таким образом, нарушения гомеостаза ионов Fe3+, Zn2+, их аномальное накопление в нейронах, и, даже в большей степени, накопление ионов Al3+, способны вызывать серьезные нарушения системы микротрубочек, подобные обнаруженным в мозге больных БА: снижение количества микротрубочек, нарушения структуры новых образующихся микротрубочек, аномальное фосфорилирование тубулина и MAP. Учитывая разнообразие функций, выполняемых МТ в клетке, нарушение структуры и количества МТ может быть причиной самых различных внутриклеточных биохимических аномалий и, в конечном счёте, может привести к развитию деструктивных процессов, гибели нейронов, нарушениям когнитивных функций. Эти знания могут способствовать поиску новых направлений в создании лекарственных препаратов, защищающих от действия этих патогенных факторов или способствующих восстановлению обнаруженных изменений микротубулярного аппарата клетки. БЛАГОДАРНОСТИ Работа выполнена в рамках Госзадания 0090-2017-0019 и при финансовой поддержке гранта РФФИ_16-03-00079. ЛИТЕРАТУРА
|