К 40-летию Института физиологически активных веществ РАН
|
Защита клеток нейробластомы SK-N-MC природными сесквитерпеновыми лактонами от повреждений, вызванных глутаматом и пероксидом
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
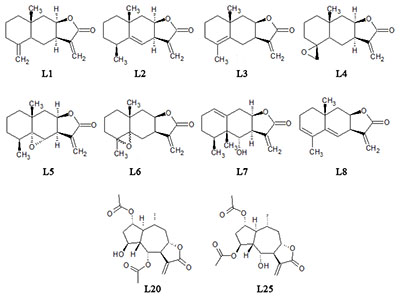
*e-mail: dubrovskaya@ipac.ac.ru Ключевые слова: сесквитерпеновые лактоны; нейробластома; пероксид; глутамат; ресазурин DOI: 10.18097/BMCRM00051 ВВЕДЕНИЕ Различные по происхождению нейродегенеративные заболевания имеют общие механизмы поражения клеток. Установлено, что дисбаланс, ведущий к накоплению активных форм кислорода (АФК), таких как супероксид-аниона, пероксида водорода (Н2О2) и гидроксил-радикала, ведет к окислительному стрессу, который вовлекается в развитие болезни Альцгеймера и болезни Паркинсона [1]. Показано, что накопление глутамата в клетке также индуцирует окислительный стресс, в частности, через поражение митохондрий в результате избыточного накопления Са2+ [2]. Исходя из этого, следует, что антиоксидантная терапия играет важную роль при лечении нейродегенеративных заболеваний [3]. Сесквитерпеновые лактоны – обширная группа вторичных метаболитов растений, обладающих широким спектром биологической активности: противовоспалительной, цитотоксической, кардиотонической, анальгезирующей, спазмолитической, гипогликемической, гипотензивной, антибактериальной, противогрибковой [4]. Они являются потенциальными лекарственными средствами для лечения нейродегенеративных заболеваний [5]. Многие лактоны обладают антиоксидантными свойствами и могут рассматриваться как экзогенные антиоксиданты [6]. Ранее было показано, что некоторые аминопроизводные сесквитерпеновых лактонов обладают антиоксидантными свойствами [7]. В данной работе исследовано защитное действие природных сесквитерпеновых лактонов, выделенных из растений семейства Asteraceae, на клетки нейробластомы человека SK-N-MC, подвергнутые окислительному стрессу, вызванному Н2О2, а также токсическому стрессу под действием высоких доз глутамата. Была исследована способность десяти природных лактонов восстанавливать жизнеспособность клеток нейробластомы при токсическом воздействии Н2О2 и глутамата. МАТЕРИАЛЫ И МЕТОДЫ В качестве исследуемых соединений были выбраны природные сесквитерпеновые лактоны, вторичные метаболиты растений рода девясил (Inula), а также их модифицированные производные (рис. 1). Из наземной части девясила британского (I. britannica) были выделены лактоны с гвайановым скелетом – иннучиненолид С (L20) и британин (L25) [8]. Эвдесманолиды – изоалантолактон (L01) и его изомер по положению двойной связи алантолактон (L02) выделены как основные компоненты корней девясила высокого (I. helenium). Лактоны L03 – L08 синтезированы путем химических трансформаций алантолактонов L01, L02 под действием кислот [9], в то же время в минорных количествах они выделены из растений рода Inula.
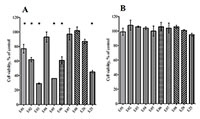
Культура клеток Клетки нейробластомы человека SK-N-MC (ATCC ® HTB-10™), культивировали в среде DMEM/F12 («Gibco», США) с добавлением 10% эмбриональной телячьей сыворотки («Gibco») и 1% смеси пеницилина/стрептомицина (НПП «ПанЭко», Россия) при 37°С в атмосфере СО2 (5%). Культура клеток получена из Института цитологии Российской Академии Наук. Клетки рассеивали в 96-луночный планшет (CELLTREATTM) в количестве 5.104/100 мкл. Через 24 ч к клеткам добавляли различные концентрации тестируемых соединений. Для индукции токсического стресса через сутки после обработки веществами в среду вводили глутамат в концентрации 25 мМ или Н2О2 в концентрации 60 мкМ и культивировали клетки еще 24 ч. Для каждой концентрации веществ эксперименты были выполнены в трех повторностях, и проведено не менее трех независимых экспериментов. Все вещества растворяли в ДМСО («PANREAC QUIMICA S.L.U.», Испания). Конечная концентрация ДМСО в лунке составляла 0.3% и была нетоксична для клеток. В контрольные лунки добавляли 0.3% ДМСО. Определение жизнеспособности клеток Выживаемость клеток определяли по тесту Alamar Blue с редокс активным флуоресцентным индикатором ресазурином (7-гидрокси-3Н-феноксазин-3-он-10-оксида натриевая соль, «Sigma-Aldrich», США) (в конечной концентрации 50 мкМ), восстановление которого оксидоредуктазами до резоруфина считается показателем жизнеспособности клеток [10]. Планшеты инкубировали в течение 2 ч при 37°С. Флуоресценцию восстановленного красителя определяли с помощью планшетного ридера Victor3 («PerkinElmer», США, возбуждение при 530 нм, эмиссия при 590 нм). За 100% выживаемости принимали значения флуоресценции резоруфина для интактных клеток в присутствии только растворителя. Выживаемость клеток при действии соединений выражали в процентах относительно контроля (контрольный образец содержал только растворитель). Значение концентрации, вызывающее 50% -ное ингибирование роста популяции клеток (IC50), было определено на основе дозозависисмых кривых с помощью программного обеспечения GraphPad Prizm 7. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Для определения концентрации токсических агентов, при действии которых 50% клеток будут жизнеспособны, клетки SK-N-MC были обработаны Н2О2 в диапазоне концентраций (300 мкМ - 6.25 мкМ) или глутаматом (160 мМ - 2.5 мМ) с последующей инкубацией в течение 24 ч при 37°С в атмосфере СО2(5%). Концентрация Н2О2, которая приводит к 50% гибели клеток, составила 56.6 мкМ, а концентрация глутамата - 19.09 мМ. В соответствии с этим, для дальнейших экспериментов была выбрана концентрация Н2О2 – 60 мкМ, глутамата – 25 мМ. Для определения нетоксической концентрации исследуемых сесквитерпеновых лактонов клетки SK-N-MC были обработаны лактонами в диапазоне концентраций 10 мкМ - 100 нМ при инкубации 48 ч при 37°С в атмосфере СО2(5%). Жизнеспособность клеток определяли по тесту с ресазурином. Концентрация лактонов 1 мкМ была выбрана для дальнейших исследований, так как при этой концентрации выживаемость клеток составляла практически 100% (рис. 2b). При обработке лактонами L03, L05 и L25 в концентрации 10 мкМ выживаемость клеток SK-N-MC значительно снижалась (рис. 2a).
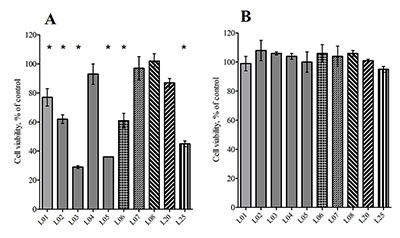
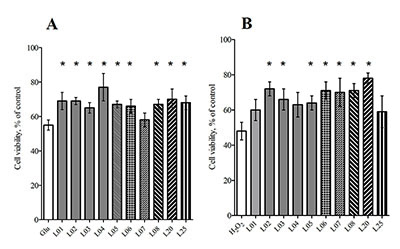
Предобработка клеток лактонами в концентрации 1 мкМ в течение 24 ч с последующей обработкой в течение 24 ч либо Н2О2 (60 мкМ), либо глутаматом (25 мМ) повышала выживаемость клеток SK-N-MC (рис. 3а,б). На рисунке 3 видно, что все исследованные лактоны в концентрации 1 мкМ повышают выживаемость клеток SK-N-MC при токсическом действии как Н2О2 (рис. 3б), так и глутамата (рис. 3а). При токсическом действии 60 мкМ Н2О2 (выживаемость клеток 48±5%) наибольшее защитное действие показано для лактонов L20 (78±3%) и L02 (72±4) (рис. 3б). Наименьший эффект проявляют лактоны L01 (60±6%) и L25 (59±9%) (рис. 3б). При токсическом действии 25 мМ глутамата (выживаемость клеток 55±3%) наибольшее защитное действие в концентрации 1 мкМ показано для лактона L04 (77±8%), немного меньше для лактонов L01 (69±5%), L02 (69±2%) и L20 (70±6%) (рис. 3а). Наименьший эффект проявляет лактон L07 (58±4%).
Как следует из приведенных выше данных, исследованные сесквитерпеновые лактоны обладают защитным действием в отношении окислительного повреждения клеток нейробластомы SK-N-MC, вызванного токсическим действием глутамата и пероксида водорода. Хотя сами сесквитерпеновые лактоны не обладают антиоксидантными свойствами, а в ряде случаев проявляют прооксидантные свойства [7], они способны активировать ферменты антиоксидантной защиты, такие как глутатион пероксидаза, супероксид дисмутаза, NQO1 и гамма-глутамилцистеин лигаза [11]. Все исследованные нами лактоны содержат активированную экзометиленовую группу в лактонном цикле, что обеспечивает возможность их связывания с тиольными группами цистеиновых остатков. Сигнальный путь Nrf2–Keap1 играет одну из основных ролей в цитопротекции при АФК-опосредованных нейродегенеративных заболеваниях, таких как болезни Альцгеймера, Паркинсона, Хаттингтона [12,13]. Предполагается, что и механизм антиоксидантной защиты сесквитерпеновых лактонов реализуется через активацию сигнального пути Nrf2–Keap1 путем связывания электрофильной α-метильной группы γ-лактона с богатой цистеиновыми остатками молекулой белка Keap1 (Kelch-like ECH-associated protein 1) [11,14]. Активация сигнального пути Nrf2–Keap1 приводит к гиперэкспрессии антиоксидантных ферментов и, соответственно, к цитопротекции, что мы и наблюдали для исследованного ряда природных сесквитерпеновых лактонов. Причем, стерически и конформационно затруднённые лактоны (например, L07 для глутаматной токсичности или L25 для оксидантного стресса вызванного гидропероксидом) показывают несколько меньшую цитопротекторную активность. Полученные данные подтверждают обсуждаемую в литературе возможность использования природных сесквитерпеновых лактонов в качестве потенциальных нейропротекторных соединений. ЗАКЛЮЧЕНИЕ Предварительная обработка клеток сесквитерпеновыми лактонами в концентрации 1 мкМ в течение 24 ч способна защищать клетки SK-N-MC от токсического стресса, вызванного воздействием 25 мМ глутамата и против оксидантного стресса под действием 60 мкМ Н2О2. БЛАГОДАРНОСТИ В работе использовано оборудование Центра коллективного пользования ИФАВ РАН. Работа выполнена в рамках Госзадания 0090-2017-0018. ЛИТЕРАТУРА
|