К 40-летию Института физиологически активных веществ РАН
|
Биоизостерные аналоги коричной кислоты в качестве потенциальных нейропротекторов
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1,
*e-mail: neganova83@mail.ru Ключевые слова: коричная кислота; нейропротекторы; нейродегенеративные заболевания; митохондрии; антиоксиданты DOI: 10.18097/BMCRM00052 ВВЕДЕНИЕ Высокий интерес исследователей к нейродегенеративным заболеваниям объясняется неутешительной статистикой заболеваемости, значительными социальными проблемами, с которыми сталкивается пациент, и отсутствием эффективных методов лечения данных состояний. Болезнь Альцгеймера (БА) является хроническим прогрессирующим заболеванием, характеризующимся значительными нарушениями когнитивных функций и патоморфологическими особенностями в мозге: внеклеточными амилоидными бляшками и внутриклеточными нейрофибриллярными пучками, основными компонентами которых являются скопления агрегатов амилоидного бета-пептида (Aβ) и агрегатов тау-белка, соответственно. Важно, что одним из значимых факторов риска для развития наиболее многочисленной спорадической формы заболевания является старение. Этот факт и наличие большого количества данных о нарушениях митохондриальных функций и окислительных повреждениях, которые обнаруживаются в мозге больных и животных моделей БА раньше проявлений основной симптоматики и специфических патоморфологических признаков, позволяют предположить триггерную роль дисфункции митохондрий и окислительного стресса в развитии нейродегенерации при БА [1,2]. При фармакологическом воздействии на вышеуказанные элементы ключевых этапов нейродегенерации можно приостановить прогрессирование заболевания. Таким образом, разработка веществ, направленно действующих на митохондриальные функции, может обеспечить терапевтические преимущества в борьбе с нейродегенеративными заболеваниями и возрастной деменцией. В качестве основы для создания таких потенциальных лекарственных средств мы выбрали биоизостерные аналоги коричной кислоты и производные полиметоксибензолов (вещества 1, 2, 3, 4, 5, 7 – аналоги коричной кислоты; 6, 8, 9, 10 – полиметоксибензолы). Производные коричной кислоты имеют широкий спектр биологической активности, включая контроль над воспалительными заболеваниями [3], гиполипидемическую активность [4] и улучшение депрессивного поведения у мышей, индуцированного стрессом [5]. Этот спектр активностей может иметь значение для лекарственных препаратов, направленных на лечение БА. Разнообразные производные полиметоксибензолов входят в состав эфирных масел растений, которые считаются перспективными пищевыми антиоксидантами [6]. МАТЕРИАЛЫ И МЕТОДЫ Материалы Химические соединения 1–10 были ситезированы в ИОХ им Н.Д.Зелинского РАН. Их структура и чистота были подтверждены данными элементного анализа, спектрами ЯМР1Н и масс-спектрами. Животные В экспериментах использовались самцы нелинейных беспородных крыс весом 200-220 г. Животных содержали в условиях стандартного вивария с 12-часовым световым режимом и свободным доступом к воде и пище. Все манипуляции с животными проводили в соответствии с решениями комиссии по Биоэтике ИФАВ РАН. В работе использовалось оборудование Центра коллективного пользования ИФАВ РАН. Влияние соединений на процесс перекисного окисления липидов гомогената мозга крыс Для оценки действия исследуемых веществ на процесс перекисного окисления липидов (ПОЛ) гомогената мозга крыс, спонтанного и инициируемого ионами Fe(III), был применен модифицированный вариант ТБК-теста в микропланшетном формате [7]. Измерения оптической плотности проводили на многофункциональном планшетном анализаторе Victor3 («PerkinElmer», США) при длине волны 540 нм. Данные нормировались по отношению к контролю (100%). Исследование влияния соединений на митохондриальные характеристики Митохондрии печени крыс выделяли стандартным методом дифференциального центрифугирования [8]. Трансмембранный потенциал митохондрий печени крыс измеряли по флуоресценции потенциал-зависимого индикатора сафранина О на планшетном анализаторе Victor3. Регистрировали флуоресценцию при λex=485 нм, λem=590 нм [9]. Процесс "набухания" митохондрий регистрировали спектрофотометрически в 96-луночных планшетах с прозрачным дном при 540 нм на планшетном анализаторе Victor3. В качестве индуктора "набухания" (скачка митохондриальной проницаемости) митохондрий использовали СаCl2 [10]. Скорость "набухания" определяли в программе Excel как dA540/dt. Данные нормировались по отношению к контролю (100%). Оценка цитопротекторного потенциала соединений Адгезивная перевиваемая клеточная линия нейробластомы человека (SH-SY5Y) была получена из Европейской коллекции клеточных культур (European Collection of Cell Cultures – ECACC, № 94030304). Клетки культивировали в среде DMEM/F12 («Gibco», США) с добавлением 10% эмбриональной телячьей сыворотки («Gibco», США) и 1% смеси пенициллина/стрептомицина («ПанЭко», Россия) при 37°С в атмосфере СО2 (5%). Культуру SH-SY5Y вели, не допуская монослоя, перевивая каждые 3-4 дня. Проводили не более 20 пассажей. Иономицин-индуцированная нейротоксичность Клетки нейробластомы человека (SH-SY5Y) рассевали в 96-луночный планшет (10000/лунку). Через 24 ч к клеткам добавляли различные концентрации тестируемых соединений. Для индукции токсического действия после обработки веществами в среду вводили иономицин в концентрации 2 мкМ и культивировали клетки еще 24 ч. Выживаемость клеток нейробластомы оценивали стандартным МТТ-тестом, который основан на способности дегидрогеназ живых клеток, в частности сукцинатдегидрогеназы, восстанавливать неокрашенные формы 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиума (МТТ-реагента) до голубого кристаллического формазана, растворимого в диметилсульфоксиде. МТТ-тест проводили по методике, описанной в работе [11], с небольшими модификациями. Количество восстановленного продукта измеряли фотометрически на планшетном анализаторе Victor3 по разнице светопоглощения пробы при длинах волн 540-620 нм. Данные нормировали по отношению к контролю (100%) и выражали в процентах. Статистический анализ результатов Каждый измеряемый параметр исследовали не менее чем в трех независимых экспериментах. Достоверность различий определяли с помощью GraphPad Prism версии 5.00 для Windows. Для сравнения двух групп (контрольной и в присутствии каждого соединения) применяли непарный t-критерий. Уровень достоверности был установлен на 95% (р<0.05), данные в графиках представлены как среднее значение ± ошибка среднего. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Исследуемые соединения В качестве тестируемых веществ в данной работе использовали биоизостерные аналоги коричной кислоты. Шифр и структурные формулы соединений представлены в таблице 1.
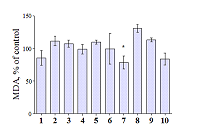
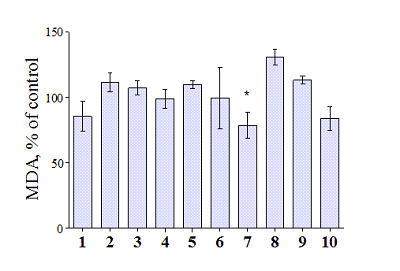
Антиоксидантная активность Изучение антиоксидантных свойств в ряду биоизостерных аналогов коричной кислоты и полиметоксибензолов проведено на модели ПОЛ гомогената мозга крыс (по стандартному ТБК-тесту). Окислительный стресс, неотъемлемым компонентом которого является процесс ПОЛ, играет важную роль в развитии многих заболеваний человека, в том числе и нейродегенеративных. В биологических системах реакции свободнорадикального окисления инициируются, главным образом, под действием активных форм кислорода и в присутствии ионов металлов переменной валентности. Важно отметить, что нарушения гомеостаза ряда ионов, в том числе ионов меди и железа, является характерной чертой нейродегенеративных заболеваний, в частности, БА. Анализ аутопсийных проб из мозга больных БА выявил аномально высокие концентрации ионов Cu2+ и Fe3+ в сенильных бляшках и нейрофибриллярных пучках – до 1 мМ [12,13]. В связи с этим нами были выбраны в качестве инициаторов ПОЛ ионы трехвалентного железа (Fe3+). Данные исследования антиоксидантных свойств биоизстерных аналогов коричной кислоты и полиметоксибензолов представлены на рисунке 1. Исследуемые производные проявляют незначительную антиоксидантную активность в данном тесте. Наиболее активным соединением оказалось вещество 7, которое достоверно ингибировало ПОЛ гомогената мозга крыс более чем на 20% относительно контроля (рис. 1).
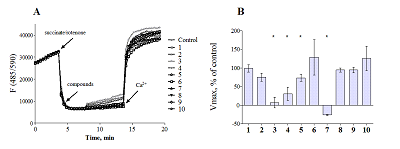
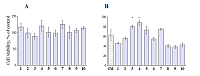
Влияние на митохондриальные характеристики Для предварительной оценки нейропротекторного потенциала и/или токсичности биоизостерных аналогов коричной кислоты и полиметоксибензолов было исследовано их влияние на мембранный потенциал митохондрий (ΔΨm) с потенциал-зависимым флуоресцентным зондом сафранин О при использовании ФАД-зависимого субстрата сукцината в присутствии ингибитора комплекса I дыхательной цепи ротенона. Также исследовано влияние соединений на изменение светопоглощения суспензии митохондрий в результате кальций-вызванного «набухания» митохондрий. Последний показатель характеризует влияние на процесс скачка митохондриальной проницаемости (mitochondrial permeability transition, MPT), являющегося ключевым этапом каскадов клеточной гибели. Такой набор тестов позволяет произвести оценку митохондриальной токсичности, поиск слабых разобщителей дыхательной цепи и ингибиторов MPT. На рисунке 2A показано влияние биоизостерных аналогов коричной кислоты и полиметоксибензолов на мембранный потенциал митохондрий печени крыс. Видно, что большинство веществ не влияют на трансмембранный потенциал, в то время как соединения 2, 3 и 4 деполяризуют мембрану при энергизации сукцинатом в присутствии ротенона, причём деполяризация развивается во времени, но не превышает 10% после 5 мин инкубации. Эти данные позволяют говорить об отсутствии значительной митохондриальной токсичности соединений. На рисунке 2B показаны данные нормированных значений скорости Са2+-индуцированного набухания митохондрий под действием всех тестируемых производных. Статистически значимые результаты отмечены звездочками (* - р<0.05). Энергизацию митохондрий в данном случае проводили сукцинатом калия в присутствии ингибитора комплекса I дыхательной цепи - ротенона. Конечная концентрация исследуемых соединений составляла 30 мкМ. Как видно из представленной диаграммы, соединения 3 - 5 и 7 достоверно подавляют процесс "набухания" митохондрий, причём в присутствии веществ 3 , 4 и 7 в концентрации 30 мкМ наблюдается высокая (более 50%) степень ингибирования открытия поры скачка митохондриальной проницаемости. Если для соединений 3 и 4 , вызывающих также слабую деполяризацию митохондрий, этот эффект может быть связан со снижением потенциал-зависимого входа кальция в митохондрии, то в случае соединения 7 возможно непосредственное ингибирование пор МРТ.
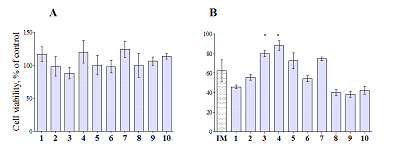
Цитопротекторные свойства На следующем этапе нашей работы мы изучили влияние исследуемых соединений на выживаемость нейрональной культуры клеток (нейробластомы SH-SY5Y) с целью выявления собственной цитотоксичности и потенциального цитопротекторного действия при иономицин-индуцированной гибели клеток. Одной из причин гибели нейронов при разных сценариях нейротоксичности (гипоксия, эксайтотоксичность, β-амилоидная токсичность и т.п.) является аномальное повышение внутриклеточной концентрации Са2+. Кальциевый ионофор иономицин применяется для обеспечения нерегулируемого входа ионов кальция в клетку, моделируя кальциевый стресс как причину гибели клетки, и широко используется для изучения влияния соединений на выживаемость клеток. Жизнеспособность клеток измеряли по стандартной методике МТТ-теста. Все исследуемые соединения не оказывали заметного собственного токсического действия на культуру клеток нейробластомы (рис. 3А). При индукции нейротоксичности иономицином, связанной с кальциевым стрессом, для соединения 7 наблюдалась тенденция нейропротекторного эффекта (p=0.065), а соединения 3 и 4 достоверно увеличивали количество выживших клеток (рис. 3B). Таким образом, соединения 3, 4 и 7 могут представлять интерес как скаффолды для создания новых потенциальных нейропротекторов.
ЗАКЛЮЧЕНИЕ В результате проведенных исследований среди биоизостерных аналогов коричной кислоты и полиметоксибензолов была выделена группа веществ-лидеров: 3, 4 и 7. Данные соединения не проявляют собственной токсичности и оказывают нейропротекторный эффект на клеточной модели нейродегенерации, связанной с кальциевым стрессом. Механизм их цитопротекторной активности, возможно, обусловлен влиянием на функции митохондрий, поскольку эти соединения эффективно подавляют кальций-индуцированный процесс МРТ. Кроме того, одно из исследованных веществ (7) обладает антиоксидантными свойствами, проявляя способность к ингибированию ПОЛ гомогената мозга крыс, что может быть дополнительным механизмом нейропротекторного эффекта. Полученные данные позволяют рекомендовать данные вещества в качестве основы для создания эффективных нейропротекторных препаратов, способных повлиять на ранние стадии развития нейродегенеративных заболеваний. БЛАГОДАРНОСТИ Работа выполнена в рамках Госзадания 0090-2017-0019 и при финансовой поддержке гранта РФФИ_16-03-00079. ЛИТЕРАТУРА
|