|
Усиление сигнала SPR биосенсора с помощью золотых наночастиц на примере анализа бета-2-микроглобулина человека Научно-исследовательский институт биомедицинской химии имени В.Н.Ореховича, 119121, Москва, Погодинская ул. 10;*e-mail: pavel79@inbox.ru Ключевые слова: поверхностный плазмонный резонанс; оптический биосенсор; усиление сигнала; золотые наночастицы; белок-белковые взаимодействия DOI: 10.18097/BMCRM00053 ВВЕДЕНИЕ
В настоящее время появляются и быстро развиваются новые сенсорные технологии детекции различных биомаркеров для диагностических целей. Одной из наиболее перспективных является технология поверхностного плазмонного резонанса (SPR) [1]. Биосенсоры на эффекте SPR обладают рядом существенных преимуществ, такими как универсальность принципа анализа любых аналитов, линейный динамический диапазон анализа, более высокая точность и воспроизводимость по сравнению с ИФА (коэффициент вариации определения концентрации целевого белка в сыворотке крови < 1.5% в одной серии и < 3% в разных сериях) и высокая степень автоматизации. Однако существующая общая для всех методов регистрации проблема ограничения достоверного обнаружения низких концентраций биомаркера в сыворотке крови при прямой регистрации его взаимодействия со специфическим моноклональным антителом (> 1 нМ) актуальна и для SPR биосенсоров. В то же время содержание важных для биомедицины биомаркеров в плазме крови, как правило, на порядки ниже (0.1 – 100 пМ). Поэтому повышение чувствительности SPR биосенсоров для разработки новых методов диагностики на сегодня является одной из актуальных задач. Известны различные подходы для усиления SPR сигнала: золотые наночастицы [2], «сандвич»–схема с двумя антителами [3-5], самоформирующиеся монослои и «сандвич»–схема [6,7], латексные частицы [8], сопряженная ферментативная реакция преципитации [9]. Применение наночастиц для усиления сигнала оптического SPR биосенсора представляется особенно перспективным подходом, так как величина сигнала биосенсора прямо пропорциональна массе аналита, взаимодействующего с иммобилизованным на поверхности оптического чипа лигандом. Поэтому утяжеление молекул аналита путем их селективной конъюгации с наночастицами может значительно (на порядки) усилить сигнал и, соответственно, понизить детектируемый порог концентраций биомаркера. Целью данной работы являлось описание протокола детекции белков в низкой концентрации на базе оптического SPR биосенсора с использованием золотых наночастиц. MАТЕРИАЛЫ И МЕТОДЫ Реактивы и препараты белков Следующие растворы и реагенты были получены от «GE Healthcare» (США): (1) HBS-EP+ буфер (150 мМ NaCl, 3 мМ ЭДТА, 0.005% детергента P20, 10 мМ HEPES, pH 7.4); (2) 10 мМ ацетатный буфер, pH 5.0; (3) 10 мМ глицин-НСl (pH 2.5); (4) набор реагентов для ковалентной иммобилизации лигандов за аминогруппы: EDC (1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид), NHS (N-гидроксисукцинимид), 1 М этаноламин-HCl (pH 8.5); (5) бета-2-микроглобулин человека (B2M); (6) поликолональные антитела кролика (Pab) к B2M; (7) моноклональные антитела мыши (Mab) к B2M. Бычий сывороточный альбумин (БСА) был получен от «Сalbiochem» (США). Реактивы для синтеза золотых наночастиц были получены от «Sigma Aldrich» (США): (1) тетрахлораурат водорода (HAuCl4•3H2O); (2) цитрат натрия (C3H4OH(COONa)3•2H2O); (3) боргидрид натрия (NaBH4). Другие реактивы и препараты аналитической чистоты были получены от отечественных поставщиков. Протокол синтеза золотых наночастиц (GNP) [10]
Протокол получения конъюгатов поликлональных антител (Pab) с золотыми наночастицами (Pab/GNP)
Определение концентрации золотых наночастиц, конъюгированных с Pab Концентрация золотых наночастиц в суспензии была определена на спектрофотометре NanoDrop 1000 («Thermo Scientific», США) при длине волны 520 нм. Ковалентная иммобилизация моноклональных антител мыши (Mab) к B2M на поверхности оптического чипа Иммобилизация Mab и регистрация белок-белковых взаимодействий были выполнены на оптическом биосенсоре Biacore 3000 («GE Healthcare», США) с использованием чипа CM5, покрытого карбоксиметилированным декстраном. Mab иммобилизовали согласно стандартному протоколу иммобилизации за аминогруппы белка [11]. Протокол иммобилизации Mab
В таблице 1 в качестве примера представлен пошаговый протокол работы оптического биосенсора Biacore 3000 при выполнении процедуры иммобилизации Mab. В данном протоколе отражены все начальные установки биосенсора и последующие их изменения, а также все выполняемые операции.
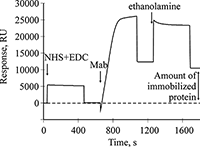
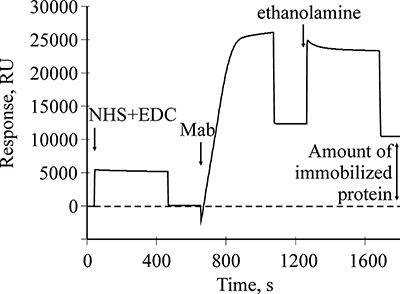
На рисунке 1 представлена соответствующая сенсограмма иммобилизации Mab. Стрелками указаны моменты начала инжекций растворов в соответствии с протоколом. Инжекция смеси NHS/EDC активирует карбоксильные группы на поверхности чипа.
При инжекции раствора Mab происходит иммобилизация антител на поверхности чипа путем формирования амидных связей между аминогруппами белка и карбоксильными группами карбоксиметилированного декстрана. Не вступившие в реакцию активные группы на поверхности чипа инактивируются раствором этаноламина. В результате выполнения данного протокола количество иммобилизованного белка составило 10486 RU (резонансные единицы), а 1 RU соответствует связыванию примерно 1 пг белка на 1 мм2 поверхности оптического чипа. Регистрация белок-белковых взаимодействий
Пошаговый протокол всех выполненных операций и установок биосенсора для регистрации белок-белковых взаимодействий представлен в таблице 2.
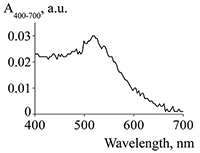
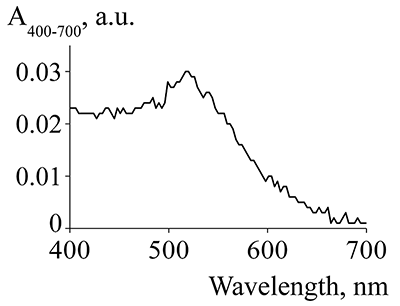
Оптический биосенсор был термостатирован при 25°С, а в качестве рабочего буфера использовали HBS-ЕР+ буфер. Все инжекции растворов выполнялись в режиме QuickInject при скорости потока 10 мкл/мин. Взаимодействие B2M (100 пМ) с иммобилизованными на чипе Mab регистрировалось в течение 5 мин. Последующее усиление сигнала по «сандвич»-схеме при инжекции Pab или конъюгата Pab/GNP регистрировалось в течение 3 мин. Регенерация поверхности чипа выполнялась при инжекции 10 мМ глицин-HCl (рН 2.5) в течение 30 с при скорости потока 10 мкл/мин. Канал биосенсора без иммобилизованного белка использовался в качестве контрольного для коррекции эффектов неспецифической сорбции белкового материала на поверхности чипа путем вычитания сигнала контрольного канала из сигнала рабочего канала. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Определение концентрации золотых наночастиц в суспензии Измерение оптической плотности суспензии GNP и конъюгатов Pab/GNP было выполнено на спектрофотометре NanoDrop 1000. На рисунке 2 показан спектр поглощения образца суспензии GNP в концентрации 20 мкг/мл, из которого следует, что присутствует характерный для коллоидного золота пик поглощения при длине волны 520 нм.
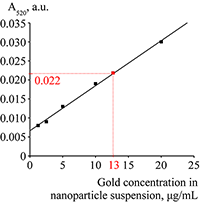
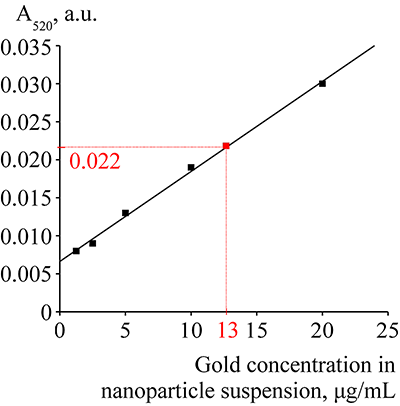
На основе значений оптической плотности при 520 нм для разных концентраций золотых наночастиц (от 1 до 20 мкг/мл) был построен калибровочный график (рис. 3). По данному калибровочному графику была определена концентрация суспензии конъюгатов Pab/GNP, которая составила 65 мкг/мл. Образец для спектрофотометрирования готовили путем разведения исходной суспензии в 5 раз.
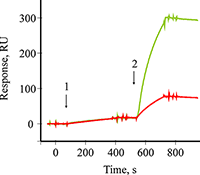
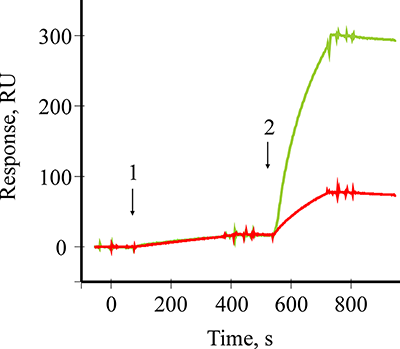
Усиление сигнала биосенсора с помощью Pab и конъюгатов Pab/GNP Усиление сигнала биосенсора по «сандвич»-схеме с помощью конъюгатов Pab/GNP осуществляли путем последовательных инжекций раствора B2M и суспензии конъюгатов Pab/GNP через канал биосенсора с иммобилизованными Mab. На рисунке 4 показаны две совмещенные сенсограммы связывания B2M (стрелка 1) с иммобилизованными на чипе Mab и усиление сигнала биосенсора по типу «сандвич» при инжекции растворов (стрелка 2) Pab (красная сенсограмма) или конъюгатов Pab/GNP (зеленая сенсограмма). Как видно из рисунка, возрастание сигнала после образования тройного комплекса Mab-B2M-Pab составило 55 RU, в то время как при образовании комплекса Mab-B2M-Pab/GNP сигнал вырос до 285 RU (примерно в 5 раз).
ЗАКЛЮЧЕНИЕ На примере бета-2-микроглобулина (В2М) в качестве модели биомаркера и двух типов антител (поликлональных и моноклональных) к нему описан высокочувствительный метод детекции низких концентраций В2М с помощью усиления сигнала SPR биосенсора с использованием золотых наночастиц. Данный принцип анализа носит универсальный характер и может быть успешно применен для детекции любых белковых биомаркеров. Стоит отметить, что для анализа биомаркеров в предельно низкой концентрации требуется значительное время для их связывания с первым антителом (до 1 ч и более), и поэтому более целесообразно использовать схему анализа по принципу «обратного сандвича», когда конъюгат Pab/GNP добавляется в образец сыворотки крови и инкубируется в течении 1 ч. За время инкубации в пробе происходит формирование комплекса биомаркер-Pab/GNP. Затем смесь инжектируется через канал биосенсора с иммобилизованным Mab, где и происходит быстрое формирование конечного «сандвича» Mab-биомаркер-Pab/GNP с регистрацией усиленного золотыми наночастицами SPR сигнала. Данный протокол подробно описан нами на примере анализа крайне низких концентраций кардиомиоглобина в сыворотке крови человека [5]. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы. SPR измерения выполнены на оборудовании ЦКП «Протеом человека» при ИБМХ, поддержанном Минобрнауки РФ в рамках соглашения №14.621.21.0017 (идентификатор RFMEFI62117X0017). ЛИТЕРАТУРА
|