|
Использование SPR биосенсора при поиске прототипов лекарственных средств на примере цитохрома Р450(51) в качестве белка-мишени
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Россия, 119121, Москва, Погодинская ул. 10
;*e-mail: la-kaluzhskiy@yandex.ru Ключевые слова: поверхностный плазмонный резонанс (SPR); скрининг; цитохром Р450(51) человека; прототипы лекарственных средств DOI: 10.18097/BMCRM00055 ВВЕДЕНИЕ За последнее время создание интегрированной платформы «от гена до прототипа лекарства», объединившей компьютерные, биоинформатические и экспериментальные подходы, позволило значительно ускорить и оптимизировать процессы поиска базовых структур для создания новых лекарственных препаратов. Компьютерное моделирование, виртуальный скрининг и предсказание свойств будущего лекарственного препарата позволяют значительно сократить время и стоимость начальной стадии разработки нового лекарства [1]. Полученную выборку соединений, которые, согласно компьютерному моделированию, могут взаимодействовать с молекулярной мишенью, необходимо тестировать в реальных экспериментах in vitro с использованием чувствительных и высокопроизводительных технологий. Поверхностный плазмонный резонанс (SPR) является методом первого выбора для решения подобных задач, поскольку позволяет регистрировать факт физического взаимодействия соединения с белком-мишенью в режиме реального времени и определять константы скоростей ассоциации и диссоциации комплексов, равновесную константу диссоциации комплекса (Kd) и даже термодинамические параметры процесса. В данной статье рассматриваются методические аспекты применения оптического SPR биосенсора для поиска прототипов лекарственных средств на примере цитохрома Р450(51) человека, катализирующего ключевую стадию биосинтеза холестерина. МАТЕРИАЛЫ И МЕТОДЫ В качестве молекулярной мишени был использован препарат рекомбинантного цитохрома Р450(51) человека (CYP51A1) ( > 95% чистоты по данным электрофореза в полиакриламидном геле в денатурирующих условиях). Белок был получен и очищен по протоколу, описанному ранее [2]. Низкомолекулярные соединения, использованные в работе, получены согласно ранее опубликованным протоколам [3-11]. Следующие реактивы были получены от фирмы-производителя оборудования («GE Healthcare», США): HBS-N буфер (150 мМ NaCl, 10 мМ HEPES, pH 7.4), 1-этил-3-(3-диметиламинопропил)карбодиимид-HCl (EDC), N-гидроксисукцинимид (NHS), ацетатные буферы (10 мМ ацетат натрия, pH 4.0, 4.5, 5.0, 5.5), 1 M этаноламин-HCl (pH 8.5). Остальные реактивы аналитической чистоты были получены от отечественных поставщиков. Поверхностный плазмонный резонанс (SPR) SPR анализ был выполнен с применением оптического биосенсора Biacore 3000 («GE Healthcare»). В работе были использованы оптические чипы типа СМ5 («GE Healthcare»), поверхность которых покрыта карбоксиметилированным декстраном для ковалентной иммобилизации белка-лиганда путем образования амидных связей между карбоксильными группами декстрана и свободными аминогруппами белков. В качестве рабочего буфера был использован буфер HBS-N. Все измерения проводили при температуре 25ºС. Полученные сенсограммы представляли собой запись сигнала биосенсора в реальном времени в резонансных единицах RU (1 RU соответствует 1 пг белка на поверхности оптического чипа). Результирующий сигнал биосенсора представлял собой разницу между рабочим (с иммобилизованным белком-лигандом) и контрольным (без белка) каналами биосенсора. Значения констант скорости ассоциации и диссоциации комплексов, а также Kd комплексов вычислялись с использованием лицензионной компьютерной программы Biacore BIAevaluation v.4.1 («GE Healthcare»). Выбор иммобилизационного буфера Для выбора оптимального значения pH иммобилизационного буфера были приготовлены образцы растворов CYP51A1 концентрации 20 мкг/мл в 10 мМ ацетатных буферах с pH 4.0, 4.5, 5.0, 5.5. Они были инжектированы в течении 2-х мин при скорости потока 5 мкл/мин для оценки уровня преконцентрирования белка у поверхности чипа СМ5. При этом активация поверхности чипа смесью EDC/NHS не проводилась. После каждой инжекции поверхность чипа промывали 50 мМ NaOH в течении 30 с при скорости потока 35 мкл/мин. Ковалентная иммобилизация CYP51А1 на оптическом чипе СМ5 Согласно протоколу ковалентной иммобилизации белков за аминогруппы [3-5] были последовательно выполнены следующие процедуры: (1) активация карбоксильных групп декстрана чипа СМ5 инжекцией смеси равных объёмов 0.2 M EDC и 0.05 M NHS в течении 7 мин при скорости потока 5 мкл/мин, (2) инжекция раствора белка-лиганда в иммобилизационном буфере (20 мкг/мл раствор CYP51A1 в 10 мМ ацетатном буфере с pH 5.0) в течении 10 мин при скорости потока 5 мкл/мин, (3) инактивация непрореагировавших с белком активированных карбоксильных групп декстрана путем инжекции 1 М этаноламина-НCl (pH 8.5) в течение 1 мин при скорости потока 5 мкл/мин. Подготовка образцов низкомолекулярных соединений для скринингового SPR анализа Маточные 3 мМ растворы исследованных низкомолекулярных соединений готовили путем их растворения в диметилсульфоксиде (DMSO). Рабочие растворы соединений получали разведением маточных растворов рабочим буфером HBS-N до концентрации 30 мкМ. При этом конечное содержание DMSO в анализируемых образцах составляло 1%. Для минимизации скачкообразного сдвига сигнала биосенсора (так называемого балк-эффекта) при инжекции тестовых образцов, обусловленного разницей коэффициентов преломления образца и рабочего буфера, в последний добавляли DMSO до конечной концентрации 1%. Образцы последовательно инжектировали в течение 6 мин при скорости потока 10 мкл/мин. После инжекции каждого образца проводили двукратную промывку рабочего и контрольного каналов биосенсора регенерирующим раствором (2 М NaCl, 0.4% масса/объём CHAPS) в течение 17 с при скорости потока 35 мкл/мин. Анализ выполнялся в автоматическом режиме по следующему протоколу, записанному в управляющей программе биосенсора Biacore 3000 Control Software v4.1 («GE Healthcare»), в подпрограмме «New Application Wizard – Customized Application»:
SPR анализ аффинности и термодинамических параметров взаимодействия между белком-мишенью и выявленным при скрининге позитивным тестовым соединением Промежуточный раствор низкомолекулярного соединения готовили путем разведения маточного раствора HBS-N буфером до концентрации 100 мкМ (содержание DMSO составляло 3.33%). Из данного раствора готовили серию тестовых образцов с концентрациями соединения в диапазоне 1 - 100 мкМ. Для выравнивания коэффициента преломления (Ri) каждого образца из серии и рабочего буфера биосенсора применяли следующую последовательность действий с использованием прецизионного рефрактометра RX-5000 («ATAGO», Япония):
Далее готовили все образцы серии с различной концентрацией низкомолекулярного соединения путем разбавления промежуточного раствора (100 мкМ) с использованием рабочего буфера, в который был добавлен DMSO. Содержание DMSO в рабочем буфере вычисляли с помощью поправочного коэффициента по формуле 2:
Полученную серию образцов последовательно инжектировали через рабочий и контрольный каналы биосенсора в течение 6 мин при скорости потока 10 мкл/мин с последующей регистрацией диссоциации комплекса в течение 6 мин. После окончания каждой инжекции осуществляли двукратную промывку каналов биосенсора регенерирующим раствором (2 М NaCl, 0.4% масса/объём CHAPS) в течении 17 с при скорости потока 35 мкл/мин. Анализ выполнялся в автоматическом режиме согласно следующему протоколу, записанному в управляющей программе биосенсора Biacore 3000 Control Software v4.1 («GE Healthcare»), с помощью подпрограммы «New Application Wizard – Customized Application»:
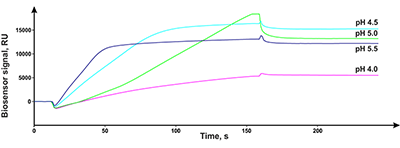
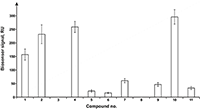
Для измерения термодинамических параметров взаимодействия описанный выше SPR анализ серии образцов с разной концентрацией тестового соединения многократно повторяли при рабочих температурах в диапазоне 10-40°С с шагом в 5 градусов. Полученная температурная зависимость Kd низкомолекулярного соединения с белком-мишенью была использована для построения зависимости Вант-Гоффа, из которой вычислялись значения изменения свободной энергии Гиббса (ΔG), энтальпии (ΔН) и энтропии (ΔS) [12,13] РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Выбор иммобилизационного буфера Все белки-мишени отличаются по эффективности иммобилизации на оптических чипах СМ из-за разных значений их изоэлектрических точек, поэтому для оптимизации условий иммобилизации выполняли процедуру так называемого рН скаутинга, представляющую собой экспериментальный подбор оптимального значения рН иммобилизационного буфера, при котором наблюдается максимальное преконцентрирование белка у поверхности чипа. На рисунке 1 в качестве примера показан результат рН скаутинга для CYP51A1. Видно, что максимальная преконцентрация наблюдалась в 10 мМ ацетатном буфере при рН 5.0.
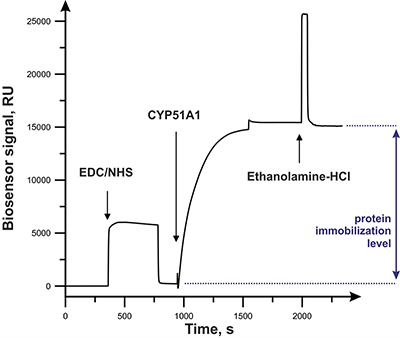
Иммобилизация CYP51A1 на поверхности оптического чипа СМ5 Согласно сложившейся практике по выбору типа оптического чипа для иммобилизации белковых молекул, принимают во внимание необходимый уровень массы иммобилизованного белка на поверхности чипа. Так, для проведения скрининговых исследований с низкомолекулярными аналитами с молекулярной массой меньше 1 кДа уровень иммобилизации белка-лиганда должен быть достаточно высоким (от 5000 до 15000 RU). Это необходимо для обеспечения максимальной чувствительности при регистрации взаимодействий. Поэтому в данном случае предпочтение отдавалось выбору чипа CM5, поверхность которого содержит наибольшее число карбоксильных групп. На рисунке 2 приведена типичная сенсограмма иммобилизации белка-мишени (на примере CYP51A1) на карбоксиметилдекстрановой поверхности чипа СМ5.
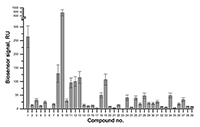
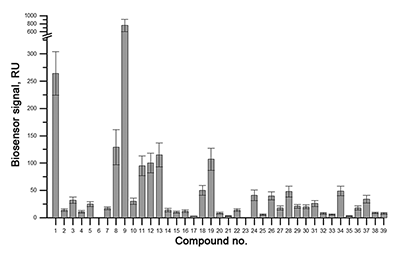
Скрининговый анализ взаимодействия выборки низкомолекулярных соединений с иммобилизованным на чипе CYP51А1 Из опыта наших работ [3-5] мы сделали вывод, что для выполнения SPR скрининга оптимально использовать растворы тестовых соединений с концентрацией 30 мкМ. Для различных моделей SPR биосенсоров существует разный порог детекции низкомолекулярных соединений по минимальной молекулярной массе. В нашей работе был использован оптический биосенсор Biacore 3000, для которого данный порог составляет 150 Да. Молекулярная масса всех тестовых соединений была больше указанного порога. При анализе результатов SPR скрининга важным моментом является выбор уровня отсечки, т.е. величины сигнала биосенсора, при превышении которой результат теста при инжекции раствора тестового соединения считается позитивным. Выбор оптимального порога отсечки определяет эффективность скрининга - при снижении значения отсечки чувствительность теста растет, а специфичность, следовательно, снижается. В экспериментах с CYP51А1 уровень значимого порога отсечки был установлен 15 RU, что значительно превышает уровень шума и скорость дрейфа сигнала биосенсора. При повторных измерениях коэффициент вариации (СV) снижался с 10% до 2.5%. На рисунке 3 показаны результаты скрининга выборки 39 низкомолекулярных соединений (гликозидов, выделенных из экстрактов морских животных и растений) и природного субстрата CYP51А1 (ланостерола), для которого ранее были получены кристаллографические данные и определены сайты связывания с молекулой белка [2]. Позитивный результат взаимодействия с CYP51A1 показал 21 образец. Последующий анализ аффинности выявленных взаимодействий показал, что у 19 соединений значения Kd находятся в диапазоне 1 – 100 мкМ, а одно соединение связывалось с CYP51A1 с Kd приблизительно 0.27 мкМ. Последующий анализ данных комплексов с помощью технологии спектрального титрования показал, что данные соединения не взаимодействуют с активным центром CYP51A1, что свидетельствует о наличии сайта связывания подобных соединений на поверхности белковой молекулы [4].
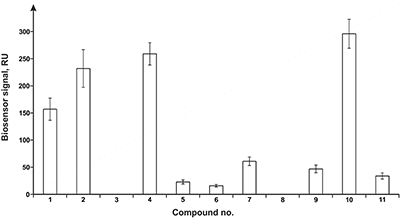
На рисунке 4 показан другой пример SPR скрининга выборки из 11 соединений стероидной природы на их способность взаимодействовать с CYP51A1. Был получен позитивный результат для 9 соединений. Для данных комплексов значения Kd оказались в диапазоне 0.1 – 10 мкМ [5].
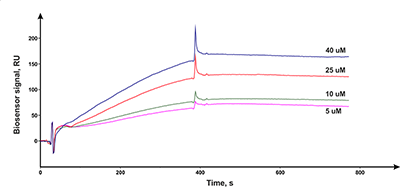
На рисунке 5 в качестве примера показана серия сенсограмм, полученная для взаимодействия разных концентраций левискулозида G (соединение 6 на рис. 4) с CYP51A1. Из данного набора сенсограмм рассчитывали величину Kd с использованием теоретической модели поверхностного связывания Лэнгмюра (1:1). Для данного соединения значение Kd составило 0.65 мкМ [5].
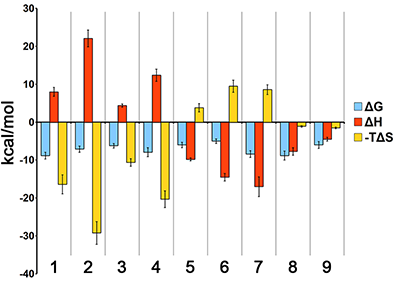
Далее соединения 1, 2, 4 - 7, 9 - 11, показавшие позитивный результат при SPR скрининге, были проверены на способность взаимодействовать с активным центром CYP51A1 с помощью технологии спектрального титрования. Для четырех соединений (ланостерол, хенрициозид H1, левискулозид G, астеросапонин Р1) был получен позитивный результат, свидетельствующий о непосредственном их взаимодействии с атомом железа в геме цитохрома, находящегося в активном центре фермента. Для данных взаимодействий были получены значения Kd в диапазоне 10-6 – 10-8 М [5]. Найденные новые лиганды CYP51A1, способные взаимодействовать с активным центром фермента, были далее проверены с помощью биохимического теста в реконструированной монооксигеназной системе цитохрома P450(51) по методу Trosken и соавт. [14] с незначительными изменениями [2,5]. Два соединения (хенрициозид H1 и левискулозид G) показали способность ингибировать активность CYP51A1 со значением IC50 80-90 мкМ [5]. Таким образом, поскольку эти соединения являются ингибиторами активности CYP51A1, то следующим этапом будут исследования, посвященные тестированию новых химически модифицированных базовых структур для поиска такого низкомолекулярного соединения прототипа лекарства, которое бы связывалось с CYP51A1 с более высокой аффинностью и обладало большим потенциалом ингибиторного действия. Ввиду наличия высокой субстратной специфичности для цитохромов семейства Р450(51) [15], найденные при SPR скрининге новые соединения могут представлять интерес в качестве ингибиторов других представителей данного семейства, которые рассматриваются как потенциальные мишени для терапии паразитарных инвазий и микозов [16]. Помимо данных о кинетических и равновесных параметрах взаимодействий, SPR-анализ позволяет получить данные о термодинамических параметрах взаимодействия исследуемого соединения с макромолекулой-мишенью. Эти данные позволяют оценить вклад различных термодинамических компонент в процесс комплексообразования. На рисунке 6 приведены ранее не опубликованные термодинамические данные для взаимодействия ряда низкомолекулярных соединений с CYP51A1 (ланостерола (соединение 1 на рис. 3, 4), кетоконазола (известный ингибитор CYP51A1 [2], Kd - приблизительно 6 мкМ [3]), голотурина А (соединение 26 на рис. 3), астеросапонина Р1 (соединение 7 на рис. 4), бетулафолиентриола (соединение 29 на рис. 3), теасапонина (соединение 34 на рис. 3), левискулозида G (соединение 6 на рис. 4), хенрициозида Н1 (соединение 5 на рис. 4), дигитонина (соединение 27 на рис. 3). Значительное изменение энтальпии в ходе взаимодействия может говорить о заметном вкладе в процесс взаимодействия электростатических взаимодействий, образования солевых мостиков или водородных связей и изменения конформации белка, в то время как изменение энтропийной составляющей говорит о вкладе гидрофобных взаимодействий и перестройках сольватных оболочек взаимодействующих молекул [17].
ЗАКЛЮЧЕНИЕ Таким образом, с помощью SPR-анализа можно получить следующие данные о характере взаимодействия низкомолекулярного соединения:
Вышесказанное подтверждает, что оптический биосенсор как средство первичного поиска прототипов новых лекарственных препаратов и количественной характеристики конкретного взаимодействия органично сочетается с рядом дополнительных методов (электрохимические, биохимические, спектральные, компьютерное молекулярное моделирование, кристаллография). БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы (0518-2018-0003) с использованием оборудования ЦКП «Протеом человека» при ИБМХ, поддержанном Минобрнауки РФ в рамках соглашения №14.621.21.0017 (идентификатор RFMEFI62117X0017). Экспрессия белков, спектральное титрование и биохимический анализ были выполнены при поддержке Государственной программы Республики Беларусь «Наукоемкие технологии и техника» на 2016-2020 гг (подпрограмма 1, «Инновационные биотехнологии – 2020»). ЛИТЕРАТУРА
|