К 40-летию Института физиологически активных веществ РАН
|
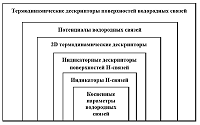
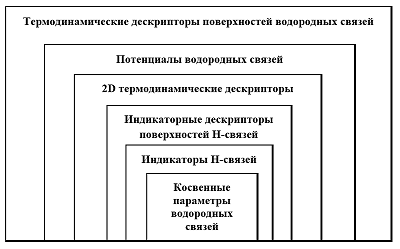
СОДЕРЖАНИЕ 1. ДЕСКРИПТОРЫ ВОДОРОДНЫХ СВЯЗЕЙ И ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ ДЛЯ ИХ РАСЧЁТА 2. ИССЛЕДОВАНИЕ ВЗАИМОСВЯЗЕЙ ДЕСКРИПТОРОВ ВОДОРОДНЫХ СВЯЗЕЙ С БИОДОСТУПНОСТЬЮ ЛЕКАРСТВ Рисунок 1 Иерархия информационного содержания различных дескрипторов водородной связи. Рисунок 3 Потенциалы водородной связи. Зависимость оптимальной энергии от длины связи. Таблица 2 Коэффициенты уравнения (19) и их статистические критерии. |
Вклад водородного связывания в биодоступность лекарств: методы хемоинформатики Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; e-mail: raevsky@ipac.ac.ru Ключевые слова: QSAR; HYBOT; дескрипторы водородных связей; биодоступность DOI: 10.18097/BMCRM00060 ВВЕДЕНИЕ Понятие водородной связи описывает взаимодействие атома водорода, ковалентно связанного с каким-либо электроотрицательным атомом (азот, кислород, сера, фтор, хлор), c другим электроотрицательным атомом этой же молекулы (внутримолекулярная водородная связь) или другой молекулы (межмолекулярная водородная связь). При этом указанный атом водорода определяется как «донор водородной связи», а электроотрицательные атомы как «акцептор водородной связи». Энергии водородных связей меняются в очень широких пределах (от 1 до 160 кДж/моль) и зависят от пространственной конформации образованного H-комплекса, типов атомов, непосредственно участвующих в формировании водородной связи, и природы заместителей, расположенных в молекулах в непосредственной близости от доноров и акцепторов водородной связи [1]. Первая публикация, упоминающая водородную связь, вышла в 1912 году Моор и Винмил использовали понятие о водородной связи, чтобы объяснить, почему гидроксид триметиламмония является слабым основанием по сравнению с гидроксидом тетраметиламмония [2]. В свою очередь, в 1920 году М.Л. Хаггинсом была высказана гипотеза образования «водородносвязанных стержней» [3] в воде, объясняющая аномальные свойства воды. Физическая природа водородной связи с момента обнаружения и до настоящего времени остается предметом повышенного внимания. Однако выяснены далеко не все детали этого сложного взаимодействия атомов. Продолжаются дискуссии о характере взаимодействий при образовании водородной связи (электростатических, ковалентных или их сочетания), о пространственной ориентации атомов и неподеленных электронных пар гетероатомов, участвующих в образовании H-комплексов [1]. В то же время очевидно, что взаимодействия между молекулами, являющимися донорами и акцепторами водородной связи, приводят к образованию разнообразных молекулярных и ионных комплексов, играющих важную роль в химических и биохимических процессах, включая ферментативный катализ [4]. Структуры, образуемые за счёт водородных связей, исключительно важны в биологических системах, поскольку они играют ключевую роль в макромолекулярных структурах и при молекулярном распознавании. Классический пример – формирование 3D структуры нуклеиновых кислот и определяющая роль водородного связывания в процессе репликации ДНК [5], основанные на образовании высокоспецифичных комплексов пуриновых и пиримидиновых оснований. Другой пример – формирование структуры белка, элементы вторичной структуры которого стабилизуются посредством водородных связей (энтальпийные вклады), в то время как третичная структура в большей степени определяется гидрофобными контактами (преимущественно энтропийные вклады) [6]. Данный обзор затрагивает лишь небольшую часть эффектов, связанных с образованием водородных связей, которые имеют прямое отношение к решению проблемы биодоступности лекарственных соединений. В основе понятия биодоступности лежит такой физиологический процесс, как абсорбция, сам по себе достаточно сложный и включающий в себя, например, перенос вещества через апикальную плазматическую мембрану внутрь клеток ЖКТ, внутриклеточный транспорт веществ, опционально метаболическую модификацию, перенос вещества из клетки в кровь или лимфу [7]. По определению FDA, биодоступность – скорость и степень поступления (всасывания) активного фармацевтического ингредиента из соответствующей лекарственной формы и места введения в системный кровоток, в результате чего он становится доступным в зоне действия [8]. Среди большого числа факторов, влияющих на биодоступность, важную роль играют физические свойства лекарственного средства, в частности, гидрофобность (гидрофильность), степень диссоциации на ионы, растворимость. Для многих органических соединений определяющим фактором при изучении этой группы свойств является способность образовывать водородные связи. Отдел компьютерного молекулярного дизайна (ОКМД) ИФАВ РАН уделяет первостепенное внимание развитию QSAR моделей с участием водородного связывания, обзору которых и посвящена настоящая работа. 1. ДЕСКРИПТОРЫ ВОДОРОДНЫХ СВЯЗЕЙ И ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ ДЛЯ ИХ РАСЧЁТА 1.1. Классификация дескрипторов водородных связей В литературе описан целый ряд различных дескрипторов водородной связи, включая индикаторные переменные, числа донорных и акцепторных атомов водородной связи, поверхности атомов, участвующих в образовании водородной связи, квантово-химические дескрипторы, термодинамические и сольватохромные параметры [9]. Каждый из этих дескрипторов прямо или косвенно связан со сложным процессом формирования водородных связей на различных уровнях. Классификация дескрипторов водородной связи (рис. 1) по их информационному содержанию предложена нами в [10].
Индикаторные дескрипторы самого низкого уровня, косвенно характеризующие водородную связь, дают возможность определить лишь тенденцию в изменении свойства. Например, чем больше донорных и акцепторных групп водородной связи, тем лучше растворимость соединений в воде (не бесспорное суждение для кристаллических соединений!). Дескрипторы промежуточного уровня (энтальпийные и свободноэнергетические факторы водородной связи) дают возможность количественно охарактеризовать одноцентровые водородные связи. Дескрипторы следующего уровня (потенциалы водородной связи, термодинамические параметры поверхностей водородной связи) дают количественное описание водородной связи при оптимальном расположении взаимодействующих химических групп. А расчет термодинамических параметров с учетом зависимости потенциалов водородной связи от расстояний между атомами, образующих водородную связь, и от ориентации атомов и неподеленных электронных пар является самым высоким уровнем количественного описания водородной связи. 1.2. Создание оригинальных 2D термодинамических дескрипторов водородных связей Разумной альтернативой любым качественным подходам оценки водородносвязанных параметров может быть только путь описания образования водородной связи на основе термодинамических функций комплексообразования согласно уравнению:
Для описания изменения энтальпии при образовании водородной связи между i-тым и j-тым атомами (∆Hij) нами было предложено эмпирическое уравнение, в котором использованы донорные (Ed) и акцепторные (Ea) энтальпийные факторы водородной связи, упорядоченные в рамках единой шкалы и имеющие противоположные знаки [11-13]:
Примеры использования этого подхода для оценки акцепторной способности водородной связи для обширного массива разнообразных по структуре соединений представлены в публикациях [14-21]. Аналогичное уравнение было предложено и для описания изменения свободной энергии при образовании водородной связи [17]:
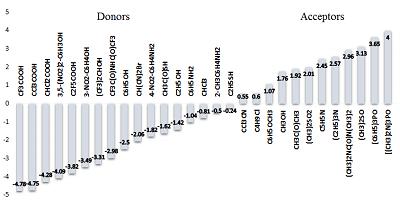
Развитие и успешное применение рассматриваемого подхода количественного описания водородной связи возможно лишь на базе обширных экспериментальных данных по термодинамике водородной связи. Использование таких данных в работе [22] позволило получить статистически устойчивые параметры. Из многих тысяч комплексов c водородной связью нами было отобрано 936, удовлетворяющих следующим требованиям: (1) стехиометрия комплексов водородной связи 1:1; (2) растворитель во всех системах CCl4; (3) для комплексов имеются данные как по DH, так и по DG; (4) значения ∆H и ∆G определены экспериментальными методами. Был разработан специальный алгоритм для расчета энтальпийных и свободноэнергетических параметров водородной связи с фиксацией гексаметилфосфорамида в качестве референсного акцептора (встречался 88 раз среди изученных 936 комплексов) и фенола в качестве референсного донора водородной связи (встречался 119 раз). В результате были рассчитаны донорные факторы водородной связи для 163 соединений и акцепторные факторы водородной связи для 195 соединений. Оценку качества полученных значений факторов водородной связи проводили, сравнивая экспериментальные значения ∆H и ∆G с рассчитанными с использованием уравнений 2 и 3.
Приведенные статистические параметры уравнений (4) и (5) показывают, что полученные факторы водородной связи (рис. 2) обеспечивают возможность достаточно точного расчета энтальпии и свободной энергии водородного связывания в комплексе.
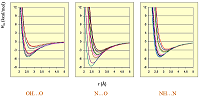
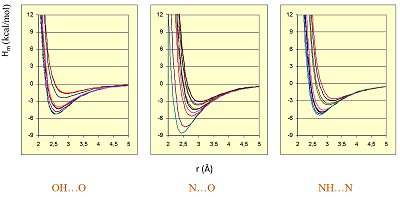
Расширение спектра органических соединений, для которых можно рассчитать свободноэнергетические факторы, стало возможным за счёт использования экспериментальных данных по термодинамике водородной связи при условии, что известно только ∆G комплекса [23,24]. Число факторов таким образом было увеличено до 414 для доноров и 1298 для акцепторов водородной связи, что потенциально даёт возможность рассчитать свободную энергию 537372 комплексов с водородной связью. Особенно стоит отметить, что предложенная шкала адекватно описывает влияние заместителей при группах, образующих водородные связи, на значение факторов водородной связи [22]. Этот широко известный факт нередко игнорируется при использовании простых методов учёта водородного связывания. В тоже время подходы, аналогичные предложенному нами, также развивались и другими исследователями [25- 27]. 1.3. Компьютерная программа HYBOT Собранная база экспериментальных данных по термодинамике водородной связи и предложенная шкала факторов водородного связывания стали основой для создания в 90-х годах программного комплекса HYBOT (Hydrogen Bond Thermodynamics) [28]. Помимо собственно базы данных термодинамических параметров ~16000 комплексов с водородной связью программа включает в себя базы данных энтальпийных и свободноэнергетических факторов водородной связи (более 50 000), модуль расчёта фактора водородного связывания для произвольной органической структур методом ближайшего соседа, а также расчёт дополнительных 32 молекулярных дескрипторов, включая молекулярную поляризуемость, суммы положительных и отрицательных зарядов на атомах, суммы энтальпийные и свободноэнергетические факторы водородной связи. Программа функционирует как самостоятельно в операционных системах Windows и LINUX, так и в составе системы управления химическими базами данных CHED [29]. Примеры использования программного комплекса HYBOT для установления количественных взаимосвязей “структура–свойство” будут представлены в следующей части этого обзора. 1.4. Трехмерные потенциалы водородной связи и программа HYBOT 3D Расчёт описанных выше факторов водородного связывания базируется исключительно на структурной формуле органического соединения; таким образом все рассчитанные с их использованием дескрипторы можно отнести к 2D-дескрипторам. В тоже время современная тенденция в молекулярном моделировании и QSAR – использование в работе данных по 3D системам [30]. В той или иной степени учёт водородного связывания есть в большинстве программ молекулярной механики. От наиболее простых, таких как поправочные коэффициенты при расчёте ван-дер-ваальсовых взаимодействий (например, в поле сил TRIPOS [31]), до самостоятельных потенциалов, таких как потенциал «10-12» в старых версиях программы AMBER [32] или «6-8» в программе GRID [33]. Недостаток таких потенциалов, как правило – ограниченное число фиксированных параметров пары донор/акцептор. Например, в программе GRID фактически зафиксированы три потенциала водородной связи: -4,00 ккал/моль в качестве оптимальной энергии водородной связи для пары O—H···O, 2,8 ккал/моль для O—H···N и -2 ккал/моль для N—H···N. Эти значения потенциалов не учитывают того факта, что энтальпия водородной связи для одного и того же типа атомов меняется в очень широких интервалах и существенно зависит от природы заместителя. Так, по данным расчёта программой HYBOT для пары O—H···O оптимальная энтальпия водородной связи (при идеальной геометрии) меняется в интервале 0,9—15,9 ккал/моль, для O—H···N — в интервале 0,5—10,5 ккал/моль, для N—H···N — в пределах 0,5—11,5 ккал/моль. Кроме того, при анализе набора низкомолекулярных кристаллических комплексов из Кембриджского банка структурных данных [34] с близкими к «идеальным» значениям углов в геометрии водородной связи (угол донорный — «тяжелый» атом - атом водорода - атом акцептора в интервале 173—187°, угол между ядрами акцептора неподеленной пары электронов и атомом водорода в интервале 170—190°), было показано [39], что от природы заместителей зависит не только оптимальная энергия водородной связи (Em), но и оптимальная длина (rm) водородной связи (рис. 3). Зависимость между ними аппроксимируется уравнением:
В результате была предложена модификация потенциала «6-8», реализованная в программном комплексе HYBOT 3D [35], где расчёт энергии водородного связывания проводится по следующей схеме: 1) рассчитываются энтальпийные акцепторные и донорные факторы водородной связи (идентично с модулем расчёта HYBOT); 2) рассчитываются значения оптимального расстояния и оптимальной энергии для пары атомов, образующих водородную связь, с помощью уравнений 6 и 3; 3) рассчитывается значение потенциала «6-8» с учетом отклонений от идеального расположения атомов, участвующих в образование водородной связи:
Значение оптимальной свободной энергии рассчитывается по уравнению (2) при k1 равным 1.33, а оптимальное расстояние между донорным и акцепторным атомами рассчитывается по уравнению (6). Коэффициенты k4, k7 и k8 рассчитаны для каждой пары акцепторный атом/донорный атом по данным из кристаллографической базы данных низкомолекулярных соединений [34]. Сопоставление полученных расчетных данных с результатами работы [35-37] показало, что данный метод более корректно описывает сложные межмолекулярные взаимодействия по сравнению с программой GRID. 1.5. HYBOT PSA дескрипторы С использованием факторов водородной связи можно рассчитать также 6 новых дескрипторов, идеологически близких такому широко используемому дескриптору как PSA (polar surface area). Они дают возможность определить области молекулярной поверхности, благоприятные для образования межмолекулярных водородных связей и также учесть влияние заместителей при донорных и акцепторных центрах на силу этих связей. HYBOT PSA дескрипторы можно рассчитать по следующим формулам:
Расчет HYBOT PSA дескрипторов реализован в программе MOLTRA II [36]. Программа осуществляет также непосредственный расчет термодинамических параметров водородной связи при ”идеальном“ расположении донорных и акцепторных атомов и оптимальном расстоянии между этими атомами. 2. ИССЛЕДОВАНИЕ ВЗАИМОСВЯЗЕЙ ДЕСКРИПТОРОВ ВОДОРОДНЫХ СВЯЗЕЙ С БИОДОСТУПНОСТЬЮ ЛЕКАРСТВ Так как фактически биодоступность лекарств является оценочной характеристикой для работы сложнейшей системы физических, физиологических и отдельных биохимических процессов, часто каскадно организованных, имеет смысл рассматривать каждый элемент по отдельности. К таким элементам можно отнести растворение в физиологической среде, мембранный транспорт, абсорбцию, различные метаболические процессы, распределение по различным органам. Например, для лекарств, предназначенных для воздействия центральную нервную систему, очень важно преодоление гематоэнцефалического барьера (ГЭБ). В свою очередь, для оценки способности соединения проходить ГЭБ или участвовать в процессе мембранного транспорта большую роль играет такой фактор как липофильность органического соединения. Последний также важен в понимании такого явления как общая токсичность. Для создания предсказательных QSAR моделей, описывающих некоторые из этих явлений, использование понятия водородного связывания имеет принципиальное значение 2.1. Липофильность органических соединений Физико-химические модели липофильности, основанные на стерических, электростатических и водородносвязанных взаимодействиях, рассматриваются с начала 1980-х годов [37,38]. В 1995 году нами было предложено уравнение, в котором в качестве дескрипторов используются молекулярный объем и водородносвязанные факторы для описания коэффициентов распределения химических соединений в системе октанол–вода (log P) [42]. Позднее молекулярный объем был заменен на молекулярную поляризуемость (α). В результате было получено корреляционное уравнение, описывающее с высокой точностью зависимость log P от двух дескрипторов [39] для 2850 простых монофункциональных органических соединений:
Это уравнение было в дальнейшем использовано нами для расчета липофильности программой SLIPPER-98 [40]. Несмотря на то, что значительная часть соединений обучающей выборки содержала группы доноров водорода, вклад донорных факторов в липофильность не был показан. В тоже время уравнение не содержит постоянного члена, т.е. для соединений, не содержащих доноров и акцепторов водородной связи, липофильность прямо пропорциональна молекулярной поляризуемости, которая, в свою очередь, хорошо коррелирует с такими параметрами как молекулярный вес или объём. Хотя применение уравнения (14) в программе SLIPPER-98 обеспечило хорошую точность оценок log P, для расчетных значений этого параметра в случае сложных химических соединений и лекарств, содержащих в составе молекул несколько функциональных групп, наблюдались существенные отклонения по сравнению с экспериментальными значениями. Это побудило нас в работе [41] модифицировать формулу (14), включив в уравнение экспериментальное значение липофильности для ближайшего структурно-родственного соединения и разности величин дескрипторов для него и тестируемого соединения:
В дальнейшем формула (15) была применена для расчета log P в программном комплексе SLIPPER-2001 [41]. Эффективность расчета липофильности с помощью уравнения (15) была проверена на массиве, содержащем 10937 органических соединений и лекарств. Коэффициент корреляции между экспериментальными и рассчитанными значениями для этих соединений составил 0.972. 2.2. Растворимость в физиологической среде Растворимость химического соединения в воде является важным параметром при оценке биодоступности. Плохая растворимость кандидатов – частая причина неудачи проектов по поиску новых лекарственных соединений [42]. Что касается ЦНС, новое соединение вряд ли станет лекарством для лечения её заболеваний, если его растворимость меньше 1 мкм/л [43]. Известно, что растворимость жидких органических соединений хорошо коррелирует с коэффициентом распределения в системе октанол-вода [44]:
Полученная нами корреляция, основанная на данных по растворимости 606 жидких неионизированных органических соединений, оказалась похожей [16]:
Поскольку ранее нами уже была установлена зависимость для log P (уравнение 14), логично было использовать тот же набор дескрипторов. Однако в данном случае значимыми были как молекулярная поляризуемость (α) и сумма акцепторных факторов (∑Са), так и два дополнительных дескриптора (сумма частичных отрицательных зарядов (∑Q-) и сумма донорных факторов (∑Cd) [45]):
В тоже время, ситуация c растворимостью в воде кристаллических соединений (чаще встречающихся среди лекарственных соединений) является гораздо более сложной, так как энергия, необходимая для их растворения, зависит от структуры кристаллической решетки. В настоящее время имеется большое число работ [16,46-51], посвященных предсказанию растворимости таких веществ в воде. Однако, как правило, ошибка предсказания в этих работах от единицы и более в логарифмической шкале log S [52,53].
Для решения данной проблемы мы использовали две оригинальные QSAR модели: AMP (средняя арифметическая модель) [54] и LoReP (регрессия локального кластера) [55]. Результаты оценки растворимости 2615 кристаллических соединений представлены в таблице 1. В обоих случаях получены весьма удовлетворительные статистические критерии QSAR моделей с участием параметра AlogP (коэффициент распределения октанол/вода рассчитанный методом Ghose-Crippen [56]) и молекулярной поляризуемости. Стоит также упомянуть, что в физиологических условиях для лекарственных соединений важное значение имеет pH среды. В работах [57-59] этот вопрос рассматривается более подробно. 2.3. Абсорбция химических соединений и лекарств в живых организмах Первое подробное исследование в области предсказания абсорбциии нам удалось выполнить на примере модели пассивного транспорта 32 лекарств при пероральном способе введения в организм человека [60].
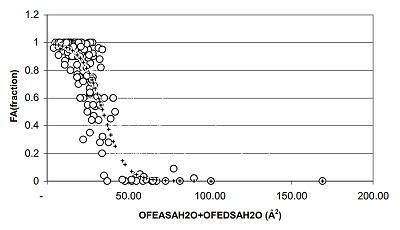
Величину FA (Fraction Absorption) измеряли в пределах от нуля до единицы как отношение абсорбированного вещества к его общему количеству. Линейные регрессионные модели взаимосвязи logit(FA) с использованными физико-химическими дескрипторами показали неплохие статистические критерии, но не выдержали тестирования при скользящем контроле. Далее в работе были рассмотрены эмпирические нелинейные модели. Например, уравнение (19) имеет сигмоидную зависимость (рис. 4) величины FA от суммы таких дескрипторов, как молекулярная поляризуемость, сумма частичных зарядов и суммы донорных и акцепторных факторов. Статистические критерии данного набора моделей (табл. 2) хорошие, причём стандартное отклонение рассчитанных значений FA находится на уровне ошибки их экспериментального определения.
Позднее сигмоидный характер зависимости пассивной абсорбции лекарств от размера поверхностей дескрипторов водородной связи был нами подтвержден на обширной выборке из 154 лекарств [61]. В работе [62] нами были использованы данные по абсорбции в организме человека 100 разнообразных по структуре лекарств, подверженных не только пассивной диффузии, но и активному транспорту. Учёт этого явления меняет картину зависимости абсорбции от потенциала водородного связывания. При этом предсказание возможно, если данные можно разбить на несколько выборок родственных соединений. Таким образом, полученные корреляционные зависимости cсвидетельствует о важной роли водородного связывания в явлении абсорбции. По мере усложнения структуры соединений и изучаемых биологических эффектов характер зависимости структура-свойство (активность) может быть все более сложным. В данном случая уже недостаточно использования только линейных моделей, а требуется рассмотреть различные варианты, такие как параболические, билинейные, сигмоидные и другие подобные модели. 2.4. Проницаемость через гематоэнцефалический барьер Гематоэнцефалический барьер (ГЭБ) – один из важнейших защитных механизмов ЦНС, объединяющий совокупность анатомических и функциональных систем, которые поддерживают постоянство и регулируют состав внутренней среды головного и спинного мозга [63,64]. ГЭБ регулирует распределение различных веществ между током крови и мозгом, и обладает высокой избирательностью. Барьерная функция ГЭБ – основная проблема при оценке будущей биодоступности лекарств, действующих на ЦНС. В настоящее время общепринято, что физико-химические свойства лекарств, такие как размер молекул, заряды, способность к образованию водородных связей, липофильность, являются важными составляющими факторами, влияющими на преодоление ГЭБ [65]. Существует целый набор правил, созданных медицинскими химиками, для оценки возможности проницаемости соединений через ГЭБ. Здесь следует упомянуть о ряде публикаций: об оптимальном для проницаемости logP=2.0 [66]; о том, что проницаемость кровь-мозг (logBB) увеличивается за счет logP и уменьшается при увеличении способности образовывать водородные связи [67]; об использовании для предсказания logBB величины logP(алкан-вода) и молекулярного объема или PSA [68]); “правило-5” [69]; наблюдении, что соединения c O+N ≤ 5 или clogP > 0 имеют большие шансы проникать в ЦНС [70]; о возможности избежать эффлюкс P-гликопротеином для соединений с MW < 400 N+O < 4, pKa < 8 [71], и многих других [72-78]. Наши первые работы, посвященные решению этой проблемы, были опубликованы в 1990 году [79,80]. Затем в совместных работах с зарубежными учёными [81-84] была показана эффективность дескрипторов водородного связывания, рассчитанных программой HYBOT. В 2015 году Rankovic опубликовал обширный обзор [85], посвященный важности физико-химических свойств для предсказания проницаемости через ГЭБ с обсуждением различных правил медицинских химиков, упомянутых выше. В обзоре содержатся данные по шести физико-химическим свойствам и концентрации 616 соединений в мозге мышей после введения их в кровь. С использованием этой выборки (дополнив её соединениями, не проходящими ГЭБ) мы провести специальное QSAR исследование возможностей уже упомянутых правил [86,87] и современных методов бинарной классификации для оценки проходимости («ЦНС»; 500 - обучающая выборка, 50 - тестовая) или не проходимости («не ЦНС»; также 500 и 50) химическим соединеним ГЭБ [88]. Как видно из таблицы 3, ни один подход медицинских химиков не даёт удовлетворительных результатов прогноза. Использование методов логистической регрессии (LR), случайного леса (RF) и метода опорных векторов (SVM) позволило создать стабильные QSAR модели с точностью (ACC) 0.81-0.84. В этих моделях дескрипторы водородных связей (прежде всего дескрипторы HYBOT) вносят существенный вклад.
ЗАКЛЮЧЕНИЕ Водородные связи играют исключительно важную роль в формировании биохимических комплексов и в различных процессах с их участием, в том числе и процессах, определяющих биодоступность лекарственных соединений. К настоящему времени компьютерное моделирование взаимосвязей между структурой молекул и их комплексов с такими процессами (растворением в физиологической среде, липофильностью, абсорбцией, проницаемостью в ЦНС, распределением по органам живого организма) является непременной составляющей дизайна новых эффективных лекарств. Использование дескрипторов водородной связи позволяет получать адекватные предсказательные модели, особенно, если используются те дескрипторы, которые учитывают природу ближайших заместителей при атомах, обладающих донорной и акцепторной способностью для образования водородной связи, такие как дескрипторы HYBOT. БЛАГОДАРНОСТИ Работа выполнена в рамках государственного задания на 2018 год (тема № 0090-2017-0020). ЛИТЕРАТУРА
|