|
СОДЕРЖАНИЕ |
Проникновение в опухолевые клетки фото-сенсибилизатора хлорина е6 в составе фосфолипидных наночастиц при конъюгации с гексапептидом, содержащим последовательность NGR
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича,
119221, Москва, ул. Погодинская 10;*e-mail: torti@mail.ru Ключевые слова: хлорин е6; фосфолипидные наночастицы; HepG; MCF-7; аминопептидаза N; NGR DOI: 10.18097/BMCRM00063 ВВЕДЕНИЕ
Среди различных методов противоопухолевой терапии всё большее место занимает относительно недавно вошедший в практику, но уже зарекомендовавший себя способ лечения некоторых видов рака, в основном сóлидных (локализованных) опухолей - фотодинамическая терапия. Он активно развивается во многих странах мира с конца семидесятых годов, и недавно исполнилось десять лет клинического применения этого метода в России. Метод основан на предварительном введении в организм специальных веществ - фотосенсибилизаторов (ФС), обладающих способностью под действием света вступать в фотохимические реакции с кислородом, приводящие к образованию цитотоксических агентов (прежде всего активных форм кислорода), повреждающих структурные элементы опухоли [1]
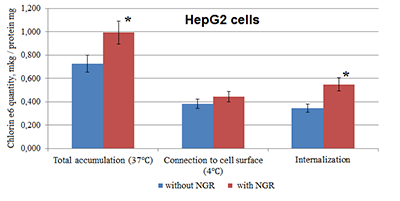
В фотодинамической терапии применяют в основном фотосенсибилизаторы из группы порфиринов, для которых еще в двадцатые годы было показано преимущественное сродство к раковым клеткам. Это обеспечивает их накопление в ткани опухоли, позволяющее индуцировать повреждающий эффект при последующем локальном облучении. Развитие фотодинамической терапии сопровождалось совершенствованием используемых для неё ФС, и в настоящее время используют в основном хлорин е6 (2,3-дигидропорфирин), основное преимущество которого заключается в том, что он активируется светом длинноволновой области спектра, который глубже проникает в ткани [2]. В клинической практике используют, в частности, такие его препараты как Радахлорин («Рада-Фарма», Россия) и Фотодитазин («Вета-Гранд», Россия). В то же время хлорин е6 обладает и рядом недостатков: низкой водорастворимостью, а также длительной фототоксичностью, обусловленной его поступлением и удерживанием не только в опухолях, но и в здоровых тканях [2]. Для улучшения эффективности использования хлорина е6 его включали в различные транспортные системы на основе частиц наноразмера – липосомы, дендримеры, полимерные наночастицы. Было показано, что инкапсуляция хлорина е6 в липосомы облегчает его введение in vivo и улучшает его фототоксичность и фармакокинетический профиль [2]. Использовались также специфические подходы для повышения проникновения наночастиц с присоединенным хлорином е6 в опухолевые ткани и клетки. Для этой цели к наночастицам присоединяли вещества – чаще пептиды, обладающие аффинностью к опухолевым клеткам или повышенной способностью к проникновению внутрь клетки (интернализации). Так, композиции хлорина е6 в наночастицах из дендримеров [3] или содержащих ПЭГ полимеров [4] с пептидом RGD (Arg-Gly-Asp), проявляющим сродство к интегриновым рецепторам ряда опухолей, повышали доставку фотосенсибилизатора в опухолевые клетки. Повышение цитотоксичности хлорина по отношению к опухолевым клеткам было также достигнуто путём присоединения к содержащим его липосомам фолата за счёт аффинности к фолатным рецепторам, повышенная экспрессиякоторых обнаружена в ряде опухолей. Сообщается о придании «адресности» хлорина е6 к опухолевым клеткам путем его непосредственной конъюгации с моноклональными антителами, избирательно взаимодействующими с внеклеточным доменом рецептора 2 эпидермального фактора роста человека (HER2), экспрессирующимся на клетках рака молочной железы [6]. Во многих работах исследовали эффективность ряда других, позже выявленных аффинных к опухолям пептидов (tumor homing peptides), хотя об их использовании по отношению к хлорину е6 не сообщается. Эти исследования были направлены на повышение доставки в опухолевые клетки других противоопухолевых лекарств, включавшихся в различные наночастицы [7-9]. Наибольшее внимание уделялось пептидам, содержащим последовательность трёх аминокислот - Asn-Gly-Arg (NGR). Для этого трипептида была выявлена аффинность к клеткам ряда опухолей и опухолевых сосудов за счет способности связываться с эскспрессирующимся на них белком аминопептидазой N (АРN, также называемой СD13) [8]. При присоединении пептида NGR к липосомам с включенными цитостатиками – доксорубицином, паклитакселем и другими - наблюдалось существенное повышение накопления лекарства в опухоли и его эффективности по сравнению с «безадресными» липосомами [9]. При этом оказывал влияние и состав фосфолипидов липосом с NGR: наибольший эффект был показан для липосом из смеси соевого и гидрогенизированного соевого фосфатидилхолинов [9]. Результаты этих работ свидетельствуют о возможной перспективности данного подхода, с использованием пептида NGR, для повышения доставки в опухолевые клетки также и хлорина е6 при включении его в липосомы или другие наночастицы. Нами ранее было проведено включение хлорина е6 в ультрамалые фосфолипидные наночастицы диаметром до 30 нм из соевого фосфатидилхолина, приводящее к снижению фототоксичности этого ФС вследствие ускоренного выведения из органов [10], а также исследована возможность повышения его проникновения в клетки HepG2 при добавлении гептааргинина (R7). Целью настоящей работы было введение в такую систему пептида NGR в качестве адресного лиганда и исследование его влияния на проникновение хлорина е6 в опухолевые клеточные линии HepG2 и MCF-7. МАТЕРИАЛЫ И МЕТОДЫ Для получения фосфолипидных наночастиц с встроенным хлорином е6 использовали соевый фосфатидилхолин (Lipoid S100, «Lipoid», США), хлорин е6 - N-метилглюкаминовую соль (Ивановский институт), гептааргинин (R7, ИБМХ, Москва). Для получения таких же наночастиц с адресным трипептидом NGR использовали гексапептид, содержащий эту последовательность - (NH2-)Gly-Asn-Gly-Arg-Gly-Cys(-COOH) («СинтонЛаб», Санкт-Петербург) и – для его присоединения - фосфолипид дистеароил-фосфатидилэтаноламин (DSPE), конъюгированный с ПЭГ2000 и малеимидом - DSPE–PEG2000–Mal («Avanti», США). Конъюгат DSPE–PEG2000-NGR получали согласно методике, описанной в работе [11], с небольшой модификацией, используя соотношение DSPE-PEG2000-Mal:NGR 4.3:1. Пептид, содержащий NGR, растворяли в дистиллированной воде, барботировали азотом. Затем добавляли DSPE–PEG2000–Mal, повторно барботировали азотом и инкубировали 24 ч при комнатной температуре, разливали по флаконам и лиофилизировали с использованием сушки Virtis Advantage XL («SP Scientific», USA); лиофилизат хранили при температуре -20°С. Для получения композиции фосфолипида Lipoid S100 («Lipoid») с конъюгатом DSPE-PEG2000-NGR – основы для приготовления наночастиц – оба фосфолипидных компонента растворяли в 96% этиловом спирте («Медхимпром», Россия), смешивали спиртовые растворы в соотношении Lipoid:DSPE–PEG2000-Mal, равном 10:1. После этого проводили отгонку спирта на роторном испарителе Heidolph Laborota 4003 («Heidolph», Германия) и полученную пленку регидратировали дистиллированной водой. Для получения фосфолипидных наночастиц с хлорином е6 в образовавшуюся грубую водную эмульсию фосфолипидов (Lipoid S100 и DSPE–PEG2000–NGR, 10:1) добавляли N-метилглюкаминовую соль хлорина е6 в соотношении с Lipoid S100 (по хлорину е6) 1:10 и обрабатывали на ультразвуковом дезинтеграторе Bandelin Sonopuls («Bandelin», Германия) с использованием стержня KE72 в течение 6 мин при мощности 50%. Полученную ультратонкую эмульсию пропускали через фильтр 220 нм («Merck Millipore», США). «Контрольные» наночастицы без NGR готовили так же, используя только соевый фосфатидилхолин (Lipoid S100), как описано ранее [10]. Встраивание хлорина е6 в наночастицы, как было показано ультрафильтрацией, достигало более 95%, размер частиц составлял 20-40 нм. В полученные водные эмульсии фосфолипидных наночастиц с хлорином е6, приготовленных или только из Lipoid S100, или из его смеси с DSPE–PEG2000–NGR, добавляли водный раствора гептааргинина (R7) в весовом соотношении к хлорину е6 6:1 и встряхивали при скорости 2000 об/мин на шейкере IKA MS 3 basic («IKA», США). Процент R7, присоединенного к наночастицам, определяемый ультрафильтрацией после центрифугирования эмульсии при 10000 об/мин 20 мин при 25°С (Mini Spin plus, «Eppendorf», Германия) в патроне Ultrafree-MC («Millipore», США), составлял 83%. В экспериментах по проникновению в клетки включенного в фосфолипидные наночастицы хлорина е6 использовали два вида клеток - гепатоцеллюлярной карциномы низкой степени злокачественности НерG2 и аденокарциномы молочной железы человека MCF-7, полученные из Американской коллекции типовых культур (АТСС) и поддерживаемые в коллекции клеточных культур ИБМХ. Клетки культивировали в среде DMEM («ПанЭко», Россия) с добавлением 10% фетальной бычьей сыворотки (FBS, «Gibco», США), 2 мкМ глутамина, 100 ед/мл пеницилина и 100 мкг/мл стрептомицина («Thermo Scientific», США) при температуре 37°С в присутствии 5% СО2. Перед проведением эксперимента клетки помещали в 6-луночные планшеты (по 1×106 клеток на лунку) и инкубировали в среде в течение 24 ч, затем дважды отмывали, по 2 мл фосфатно-солевого буфера (PBS, «ПанЭко»). После отмывки в лунки добавляли исследуемые образцы наночастиц с хлорином е6 с добавлением и без добавления DSPE–PEG2000–NGR до концентраций 25 мкг/мл (по хлорину е6) в PBS, и инкубировали в течение 4 ч при двух температурах: при 37°С в СО2-инкубаторе («Sanyo», Япония) и при 4°С (в холодильнике). После инкубации клетки трижды промывали, наливая по 2 мл холодного раствора (4°С) PBS. Для определения содержания хлорина е6 в клетках проводили его экстракцию раствором 0.1% муравьиной кислоты в метаноле (по 1 мл в лунку). Экстракты переносили в пробирки Eppendorf, центрифугировали при 10000 об/мин 10 мин при 4°С (Eppendorf 5810R, «Eppendorf», Германия), после чего анализировали методом масс-спектрометрии, используя хроматографическую систему для ВЭЖХ Agilent 1200 Series с масс-спектрометрическим детектором 6130 Quadrupole LC/MS («Agilent Technologies», США). Содержание хлорина е6 в клетках нормировали на уровень белка (мг), определяемого методом Лоури. Полное проникновение хлорина е6 в клетку (интернализацию) рассчитывали по разности его содержания при 37°С (общее накопление в клетках) и при 4°С (ассоциация с клеточной поверхностью) [12]. Для каждого типа клеток эксперимент выполняли три раза, различия в поступлении в клетки хлорина е6 для связанных и не связанных с NGR наночастицами считали статистически значимыми при p < 0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ На рисунке 1 показано накопление хлорина е6 в клетках HepG2 при их инкубации с транспортирующими его фосфолипидными наночастицами, содержавшими или не содержавшими пептид NGR.
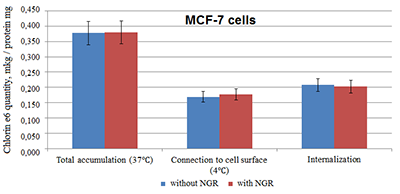
Как видно из рисунка 1, присоединение пептида NGR к фосфолипидным наночастицам, содержащим хлорин е6, заметно повышает как общее накопление этого ФС в данных клетках при 2-х-часовой инкубации, так и его интернализацию, при небольшом возрастании также и поверхностного связывания при 4°С [12]. Это может быть обусловлено экспрессией опухолевыми клетками белка аминопептидазы (CD13), за счет афинности к которой адресного пептида NGR происходит присоединение и интернализация наночастиц с включенным хлорином е6 [7-9]. Результаты для линии опухолевых клеток MCF-7 существенно отличались (рис. 2).
Как видно из рисунка 2, общее накопление хлорина е6 в клетках, включая как его присоединение к клеточной поверхности, так и интернализацию, не отличалось в условиях инкубации с наночастицами с присоединенным NGR или без него. Другими словами, в отличие от клеток HepG2, клетки MCF-7 не реагировали на присутствие в инкубируемых с ними хлорин-содержащих наночастицах адресного пептида NGR. Анализ литературы показал, что это может быть обусловлено специфическими особенностями этих клеток: хотя они также являются опухолевыми, но их относят к CD13-отрицательному виду, то есть им не свойственна экспрессия аминопептидазы N [13]. Клетки MCF-7 рака молочной железы характеризуют как «слабо метастазирующие», в отличие от «сильно метастазирующих» клеток той же локализации (MDA-MB-231) [14], экспрессирующих CD13 и присоединяющих NGR-содержащий пептид [15]. В настоящее время еще четко не выяснена связь клеточного типа опухоли с экспрессией CD13 (APN) и, соответственно, ответом (аффинностью) клетки на вводимый пептид NGR. На основании данных многих работ сложилось мнение, что это свойство сопряжено с опухолевым фенотипом - активной пролиферацией, секрецией, инвазией и ангиогенезом. Показана высокая экспрессия APN на клетках многих опухолей - рака молочной железы, кишечника, желудка, яичников, почек, поджелудочной и щитовидной желез, что детально рассмотрено в обзоре [7]. Возможности использования APN как мишени для противоопухолевой терапии активно обсуждаются в литературе, проводятся клинические испытания, некоторые из которых дали положительные результаты. [7,8]. Выявленные в настоящей работе различия между ответом на взаимодействие с наночастицами с хлорином е6 двух клеточных линий (HepG2 и MCF-7), отличающихся по экспрессии APN [13], подтверждают значимость экспрессии этого белка, возможность использования его в качестве мишени для направленной доставки. Ранее сходные тенденции наблюдали для липосом с включенными лекарствами, в основном, цитостатиками - во многих работах наблюдалось повышение доставки в клетки и противоопухолевой активности ряда лекарств при присоединении к транспортирующим их липосомам аффинного к APN (CD13) пептида NGR [7-9]. В этом отношении полученные нами данные на клетках HepG2, показавшие двукратное повышение интернализации хлорина е6, вводимого в составе фосфолипидных наночастиц при присоединении к ним NGR (рис. 1), свидетельствуют о перспективности такого подхода также и для фотодинамической терапии опухолей с использованием хлорина е6. Позитивному ответу на такое лечение может способствовать возможность предварительной гистохимической оценки экспрессии APN на конкретном виде опухоли [7], а также отмеченная многими авторами её повышенная экспрессия на сосудах опухоли в условиях свойственного опухолевому процессу усиленного ангиогенеза [8]. Следует также подчеркнуть, что это первая работа, показавшая результативность использования аффинного к опухолям пептида Asn-Gly-Arg (NGR) для повышения адресной доставки в опухолевые клетки хлорина е6, включенного в лекарственную транспортную систему. Полученные на опухолевых клетках HepG2 результаты в сочетании с показанным нами ранее снижением фототоксичности этого фотосенсибилизатора при включении его в фосфолипидные наночастицы [10] могут служить убедительным доводом в пользу перспективности такого подхода для оптимизации фотодинамической терапии сóлидных опухолей. БЛАГОДАРНОСТИ Авторы благодарят сотрудников лаборатории пептидной инженерии ИБМХ, руководимой проф. Е.Ф.Колесановой, за предоставление синтезированного ими гептааргинина (R7). Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013-2020 годы. ЛИТЕРАТУРА
|