К 40-летию Института физиологически активных веществ РАН
|
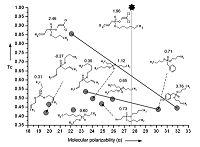
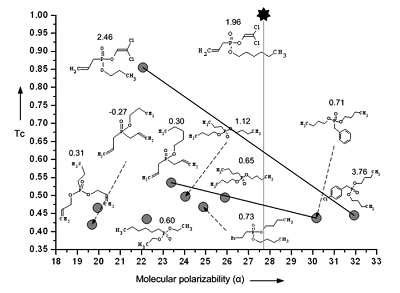
QSAR моделирование острой оральной токсичности млекопитающих Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: raevsky@ipac.ac.ru Ключевые слова: острая оральная токсичность; QSAR; HYBOT DOI: 10.18097/BMCRM00066 ВВЕДЕНИЕ Острая оральная токсичность у млекопитающих является сложным и недостаточно хорошо понимаемым явлением, состоящим из множества неспецифических взаимодействий химических соединений с биологическими мембранами, а также специфического связывания с большим числом биологических мишеней внутри организма. В связи с этим создание адекватных моделей количественных взаимосвязей «структура - токсичность» затруднено. Так, например, детальный анализ QSAR моделей острой токсичности, проведенный в [1] показал, что многие модели острой токсичности у мышей имеют ограниченное применение вследствие их скромных статистических параметров или ввиду того, что модели были построены на небольшом количестве данных. Более того, в большинстве публикаций острая токсичность коррелирует с гидрофобностью, хотя в настоящее время установлено, что таких простых корреляций для описания этого сложного явления недостаточно [2,3]. В публикации [4] нами была предложена оригинальная локальная QSAR модель Арифметическое Среднее Свойство (AСС), основанная на структурном и физико-химическом сходстве. Эта модель была успешно использована для оценки острой внутривенной токсичности на мышах [4]. В работе рассмотрены результаты детального исследования острой оральной токсичности химическими соединениями у мышей с применением АСС модели. МАТЕРИАЛЫ И МЕТОДЫ В настоящей работе использованы экспериментальные данные по острой оральной токсичности химическими соединениями у мышей из SYMYX Toxicity Database [5]. Отобранные экспериментальные значения LD50 в мг/кг живого веса были пересчитаны в log(1/LD50) (ммоль/кг) и использованы как количественная мера острой токсичности. Общее число отобранных нейтральных химических соединений составило 7490. Все эти соединения были ранжированы по величине LD50. Каждое пятое соединение было включено в тестовую выборку. Остальные соединения были использованы в качестве обучающей выборки. Для каждого соединения было рассчитано по 214 физико-химических дескриптора. Расчеты выполнены программами VolSurf [6], HYBOT [7] и DRAGON [8]. Алгоритм создания АСС модели Шаг 1. Для каждой анализируемой молекулы из обучающего и тестового ряда определяли величину структурного сходства (в виде коэффициента Танимото, Тс) с остальными молекулами. В качестве соседей при этом выступали только молекулы обучающей выборки. Величины Тс были упорядочены по убыванию. Первичные кластеры ближайших структурных соседей, сформированы путем задания минимального (Tc,min) и максимального (Tc,max) граничного значения Тс. В настоящей работе использовали Tc,min = 0.00 и Tc,max = 1.00. Шаг 2. Для каждой молекулы рассчитывали набор из 214 дескрипторов. В результате были сформированы дескрипторные обучающая и тестовая матрицы. Шаг 3. С использованием каждого дескриптора в отдельности и первичного структурного кластера для каждой молекулы был рассчитан вторичный кластер. Из молекул первичного кластера выбирали такие пары ближайших соседей, которые имели значение дескриптора больше и меньше, чем у анализируемой молекулы. При этом использовали только одиночные дескрипторы, то есть общее число комбинаций было равно 214. Размер вторичного кластера регулировали путем задания числа молекулярных пар. В данной работе использовали 3 молекулярные пары. Шаг 4. Токсичность анализируемой молекулы рассчитывали как арифметическое среднее токсичностей молекулярных пар. Схематическое объяснение модели АСС представлено на рисунке 1. В этом примере молекулярная поляризуемость (α) используется как дескриптор для формирования вторичного кластера соседей на основе двух молекулярных пар. Анализируемое соединение (log(1/LD50) = 1.96) имеет 10 ближайших структурных соседей (первичный кластер). По сравнению с анализируемым соединением, 8 соседей имеют меньшую величину α (1 группа), а 2 соседа – большую величину α (2 группа). Для образования первой пары берется сосед с максимальным значением Тс (log(l/LD50) = 2.46, 1 группа). Ближайшим соседом из 2 группы оказывается соединение с log(l/LD50) = 3.76. Для формирования второй пары берется еще неиспользованное соединение с максимальным значением Тс (log(l/LD50) = 0.71, 2 группа). Ближайшим соседом из 1 группы оказывается соединение с log(l/LD50) = 0.30. На основе двух выбранных молекулярных пар можно оценить величину токсичности для анализируемого соединения: log(l/LD50) = (2.46 + 3.76 + 0.71 + 0.30)/4 = l.81.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В таблице 1 представлены отдельные результаты расчетов, выполненные в рамках модели АСС. Они представляют собой выборку лучших (в статистическом плане) данных, полученных при анализе 214 моделей, использующих по одному единственному дескриптору.
Попытки улучшить параметры моделей путем увеличения числа используемых дескрипторов (и, соответственно, ростом числа их комбинаций) не увенчались успехом. Тем не менее, из таблицы следует, что лучшие модели, использующие одиночные дескрипторы, имеют вполне удовлетворительные статистические параметры: коэффициенты линейной корреляции больше 0.5 и cтандартное отклонение 0.45 (в единицах log(1/LD50)). Следует отметить, что статистические характеристики полученных АСС моделей вполне соответствуют опубликованным в литературе данным с близким числом анализируемых соединений. Так, в работе [9], посвященной исследованию 8972 соединений с острой оральной токсичностью у крыс с использованием модели PASS, величины Q2(R2) находились в интервале 0.50 ÷ 0.59, а cтандартное отклонение составляло 0.56 ÷ 0.62. Таким образом, в настоящей работе установлено, что подход АСС является вполне адекватным при моделировании острой оральной токсичности по отношению к мышам в большом ряду органических соединений. Полученные регрессионные модели обладают удовлетворительными статистическими характеристиками и могут быть использованы для оценки острой токсичности новых соединений. БЛАГОДАРНОСТИ Работа выполнена в рамках государственного задания на 2018 год (тема № 0090-2017-0020). ЛИТЕРАТУРА
|