|
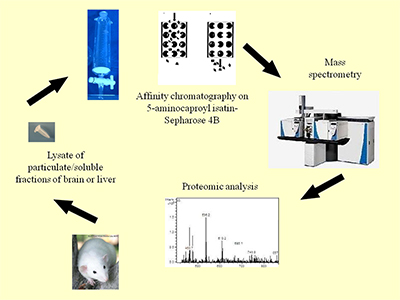
Сравнительный протеомный анализ изатин-связывающих белков печени и мозга мышей Научно-исследовательский институт биомедицинской химии имени В.Н.Ореховича (ИБМХ), 119121, Москва, Погодинская ул. 10, *e-mail: olbuneeva@gmail.com Ключевые слова: изатин, изатин-связывающие белки мозга и печени, протеомное профилирование, 5-аминокапроилизатин DOI: 10.18097/BMCRM00007 ВВЕДЕНИЕ Изатин (индол-2,3-дион) – эндогенный индол, обнаруженный в мозге, периферических тканях и биологических жидкостях человека и животных [1–4]. Обладая широким спектром биологической активности, изатин взаимодействует с многочисленными изатин-связывающими белками, многие из которых были идентифицированы в ходе протеомного профилирования препаратов мозга мышей и крыс [1, 5, 6]. Поскольку ряд обнаруженных изатин-связывающих белков играет важную роль в развитии нейродегенеративной патологии [1, 6], интерес исследователей именно к изатин-связывающим белкам мозга вполне объясним. Вместе с тем, данные биосенсорного анализа, проведенного более пятнадцати лет назад [7], свидетельствуют о существовании в мембранной и растворимой фракциях печени, почек и сердца изатин-связывающих белков, которые до сих пор не охарактеризованы. В связи с этим целью настоящего исследования было сравнительное изучение профиля изатин-связывающих белков печени и мозга мышей. МАТЕРИАЛЫ И МЕТОДЫ В экспериментах использовали бромциан-активированную сефарозу 4В, дитиотреитол, йодацетамид, трипсин, Tris(гидроксиметил)аминометан, гуанидин гидрохлорид, гидрокарбонат аммония, натрий хлористый, Triton Х-100, ацетонитрил, кумасси бриллиантовый синий G-250 фирмы «Sigma-Aldrich» (США); ацетат натрия, борную кислоту, муравьиную кислоту, тетраборат натрия, едкий натр – «Acros Organics» (США); модифицированный трипсин (sequencing grade) – «Promega» (США). Синтез 5-аминокапроилизатина был описан ранее [5]. Остальные ре активы были отечественного производства максимально доступной чистоты. Ковалентное связывание 5-аминокапроилизатина с бромциан-активированной сефарозой 4В осуществляли согласно стандартной методике. Количество иммобилизованного аналога изатина, оцениваемое по определяемому нами числу функциональных групп бромциан-активированной сефарозы, составляло ~ 0,2 мкмоль/мл в суспензии 1 : 1 (по объему). Дизайн эксперимента приведен на рисунке 1.
В экспериментах использовали печень и мозг самцов мышей линии C57BL/6 (вес 20–25 г) из питомника «Столбовая» (Московская область). Эти ткани измельчали и гомогенизировали в гомогенизаторе Ultra-Turrax T 10 при 10 000 об/мин в 0.05 М калий-фосфатном буфере, рН 7.4, для получения 30% гомогената. Выделение мембранной и растворимой фракций гомогената печени и мозга мыши и их последующую обработку для осуществления этапа аффинной хроматографии проводили в соответствии с разработанной ранее методикой [6]. Сначала гомогенаты этих органов центрифугировали 5 мин при 500 g для удаления дебриса. Надосадочную жидкость далее центрифугировали 60 мин при 16000 g, обрабатывая растворимую и мембранную фракции тритоном Х-100 раздельно. Осадок (мембранную фракцию) сначала суспендировали в 0.05 М калий-фосфатном буфере (рН 7.4) до конечной концентрации 30 мг/мл. После добавления тритона Х-100 (конечная концентрация 3%), инкубации в течение 60 мин при 4oC и последующего трехкратного разведения тем же фосфатным буфером пробы центрифугировали при 16000 g в течение 30 мин для получения осветленной надосадочной жидкости. Растворимую фракцию гомогената мозга или печени (концентрация белка около 30 мг/мл) инкубировали с 3% тритоном Х-100 и центрифугировали аналогичным способом. Аффинную хроматографию на 5-аминокапроилизатинсефарозе для последующего масс-спектрометрического анализа проводили так же, как описано ранее [6]. Осветлённые при помощи центрифугирования лизаты мембранной и растворимой фракций гомогенатов печени и мозга (концентрация белка примерно 10 мг/мл) добавляли к суспензии 5-аминокапроил-сефарозы (1:1) и инкубировали 2 ч при 4oC и медленном перемешивании. Аффинный сорбент промывали 100 объемами буфера для удаления неспецифически связавшихся белков, после чего остальные белки элюировали с использованием колонки (1 х 2 см) при комнатной температуре сначала 30 мл 1 мМ изатина в 0.05 М фосфатном буфере (рН 7.4), потом тем же объемом 1 М NaCl в 0.05 М фосфатном буфере (рН 7.4). Элюат (30 мл) концентрировали до 0.25 мл при помощи центрифужного устройства Amicon Ultra («Millipore», США). Белки экстрагировали смесью хлороформ-метанол [8], восстанавливали 20 мМ дитиотреитолом в 6 М хлориде гуанидина (рН 6.8) при 37°С в течение 60 мин; после карбкосиметилирования сульгидрильных групп 0.17 мМ йодоацетамидом (37oС, 60 мин) и повторной хлороформно-метанольной экстракции осадок белков растворяли в 50 мМ бикарбонате аммония и подвергали трипсинолизу (сначала 1мкг трипсина/100 мкг белка, 37oС, 60 мин; потом 2 мкг/100 мкг белка, 37oС, в течение ночи) [9]. Реакцию останавливали муравьиной кислотой (конечная концентрация 0.1%). Пробы выпаривали при помощи вакуумного концентратора 5301 («Eppendorf» Германия), растворяли в 0.1% муравьиной кислоте и анализировали при помощи LC-MS/MS. Для определения неспецифически связывающихся с аффинным сорбентом белков использовали контрольную бромциан-активированную сефарозу, которую подвергали тем же процедурам, что и 5-аминокапроилизатинсефарозу, но без добавления аффинного лиганда. Масс-спектрометрический анализ осуществляли с использованием интегрированной чиповой колоночной системы высокоэффективного жидкостного разделения пептидов Infinity 1290 («Agilent», США) в микропотоковом режиме. Хроматографическое разделение пептидов проводили на аналитической колонке с обращенной фазой (Zorbax RRHD «Agilent», длина колонки 100 мм, диаметр 2.1 мм, размер частиц 2.8 мкм) в линейном градиенте элюции подвижной фазы А (0.1%-ый водный раствор муравьиной кислоты) и подвижной фазы Б (80%-ый ацетонитрил, 0.1%-ая муравьиная кислота) от 2 до 60% при скорости потока 0.3 мл/мин в течение 60 минут с последующим уравновешиванием хроматографической системы в начальных условиях градиента (А : Б = 2 : 98) в течение 5 мин. Масс-спектрометрический анализ проводили на квадрупольном времяпролётном масс-спектрометре Agilent 6550 («Agilent») в режиме положительной ионизации. Сканирование тандемных спектров осуществляли в режиме автоматической селекции пяти доминантных пиков прекурсорных ионов, зарегистрированных при m/z = 400–1300. Напряжение на входе капилляра составляло 3900 В, скорость потока осушающего газа (азот) — 14 л/мин, температура осушающего газа — 280oС, скорость потока фокусирующего газа 11 л/мин, температура фокусирующего газа – 320oС. Время одного полного цикла сканирования не более 1.079 с. Отбирали 4 сигнала наиболее интенсивных ионов с последующим тандемным сканированием не более 10 спектров фрагментации. Для снижения избыточного сигнала использовали режим активного исключения прекурсорных пиков после трех регистраций в течение не более 20 с. Анализ масс-спектрометрических данных с последующей идентификацией белков проводили с использованием пакетного программного обеспечения Spectrum Mill MS Proteomics Workbench Rev B.04.01.141 («Agilent»). Белки идентифицировали сравнительным анализом экспериментально зарегистрированного масс-спектрометрического сигнала с базой данных белков мыши (Mus musculus) Swiss Prot/Uniprot. Для экстракции сигнала и его последующей обработки использовали следующие параметры: фермент протеолитического расщепления – трипсин; максимально допустимое количество внутрипептидных лизинов или аргининов не более 1; допустимая погрешность измерения моноизотопной массы пептида ± 0.01 Да, допустимая погрешность измерения фрагментного иона ± 0.05 Да. В качестве фиксированной химической модификации выбирали карбамидометилирование аминокислотных остатков цистеина, в качестве лабильной модификации – окисление метионина. Сигнал считали истинно-положительным и белок идентифицированным в случае идентификации как минимум двух протеотипических пептидов, принадлежащих к одному белку, с индексом достоверности для каждого пептида более 7,0, а для всего белка не менее 13 [15]. Ложно-позитивный сигнал проверяли через δ-коэффициент достоверности при поиске экспериментальных данных против базы данных случайно сгенерированных пептидных последовательностей. Для истинно-позитивного сигнала δ-коэффициент должен превышать 2.0. В каждом протеомном эксперименте использовали суммарные препараты, полученные в ходе аффинного обогащения растворимой и мембранной фракций гомогенатов мозга или печени не менее 2 мышей. Каждый из представленных в таблицах белков был идентифицирован, по меньшей мере, в трех независимых экспериментах. РЕЗУЛЬТАТЫ В соответствии с результатами наших предыдущих исследований с использованием 5-аминокапроилизатина в качестве аффинного лиганда [6, 10] в ходе аффинного разделения изатин-связывающих белков растворимой и мембранной фракций гомогенатов мозга мыши, лизированных тритоном Х-100, было идентифицировано менее не менее 60 индивидуальных белков, специфически связывающихся с 5-аминокапроилизатинсефарозой (см. Приложение, табл. 1S). Аналогичное разделение фракций гомогената печени мыши в ходе аффинной хроматографии позволило идентифицировать 80 белков (см. Приложение, табл. 2S). При визуальной экспертной оценке все идентифицированные белки печени и мозга принадлежали к следующим функциональным группам: (I) Метаболизм углеводов и генерация энергии; (II) Метаболизм липидов; (III) Метаболизм нуклеотидов и аминокислот; (IV) Формирование цитоскелета, экзоцитоз; (V) Регуляция экспрессии генов, клеточного деления и дифференцировки; (VI) Антиоксидантные и протекторные белки; (VII) Передача сигнала и регуляция активности ферментов. При этом общее число изатин-связывающих белков, совпадающих для мозга и печени, было невелико - всего 12 (табл. 1).
Наиболее число общих для мозга и печени изатин-связывающих белков обнаружено в группе VI (aнтиоксидантные и протекторные белки), полное отсутствие совпадений – в группе II (метаболизм липидов) и группе IV (формирование цитоскелета, экзоцитоз). В таблице 2 приведена функциональная аннотация, клеточная локализация и молекулярные функции идентифицированных изатин-связывающих белков, охарактеризованные ресурсами Gene Ontology.
Следует отметить, что изатин-связывающие белки были обнаружены не только среди белков, представленных в клетке в относительно высоких концентрациях (белки, участвующие в формировании цитоскелета, белки теплового шока и др.), но также и среди белков, концентрациях которых в клетке значительно ниже [11]. Интересно, что изатин-связывающие белков мозга и печени сильно различались и по представленности в выделенных функциональных группах. Так, в мозге количество изатин-связывающих белков в каждой группе уменьшалось в следующем порядке: I > IV ≥ V > VII >VI ≥ III >> II; для печени порядок уменьшения числа изатин-связывающих белков в группах был иным: V > III ≥ I > II = VI > IV >> VII (табл. 1). ОБСУЖДЕНИЕ Изатин (индолдион-2,3) – эндогенный индол, содержащийся в мозге, периферических тканях и биологических жидкостях млекопитающих [1-4]. Интерес исследователей к изатину связан с потенциальным фармакологическим эффектом как самого изатина, так и его многочисленных аналогов [12-15]. В этом контексте детальный протеомный анализ изатин-связывающих белков будет способствовать не только лучшему пониманию функций изатина в организме, но и идентификации конкретных биологических мишеней, обусловливающих различные ответы на введение аналогов изатина. Из-за отсутствия у изатина функциональных групп, необходимых для ковалентного связывания с носителем без потери его биологической активности, использование в качестве аффинных лигандов химических производных этого соединения представляет собой необходимый шаг в процессе выделения изатин-связывающих белков и последующего протеомного анализа. На сегодняшний день для протеомного профилирования изатин-связывающих белков используются два аналога изатина: 5-аминокапроилизатин (N-(6-аминокапроил)-5-аминоизатин) и 5-аминоизатин [5, 6, 10]. Недавно проведенное сравнительное исследование протеомных профилей изатин-связывающих белков мозга, выделенных при помощи обоих аналогов изатина, показало, что число идентифицированных белков мозга было выше при использовании более короткого аналога изатина [10]. Это свидетельствует о том, что длина вставки между аминогруппой, используемой для пришивки аффинного лиганда к сефарозе, и собственно изатином оказывает существенное влияние на результаты протеомного профилирование изатин-связывающих белков. Учитывая тот факт, что основные количественные различия протеомных профилей были обусловлены преобладанием белков, участвующих в формировании цитоскелета и экзоцитозе, в данной работе для сравнительного изучения профиля изатин-связывающих белков печени и мозга мышей был использован более длинный (и гибкий) аналог изатина. Полученные результаты свидетельствуют о том, что при использовании 5-аминокапроилизатина в качестве аффинного лиганда в печени выявляется больше 60 индивидуальных белков (80), чем в мозге (63). Незначительное число белков, общих для печени и мозга (12), свидетельствует о высокой тканевой специфичности потенциального взаимодействия изатина со своими мишенями. На сегодняшний день известно всего несколько белков-мишеней изатина, активность которых изменяется (снижается) в присутствии физиологических концентраций этого индола [1]. Для подавляющего большинства идентифицированных изатин-связывающих белков (особенно ферментов) функциональное значение взаимодействия с изатином остается неясным. С учетом появляющихся данных о влиянии изатина на различные белок-белковые взаимодействия [16-18], различия в профиле изатин-связывающих белков мозга и печени могут свидетельствовать об участии идентифицированных белков в различных (суб)интерактомах. Нельзя исключить также, что обнаруженные различия в профиле изатин-связывающих белков, по-видимому, играют важную роль в специфических эффектах изатина в определенных органах. БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы (протеомный анализ изатин-связывающих белков). Масс-спектрометрический анализ белков выполнен в ЦКП «Протеом человека» при ИБМХ, поддержанном Минобрнауки РФ в рамках соглашения № 14.621.21.0017 (идентификатор RFMEFI62117X0017). ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00007) на сайте журнала. ЛИТЕРАТУРА
|